Compte rendu du webinaire de l'EACVI
Contexte
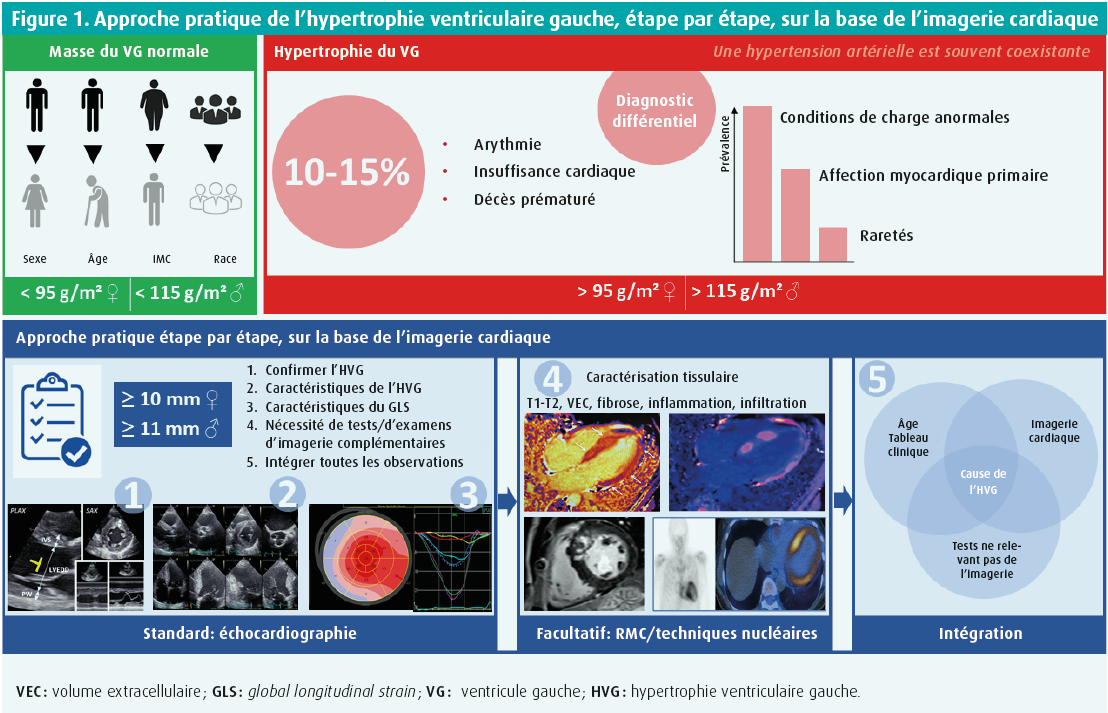
Chez les sujets en bonne santé, la masse myocardique du ventricule gauche est déterminée par quatre facteurs majeurs : le sexe, l'âge, le poids et l'origine ethnique. En effet, on observe une masse ventriculaire gauche relativement plus importante chez les hommes, à un âge plus jeune, en cas de poids corporel plus élevé et dans la race noire. Cependant, l'hypertrophie ventriculaire gauche (HVG) englobe une augmentation anormale de la masse ventriculaire gauche consécutive à une affection myocardique primaire ou secondaire à des conditions de charge anormales (surcharge de pression et/ou de volume). Cette anomalie s'observe chez 10 à 15 % de la population mondiale et elle augmente avec l'âge, souvent en raison de l'accumulation de comorbidités. L'HVG est intrinsèquement associée à un risque accru de troubles du rythme, d'insuffisance cardiaque et de décès prématuré. Un diagnostic correct et un traitement étiologique sont donc cruciaux.
Le diagnostic différentiel de l'HVG est vaste (figure 1), mais deux observations permettent déjà une première approche pratique. Tout d'abord, ce qui est fréquent est fréquent. La majorité des cas d'HVG s'explique par des conditions de charge anormales (pression et/ou volume). L'hypertension, l'obésité, le diabète de type 2, une sténose ou une insuffisance valvulaire et le coeur d'athlète figurent donc en tête de la liste des diagnostics différentiels. Si ce n'est pas le cas, nous pensons aux affections cardiaques primaires, essentiellement représentées par la cardiomyopathie hypertrophique (CMH) primaire, la cardiomyopathie amyloïde infiltrative et les affections myocardiques inflammatoires. Si elles ont pu être exclues, on peut penser - surtout en fonction de l'âge et du tableau clinique (éventuellement syndromique) - à des affections métaboliques, neuromusculaires ou mitochondriales plus exceptionnelles, à une affection maligne, une toxicité médicamenteuse ou des syndromes malformatifs. Deuxièmement, l'hypertension artérielle systémique est une comorbidité fréquente. L'hypertension a une prévalence élevée en fonction de l'âge, et elle touche même plus de 60 % des sujets de plus de 60 ans. Ceci implique que l'hypertension est souvent coexistante, mais qu'elle n'explique pas toujours l'hypertrophie. La vigilance s'impose, assurément en cas d'hypertrophie modérée à importante, disproportionnée par rapport à une hypertension qui n'est souvent que de grade 1 ou 2. Il s'agit d'un piège important en pratique de routine.
Approche pratique, étape par étape
L'échocardiographie est la première méthode d'imagerie pour le diagnostic (différentiel) de l'HVG, et elle peut être complétée par des examens d'imagerie supplémentaires ou d'autres tests, si nécessaire. Une approche pratique consiste à procéder étape par étape (figure 1).
Étape 1 : confirmation de l'hypertrophie ventriculaire gauche
De manière standard, l'épaisseur de la paroi du ventricule gauche (en mm) est mesurée sur la base d'une image bidimensionnelle en mode B en vue parasternale grand axe et petit axe. Le septum interventriculaire (SIV) et la paroi postérieure (PW, posterior wall) sont mesurés perpendiculairement à l'axe du ventricule gauche au niveau des extrémités des feuillets de la valve mitrale. En vue petit axe (basal, moyen et apical), nous confirmons les valeurs anormales éventuelles et recherchons surtout une hypertrophie supplémentaire, non visible en vue parasternale grand axe. L'hypertrophie peut en effet se produire dans un nombre limité de segments, non visibles en vue grand axe. Une épaisseur de paroi ≥ 10 mm chez les femmes et ≥ 11 mm chez les hommes est définie comme une hypertrophie.1 Pour la détermination de l'HVG légère, modérée et sévère, il existe des valeurs seuils différentes selon le sexe. Cependant, l'épaisseur pariétale est souvent surestimée à l'échographie suite à l'inclusion du faisceau modérateur ventriculaire droit, des muscles papillaires du ventricule gauche, des trabécules ou de ponts musculaires supplémentaires. Ceci peut conduire à un (sur)diagnostic erroné d'HVG.
En outre, la masse du ventricule gauche (en g/m²) peut également être estimée, notamment en utilisant la formule du Cube linéaire basée sur le diamètre télédiastolique du ventricule gauche, l'épaisseur de la PW et du SIV. La marge d'erreur est considérable, parce que ces paramètres sont élevés à la troisième puissance et qu'ils ne sont pas précis dans des ventricules dilatés ou asymétriquement hypertrophiés. Les mesures bi- ou tridimensionnelles s'approchent mieux de la masse réelle, mais sont moins validées sur le plan échographique. Une masse ventriculaire gauche > 95 g/m² chez les femmes et > 115 g/m² chez les hommes est considérée comme une HVG.1
L'utilisation de la résonance magnétique cardiaque (RMC) peut apporter une valeur ajoutée au diagnostic de l'HVG en cas d'hypothèse clinique spécifique. Tout d'abord, la résolution spatiale plus élevée contribue à une mesure plus correcte de l'épaisseur de la paroi (moins de sur- ou sous-estimation). Deuxièmement, toutes les zones ventriculaires peuvent être visualisées ; une HVG localisée au niveau du ventricule droit et de la paroi inférieure du ventricule gauche, par exemple, passe souvent inaperçue à l'échocardiographie. Enfin, la RMC est la référence pour l'évaluation de la masse ventriculaire gauche.
Étape 2 : caractéristiques de l'hypertrophie ventriculaire gauche
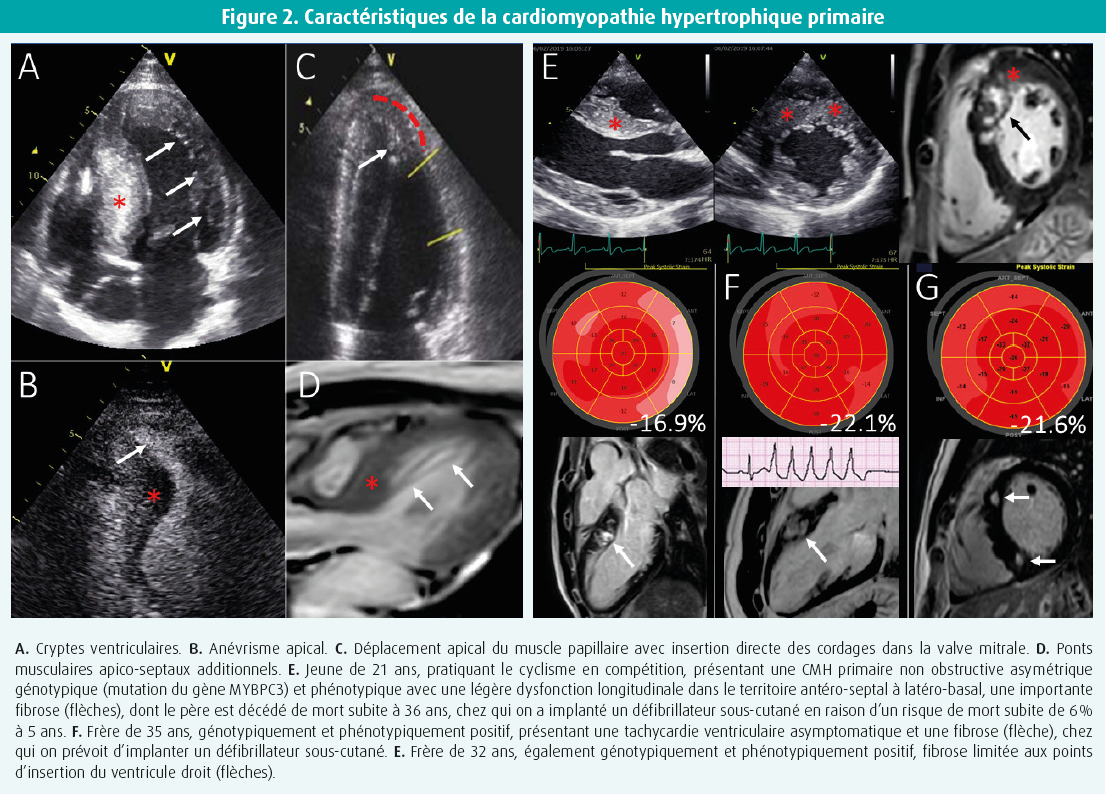
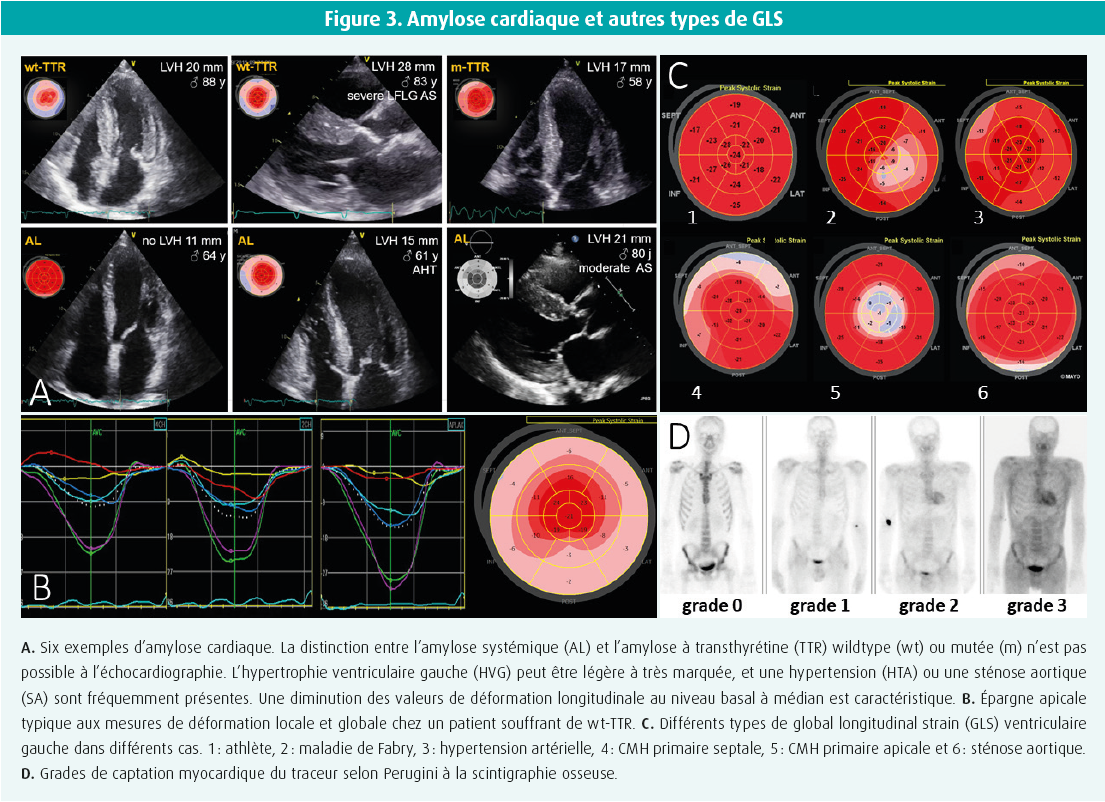
Une fois que le diagnostic d'HVG a été confirmé avec certitude, nous nous concentrons sur le diagnostic différentiel de la cause sous-jacente. À l'étape 2, nous nous concentrons sur les anomalies structurelles, principalement la sévérité, l'étendue, la localisation et la symétrie de l'HVG, ainsi que sur d'éventuelles anomalies structurelles plus spécifiques de la cause. Une surcharge de pression telle qu'on l'observe en cas d'hypertension ou de sténose aortique commence souvent par une hypertrophie du septum basal, due à la tension pariétale maximale locale, pour évoluer vers une hypertrophie plus concentrique et symétrique de tout le ventricule gauche. De même, le diabète, l'obésité et le coeur d'athlète entraînent généralement une hypertrophie ventriculaire plutôt symétrique. Dans le coeur d'athlète, la symétrie est le mot clé : un remodelage structurel et fonctionnel symétrique à droite et à gauche est la règle, et la forme physique ne peut en aucun cas être utilisée comme critère d'inclusion ou d'exclusion pour différencier cet état d'une pathologie. Une épaisseur pariétale de 12-16 mm ne se produit que chez 2-3 % des athlètes blancs et jusqu'à 8 % des athlètes noirs, mais des épaisseurs > 16 mm sont toujours pathologiques.2 La cardiomyopathie hypertrophique (CMH) primaire, qui touche 1 personne sur 500, comprend dans la grande majorité des cas une hypertrophie asymétrique légère à sévère limitée à 1-2 segments (12 %), 3-7 segments (34 %) ou ≥ 8 segments (54 %).3 De plus, au moins les segments antéro-septal et antérieur sont impliqués dans 75 % des cas, et une hypertrophie ventriculaire droite simultanée peut s'observer dans 30 % des cas. Dans cette affection sarcomérique sous-jacente, nous recherchons également des indices structurels supplémentaires, tels qu'une élongation des feuillets de la valve mitrale (30 %), des anomalies des muscles papillaires telles qu'un déplacement apico-médial (75 %), des muscles papillaires accessoires (50 %) ou une insertion directe des cordages dans les feuillets valvulaires, voire dans la chambre de chasse. On peut même observer des cryptes myocardiques, des anévrismes apicaux et des faisceaux musculaires apico-septaux supplémentaires (figure 2). De telles anomalies sont parfois plus clairement détectées par la RMC. Les myopathies infiltratives se manifestent généralement par une hypertrophie symétrique et souvent biventriculaire, bien qu'une hypertrophie asymétrique éventuellement couplée à une obstruction de la chambre de chasse ne soit pas rare. Il faut donc penser à une myopathie infiltrative en cas de nouveau diagnostic présumé de CMH primaire chez des sujets de plus de 60 ans. L'hypertrophie peut être légère ou très prononcée, mais la caractérisation entre l'amylose AL systémique ou l'amylose à transthyrétine n'est pas possible sur la base de l'échocardiographie (ou d'une autre imagerie) (figure 3). L'amylose cardiaque à transthyrétine n'est assurément pas rare, et elle est fréquemment observée en association à une sténose aortique dans 6 % des interventions chirurgicales sur la valve aortique, 15 % des remplacements percutanés de la valve aortique et jusqu'à 30 % des sténoses aortiques à faible débit et faible gradient.
Étape 3 : caractéristiques du global longitudinal strain
Après la caractérisation structurelle, l'étape suivante consiste à se concentrer sur les anomalies fonctionnelles. La déformation systolique longitudinale représente le pourcentage de raccourcissement des fibres musculaires dans le sens longitudinal pendant la systole, qui est principalement déterminé par la couche sous-endocardique des fibres myocardiques dans le ventricule gauche. Elle peut facilement être déterminée en pratique en appliquant la technique du speckle tracking bidimensionnel en vue 2, 3 et 4 cavités lors de l'échocardiographie. La valeur moyenne des 17 segments myocardiques est appelée déformation longitudinale globale (GLS) et est représentée en code couleur dans un bull's eye plot à 17 segments, où les valeurs individuelles des segments sont également visualisées (figure 3). Il existe un gradient normal avec des valeurs plus élevées pour l'apex, le milieu et la base. La valeur normale du GLS du ventricule gauche atteint environ 20 %. Des valeurs plus négatives indiquent un raccourcissement plus important et donc une meilleure fonction. Le GLS du ventricule gauche est une mesure très sensible de la fonction ventriculaire, qui diminue souvent bien avant que la fraction d'éjection ne diminue, et qui est invariablement corrélée aux critères d'évaluation cliniquement pertinents. En pratique, nous évaluons la valeur globale du GLS, la configuration des bull's eye plots et les valeurs de déformation localisées des segments hypertrophiés.
Tout d'abord, la valeur globale du GLS est évidemment déterminée par le stade de la maladie, la durée de la pathologie et la sévérité de l'hypertrophie. En effet, les principaux déterminants du GLS sont 1) la contractilité intrinsèque du myocarde, 2) la charge (pression ou volume), 3) la géométrie (hypertrophie et dilatation) ainsi que 4) les caractéristiques tissulaires, notamment la fibrose locale ou diffuse. L'hypertension, le diabète et l'obésité entraînent généralement une diminution légère à modérée de la valeur du GLS. Les athlètes ont une valeur normale à légèrement diminuée au repos, mais ils évoluent vers des valeurs normales à supranormales à l'effort (réserve contractile). La sténose aortique peut s'associer à une diminution légère, modérée ou sévère en fonction de la sévérité et de la durée de la sténose valvulaire. Dans la CMH primaire, la valeur globale du GLS dépend souvent du nombre et du grade des segments hypertrophiés, et de la fibrose myocardique. Dans l'amylose cardiaque, nous trouvons souvent une diminution modérée à sévère du GLS global.4
Le type de GLS et les valeurs de déformation locale (par segment myocardique) s'avèrent souvent utiles en pratique (figure 3). En cas d'hypertension et de sténose aortique, on remarque généralement une diminution légère à modérée dans les segments septaux basaux, où se produit la plus grande tension pariétale. Dans la CMH primaire, les valeurs de déformation locale sont souvent modérément à sévèrement diminuées, typiquement dans les segments les plus hypertrophiés.4 Étant donné qu'initialement, la fibrose se développe souvent localement dans le territoire postéro-latéral en cas de maladie de Fabry, on observe une diminution de la déformation locale à cet endroit. Dans le cas d'une cardiomyopathie infiltrative comme l'amylose, nous observons souvent un tableau caractéristique d'épargne apicale : préservation de la valeur de déformation dans le territoire apical, mais diminution modérée à très sévère dans les segments médians et basaux.4 Un tel tableau peut parfois aussi s'observer en cas de maladie de Danon ou de sténose aortique sévère, mais il faut toujours exclure une amylose.
En dehors du GLS, d'autres anomalies fonctionnelles peuvent également être évaluées. Le mouvement systolique antérieur (SAM) décrit le mouvement systolique typique du feuillet mitral antérieur (éventuellement allongé) vers le septum, ce qui peut contribuer à la création d'un gradient de pression ou à l'obstruction de la chambre de chasse, avec ou sans insuffisance mitrale fonctionnelle. L'obstruction de la chambre de chasse se produit chez 70 % des patients atteints de CMH primaire, environ 40 % au repos et 30 % à l'effort, et est mieux mise en évidence par l'échocardiographie d'effort que par un test de Valsalva.5 Cependant, une hypertrophie septale majeure, telle qu'elle est observée dans l'hypertension, la sténose aortique et même la cardiomyopathie infiltrative, peut aussi parfois générer une obstruction de la chambre de chasse et/ou un SAM.
Étape 4 : caractérisation tissulaire et autres tests
En cas de doute ou de besoin de confirmation de la cause présumée de l'HVG, une imagerie cardiaque additionnelle peut être indiquée. Ici, la RMC offre une valeur ajoutée pratique par rapport à l'échocardiographie en permettant une caractérisation plus poussée des tissus grâce à des séquences d'imagerie spécifiques. Quatre paramètres sont importants6 (figure 4). 1) Les clichés en pondération T2 (constante de temps T2 représentant la décroissance de l'aimantation transversale) permettent d'identifier un oedème myocardique intra- ou extracellulaire, car la présence d'eau dans le tissu allonge le temps de relaxation T2 avec une intensité de signal proportionnelle à la teneur en eau. Les altérations T2 locales peuvent être visualisées, mais aussi les altérations globales, sur la base d'une cartographie T2 paramétrique avec code couleur. Par exemple, en cas d'hypertrophie due à des affections inflammatoires telles qu'une myocardite ou la sarcoïdose, le temps T2 va augmenter. 2) Les clichés en pondération T1 natifs (constante de temps T1 représentant la récupération de l'aimantation longitudinale) sont déterminés sans administration de contraste (natif), ce qui constitue un avantage majeur. Le temps de relaxation T1 est spécifique du tissu et change en fonction du contenu moléculaire du tissu. Il est donc fortement influencé par les affections myocardiques telles que la fibrose, l'inflammation, l'oedème et une pathologie infiltrative, ce qui aide au diagnostic différentiel. La cartographie T1 native peut également être réalisée avec des valeurs normales en fonction de la puissance locale de l'aimant (Tesla) et des paramètres de la séquence d'impulsions. 3) La mesure du volume extracellulaire (VEC) est effectuée sur la base de la comparaison des valeurs de relaxation T1 avant et après l'administration du contraste entre le myocarde et le pool sanguin du ventricule gauche, corrigée pour l'hématocrite (valeur normale jusqu'à 25 %). Le compartiment extracellulaire comprend le liquide, le collagène, l'élastine, les fibrilles et les glycoprotéines. L'expansion du compartiment extracellulaire est souvent causée par une fibrose diffuse et constitue donc une mesure de cette dernière, bien qu'une pathologie infiltrative puisse également provoquer une forte augmentation du VEC. 4) Enfin, le rehaussement tardif du gadolinium (LGE) est une technique lors de laquelle l'accumulation extracellulaire du gadolinium est visualisée environ 10 minutes après l'administration du contraste. L'augmentation de l'intensité du signal indique la présence d'une expansion locale du compartiment extracellulaire, généralement une mesure de la fibrose focale. On distingue les profils de LGE ischémiques (sous-endocardiques et dans le territoire de perfusion coronaire) et non ischémiques (épicardiques, médians ou transmuraux, locaux, diffus ou mouchetés). Bien qu'aucun schéma ne soit vraiment spécifique, on observe parfois un anneau entier de fibrose sous-endocardique, ce qui est fortement suspect d'amylose cardiaque. Dans la maladie de Fabry, la fibrose locale commence souvent au milieu de la paroi jusqu'au niveau sous-épicardique dans la paroi inféro-latérale.
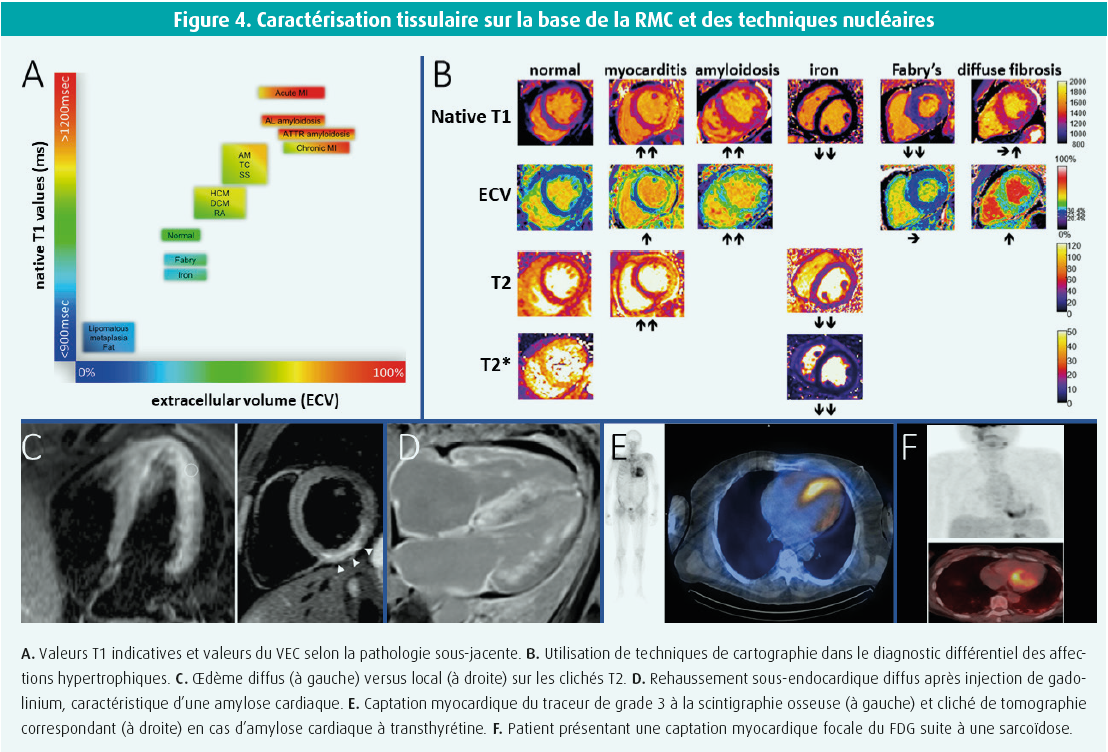
Enfin, dans une certaine mesure, les techniques nucléaires permettent aussi de caractériser les tissus. On recourt surtout à la scintigraphie osseuse avec tomographie (SPECT) lorsqu'on suspecte une amylose (figure 3). En effet, la captation myocardique du traceur est pathologique, et elle est liée aux protéines chaperons contenant du calcium, présentes à l'intérieur des fibrilles amyloïdes qui précipitent. Comparativement au tissu squelettique environnant, la captation myocardique du traceur peut être nulle (grade 0 de Perugini), moindre (grade 1), égale (grade 2) ou plus élevée (grade 3). Important : la combinaison d'une captation myocardique de grade 2 ou 3 et d'une exclusion d'une monoclonalité sur le sang et l'urine a une spécificité proche de 100 % pour une amylose à transthyrétine, équivalente à la biopsie. Cependant, l'absence de captation myocardique du traceur n'exclut jamais l'amylose. En présence d'une monoclonalité et/ou d'une captation de grade 1, une imagerie complémentaire et/ou une biopsie sont indiquées pour exclure avec certitude une amylose cardiaque de type AL systémique.
Enfin, la tomographie par émission de positrons au fluorodésoxyglucose (FDG-PET), éventuellement combinée à un CT scan, peut s'utiliser en cas de suspicion d'affections hypertrophiques dues par exemple à une myocardite, une sarcoïdose ou une affection maligne. Une préparation diététique correcte est essentielle pour supprimer la captation physiologique du FDG dans le myocarde. En effet, la captation du FDG dans le myocarde se produira alors principalement au niveau des zones présentant un métabolisme du glucose accru, telles que les tumeurs malignes, les inflammations ou les infections.
Étape 5 : intégration de toutes les observations
À la dernière étape, nous essayons d'intégrer les anomalies structurelles et/ ou fonctionnelles détectées à l'imagerie cardiaque (échocardiographie, RMC, scintigraphie) avec le tableau clinique, essentiellement, en complétant éventuellement le bilan par des tests ciblés ne reposant pas sur l'imagerie. Ainsi, l'âge du patient, ses antécédents familiaux et son tableau clinique seront souvent déterminants dans le diagnostic différentiel. Une anamnèse spécifique des systèmes pour les anomalies neurologiques, musculosquelettiques, mentales, autonomes ou autres, par exemple, est donc essentielle. Ainsi, la maladie de Danon est plus susceptible de toucher les adolescents. Les cardiomyopathies infiltratives, métaboliques ou inflammatoires sont le plus souvent des maladies systémiques. L'amylose cardiaque à transthyrétine est par exemple souvent associée à des antécédents de syndrome du canal carpien et/ou d'une sténose du canal lombaire. Des tests supplémentaires ne reposant pas sur l'imagerie, comme un ECG au repos, des tests fonctionnels neuromusculaires et éventuellement des examens biochimiques, génétiques ou histologiques supplémentaires ciblés peuvent compléter le puzzle pour parvenir à un diagnostic final.
Références
- Lang, R.M., Badano, L.P., Mor-Avi, V., Afilalo, J., Armstrong, A., Ernande, L. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2015, 16, 233-70.
- Basavarajaiah, S., Wilson, M., Whyte, G., Shah, A., McKenna, W., Sharma, S. Prevalence of hypertrophic cardiomyopathy in highly trained athletes: relevance to preparticipation screening. J Am Coll Cardiol, 2008, 51, 1033-1039.
- Maron, M.S., Maron, B.J., Harrigan, C., Buros, J., Gibson, C.M., Olivotto, I. et al. Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular magnetic resonance. J Am Coll Cardiol, 2009, 54, 220-228.
- Cikes, M., Sutherland, G.R., Anderson, L.J., Bijnens, B.H. et al. The role of echocardiographic deformation imaging in hypertrophic myopathies. Nat Rev Cardiol, 2010, 7, 384-396.
- Maron, M.S., Olivotto, I., Zenovich, A.G., Link, M.S., Pandian, N.G., Kuvin, J.T. et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation, 2006, 114, 2232-2239.
- Messroghli, D.R., Moon, J.C., Ferreira, V.M., Grosse-Wortmann, L., He, T., Kellman, P. et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI). J Cardiovasc Magn Reson, 2017, 19, 75.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.