ESC-congresverslag
Tijdens het ESC-congres 2022 in Barcelona werd een satellietsymposium georganiseerd onder leiding van Ileana Pina (Philadelphia, VS) en Javed Butler (Jackson, VS). Ileana Pina stelde een klinische casus voor van een 72-jarige man, sinds 2 jaar bekend met hartfalen met verminderde ejectiefractie (HFrEF) op ischemische basis, die jarenlang stabiel was maar recent toenemende hartfalensymptomen vertoont. Ondanks het opdrijven van perorale diuretica moest hij worden opgenomen in het ziekenhuis met acute congestie waarvoor IV diuretica nodig was.
Verslechtering van hartfalen: een kantelpunt in het hartfalentraject
Voor patiënten is een eerste episode van verslechtering van het hartfalen vaak de voorbode van een cyclus van terugkerende events. Een nieuw hartfalenevent is bovendien geassocieerd met een slechtere prognose. In een Amerikaans register van ruim 11 000 hartfalers werd 56 % van de patiënten binnen de 30 dagen heropgenomen na een verslechtering van hun toestand.1 Gemiddeld worden patiënten tweemaal heropgenomen, binnen de 2 jaar na een eerste event. In de US Pinnacle registry kwam zelfs 1 op 5 van de patiënten binnen de 2 jaar na een eerste verslechtering van het hartfalen te overlijden.1
Hoog risico ondanks optimale hartfalentherapie volgens de richtlijnen
Het residuele risico op cardiovasculaire dood of heropname wegens hartfalen binnen het jaar, in recente klinische HFrEF-trials met moderne hartfalentherapie bedraagt 10,5 % in de PARADIGM-HF, 11,6 % in de DAPA-HF en 15,8 % in de EMPEROR-Reduced.2,3,4 In DAPA-HF en EMPEROR-Reduced behaalde 16,3 % van de dapagliflozine-groep en 19,4 % van de empagliflozine-groep een primair eindpunt tijdens hun follow-up.3,4 Zelfs behandeld met de 4 moderne pijlers (ARNi, bètablokker, MRA en dapagliflozine) had 1 op 7 van de patiënten een hartfalenevent in de DAPA-HF-studie.3 Ileana Pina en Javed Butler benadrukken dat het belangrijk is dit risico te bespreken met de patiënt, familie en mantelzorgers om hen te motiveren tot leefstijlaanpassingen en de therapietrouw te verbeteren.
Welke pathways aanpakken met hartfalentherapie: huidige en toekomstige strategieën
De pathofysiologische pathways die met de huidige therapie worden aangepakt zijn ten eerste neurohumorale modulatie met stimulatie van het sympathische zenuwstelsel en RAAS-systeem (ACE-inhibitoren, ARB's, ARNi, bètablokkers en MRA-antagonisten). Ten tweede cardiorenale en metabole modulatie met SGLT2-inhibitoren (natriurese, diurese, inflammatie en fibrose, glycosurie). Een derde mogelijke pathway is de NO-sGC-cGMP signaling pathway. Oxidatieve stress en endotheeldisfunctie verminderen de biologische beschikbaarheid van NO en dit leidt tot ventriculaire en vasculaire disfunctie en draagt zo bij tot het hartfalen. Het direct stimuleren van sGC door middel van vericiguat kan de NO signaling pathway normaliseren met een gunstig effect op het hart (minder inflammatie, fibrose en hypertrofie), de bloedvaten (minder inflammatie, meer vasodilatatie) en de nieren (minder fibrose, verhoogde renale bloed flow).
De sprekers Justin Ezekowitz (Edmonton, Canada) en Finn Gustafsson (Kopenhagen, Denemarken) legden 3 opties voor om de 72-jarige patiënt te behandelen: diuretica verhogen, de patiënt ontslaan met huidige therapie en poliklinische opvolging op korte termijn of bijkomende therapie in het ziekenhuis opstarten. Het publiek en de experten kiezen het laatste. De behandeling omvat het combineren van geneesmiddelen die inwerken op het RAAS-systeem (ACEi, ARB, MRA), het sympathische zenuwstelsel (bètablokker), het natriuretischpeptidesysteem (ARNi), SGLT2 (SGLT2i) en NO-sGC-cGMP (vericiguat). Een multidrug-aanpak vermindert het risico op cardiovasculaire dood en hartfalenhospitalisatie bij HFrEF-patiënten. Als de maximale optimale dosis niet goed wordt verdragen, is het aangeraden een lagere dosis van verschillende klassen geneesmiddelen te combineren in plaats van de maximale dosis van 1 geneesmiddel na te streven.
Wetenschappelijk bewijs om vericiguat te gebruiken na verslechtering hartfalen
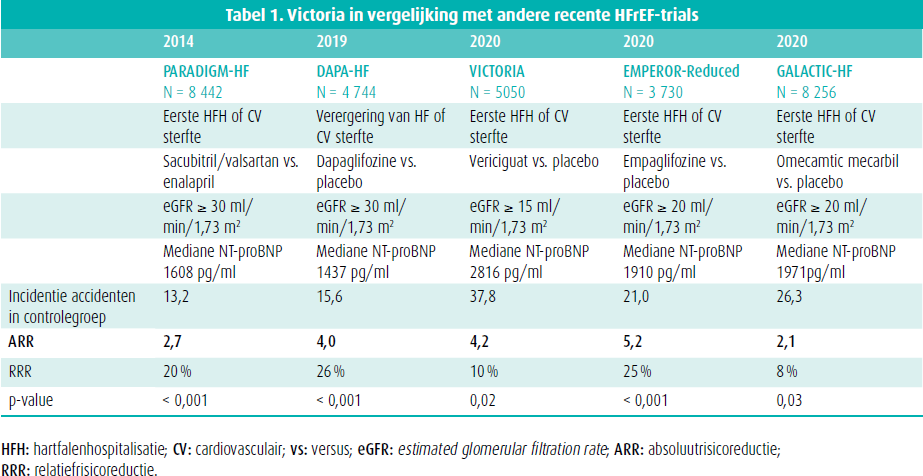
De wetenschappelijke evidentie voor het gebruik van vericiguat bij hartfalenpatiënten met ziekteprogressie komt uit de gerandomiseerde, dubbelblinde, placebogecontroleerde VICTORIA-studie.5 Deze studie includeerde patiënten met chronisch symptomatisch hartfalen (NYHA II-IV, linkerventrikelejectiefractie < 45 %) na een verslechtering van het hartfalen. Dit betekent recente decompensatie (< 3 maanden na hartfalenhospitalisatie, 3-6 maanden na hartfalenhospitalisatie, < 3 maanden na IV diuretica) en verhoogde natriuretische peptiden. Zowel opgenomen als ambulante patiënten werden gerandomiseerd maar moesten klinisch stabiel zijn (bloeddruk > 100 mmHg, IV diuretica minstens 24u stop). Daarbij werd de dosis vericiguat van 2,5 mg naar 5 mg en finaal 10 mg opgetitreerd; dit laatste werd na 12 maanden behaald in 89,2 %. Opvallend is de hoge frequentie van klinische events in de studie. Er was een duidelijke reductie van het primaire eindpunt: eerste hospitalisatie voor hartfalen of cardiovasculaire mortaliteit (HR 0,90 (95 % BI 0,82-0,98), p = 0,002). Wanneer de populatie in 4 groepen werd verdeeld volgens het baseline NT-proBNPgehalte was het primaire eindpunt significant in de laagste 3 kwartielen. In een afzonderlijke analyse was het voordeel van vericiguat ook aanwezig bij patiënten met NT-proBNP-spiegels tot 8 000 pg/ml.6 Een NT-proBNP-gehalte > 8 000 pg/ml is eerder uitzonderlijk bij ontslag uit het ziekenhuis en bij ambulante patiënten (tabel 1).
Veiligheidsprofiel van vericiguat
Het toevoegen van vericiguat na een event aan bestaande therapie bij hartfalenpatiënten met verminderde ejectiefractie werd goed verdragen. Er is ten opzichte van placebo geen significant verschil in hypotensie of syncope. Er is geen significant verschil in eGFR over de tijd. Vericiguat biedt voordeel over verschillende eGFR-groepen. Er is geen klinisch relevante impact op de ionen natrium of kalium. Er werd geen klinisch relevante bloeddrukreductie gezien in de VICTORIA-trial in kwetsbare patiënten.
Erkennen de recent aangepaste richtlijnen van de wetenschappelijke verenigingen hartfalen verslechtering als een klinische entiteit?
De ESC-hartfalenrichtlijnen uit 2021 geven aan dat vericiguat kan worden overwogen in de behandeling van hartfalenpatiënten (NYHA-klasse II-IV) met verslechterend hartfalen ondanks behandeling met ACEi/ ARNi, BB en MRA (klasse IIb-aanbeveling, level of evidence B).8 De AHA/ACC/ HFSA-richtlijnen uit 2022 verdelen stadium C symptomatisch hartfalen in een traject van de novo hartfalen, verbetering van symptomen, persisterend hartfalen en verslechterend hartfalen.9 Bij geselecteerde HFrEF-patiënten met hoog risico met een recente hartfalenverslechtering kan vericiguat worden overwogen (klasse 2b, level of evidence B-R). Verslechtering van het hartfalen dient als een afzonderlijk fenotype beschouwd te worden.
Hoe kan vericiguat worden opgestart na een verslechtering van het hartfalenevent?
In de VICTORIA-trial was het effect op het primaire eindpunt onafhankelijk van het tijdstip van het index-event.6 De patiënt moet in eerste instantie worden gestabiliseerd, ontwaterd zijn en een redelijke bloeddruk hebben. De behandeling kan vervolgens tijdens de opname in het ziekenhuis of kort nadien poliklinisch worden opgestart, volgens de plaatselijke gebruiken. Belangrijk is dat de IV diuretica minstens 24 uur zijn onderbroken en de eGFR minstens 15 bedraagt. De startdosis bedraagt 2,5 mg éénmaal per dag en wordt vervolgens om de 2 weken naar 5 mg en 10 mg respectievelijk opgedreven. Zoals door de ESC wordt aangeraden, worden patiënten best na 1-2 weken poliklinisch herbeoordeeld.8 De klinisch meest relevante combinatie die moet worden vermeden is deze met PDE-5-inhibitoren. Er is geen specifieke monitoring noodzakelijk. Het product kan worden gebruikt in gevorderd nierfalen tot een klaring van 15, vericiguat is echter niet bestudeerd in de setting van dialyse. Er zijn zeldzame gevallen van anemie gezien met een daling van de hemoglobine die stabiliseert na 16 weken gebruik van vericiguat.
In conclusie is vericiguat aanbevolen bij de behandeling van hartfalenpatiënten met verslechtering van hun toestand in combinatie met ACEi/ARNi, MRA, bètablokkers en SGLT2i.
Referenties
- Butler, J., Yang, M., Manzi, M.A., Hess, G.P., Patel, M.J., Rhodes, T., Givertz MM. Clinical Course of Patients With Worsening Heart Failure With Reduced Ejection Fraction. J Am Coll Cardiol, 2019, 73 (8), 935-944.
- McMurray, J.J., Packer, M., Desai, A.S., Gong, J., Lefkowitz, M.P., Rizkala, A.R. et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med, 2014, 371 (11), 993-1004.
- McMurray, J.J.V., Solomon, S.D., Inzucchi, S.E., Kober, L., Kosiborod, M.N., Martinez, F.A. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2019, 381 (21), 1995-2008.
- Packer, M., Anker, S.D., Butler, J., Filippatos, G., Pocock, S.J., Carson, P. et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med, 2020, 383 (15), 1413-1424.
- Armstrong, P.W., Pieske, B., Anstrom, K.J., Ezekowitz, J., Hernandez, A.F., Butler, J. et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2020, 382 (20), 1883-1893.
- Ezekowitz, J.A., O'Connor, C.M., Troughton, R.W., Alemayehu, W.G., Westerhout, C.M., Voors, A.A. et al. N-Terminal Pro-B-Type Natriuretic Peptide and Clinical Outcomes: Vericiguat Heart Failure With Reduced Ejection Fraction Study. JACC Heart Fail, 2020, 8 (11), 931-939.
- Teerlink, J.R., Diaz, R., Felker, G.M., McMurray, J.J.V., Metra, M., Solomon, S.D. et al. Cardiac Myosin Activation with Omecamtiv Mecarbil in Systolic Heart Failure. N Engl J Med, 2021, 384 (2), 105-116.
- McDonagh, T.A., Metra, M., Adamo, M., Gardner, R.S., Baumbach, A., Böhm, M. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 42 (36), 3599-3726. doi: 10.1093/eurheartj/ehab368. Erratum in: Eur Heart J, 2021, 42 (48), 4901.
- Heidenreich, P.A., Bozkurt, B., Aguilar, D., Allen, L.A., Byun, J.J., Colvin, M.M. et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol, 2022, 79 (17), e263-e421.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.