Dit artikel werd gebaseerd op de ESC-webinar 'Renal function changes in heart failure', gemodereerd door W. Mullens (Genk) met K. Damman (Groningen, NL) en D. Banerjee (Londen, VK) als sprekers. Chronische nierinsufficiëntie is een prevalent probleem bij patiënten met hartfalen, ongeacht de onderliggende ejectiefractie. De cardiale en renale functie zijn nauw met elkaar verbonden en cardiorenale interacties zorgen bijgevolg vaak voor een dilemma in de behandeling van patiënten met hartfalen. Veranderingen in de nierfunctie bij patiënten met hartfalen kunnen het gevolg zijn van zowel hemodynamische, ziektegerelateerde als medicamenteus-geïnduceerde aanpassingen. Nierfalen is een welgekende prognostische factor in patiënten met hartfalen en is geassocieerd met een verdubbeling van het mortaliteitsrisico. Desalniettemin moeten veranderingen in de nierfunctie steeds worden geïnterpreteerd in functie van de klinische context en kan misinterpretatie leiden tot een inadequate behandeling van de patiënt.1 In dit artikel wordt de evolutie van de nierfunctie van patiënten met hartfalen besproken.
Acuut hartfalen
K. Damman - Groningen, Nederland
Lisdiuretica blijven een hoeksteen in de behandeling van congestie bij patiënten met acuut hartfalen (AHF). De dosis noodzakelijk voor het bekomen van een goede diuretische respons verschilt tussen patiënten. Een ESC-consensusdocument en de huidige richtlijnen adviseren een startdosis in functie van de onderliggende nierfunctie en eventuele thuisdosis van diureticatherapie (figuur 1).2,3 Een hogere startdosis lisdiuretica is noodzakelijk in patiënten met een verminderde nierfunctie aangezien deze patiënten een relatieve diureticaresistentie met een veranderde tubulaire fysiologie hebben. Ondanks dat de DOSE-trial geen verschil kon aantonen tussen een bolus of continue infusie, wordt de voorkeur gegeven aan een bolus toediening aangezien een continue infusie een beoordeling van de diureticarespons bemoeilijkt.3,5 Een nauwe opvolging van de diureticarespons is noodzakelijk om een snelle en adequate aanpassing van de diureticatherapie mogelijk te maken.2,3
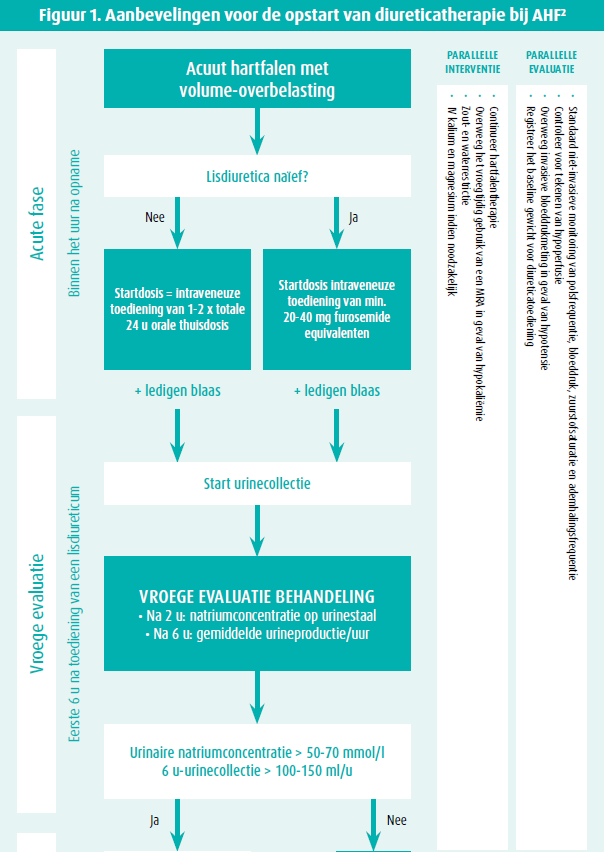
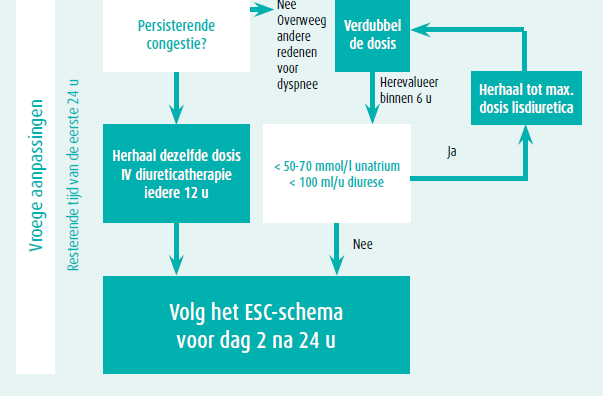
Tijdens de behandeling met intraveneuze diureticatherapie wordt vaak gevreesd voor een nierfunctie-achteruitgang. De verandering en het patroon van de nierfunctie onder diureticatherapie is echter onvoorspelbaar en kan alle richtingen uitgaan (stable, worsening or improving renal function) waarbij er geen associatie is tussen nierfunctieverandering en mortaliteit.6 Een nierfunctie-achteruitgang die groter is dan verwacht, wordt beschreven als worsening renal function (WRF) en is te verwachten bij 20-30 % van de patiënten met AHF. De etiologie van nierfunctie-achteruitgang tijdens AHF is welomschreven en is in de vroege fase vaak het gevolg van hemodynamische veranderingen, wat de combinatie is van een verminderde renale doorbloeding en veneuze congestie. Daarnaast spelen een verhoogde intra-abdominale druk (> 8 mmHg), neurohormonale activatie, inflammatie, endotheeldisfunctie en oxidatieve stress een bijkomende rol in het ontstaan van WRF. De baseline nierfunctie is de grootste voorspellende factor voor het ontstaan van WRF tijdens AHF aangezien dit een uiting is van de onderliggende renale reserve.
Als WRF ontstaat tijdens opname, dringt zich de vraag op of dit een reden moet zijn om de therapie aan te passen. Een ESC-consensusdocument van 2020 omschrijft de aanpak van WRF bij AHF (figuur 2).1
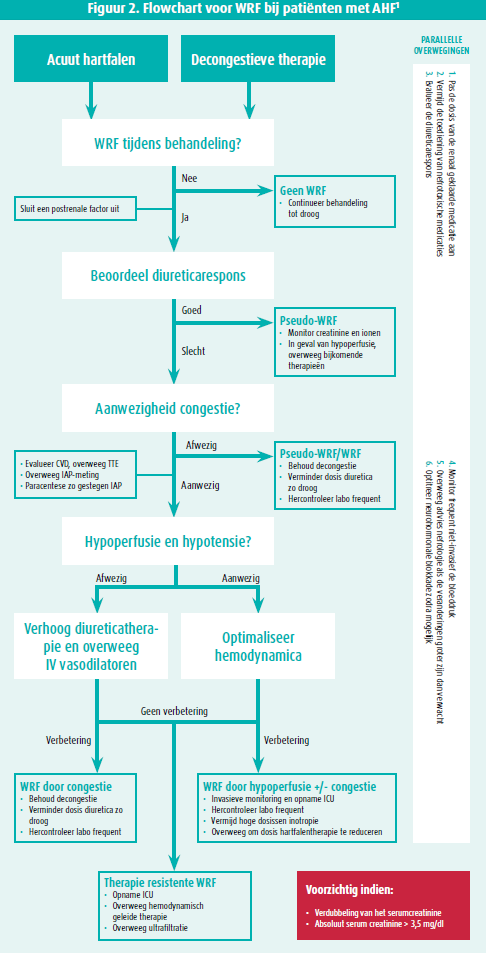
Een belangrijke nota hierbij is dat als de nierfunctie-achteruitgang onder diureticatherapie gepaard gaat met een bewaarde diurese, dit te beschouwen is als een 'pseudo-WRF' en dat dit niet geassocieerd is met een slechtere uitkomst.7 Het is dus belangrijk om steeds de renale veranderingen in functie van de klinische context te evalueren, waarbij het inschatten van de diuretische respons op de voorgrond staat. Er zijn verschillende methoden om de diuretische respons te beoordelen, maar er is steeds meer evidentie voor het gebruik van de natriumconcentratie op een spot urinestaal enkele uren na het toedienen van diureticatherapie. Als de patiënt nog tekenen van volumeoverbelasting heeft, wordt een adequate diuretische respons gedefinieerd als een urinaire natriumconcentratie > 50-70 mmol/l of een totale urineproductie van > 100-150 ml/uur respectievelijk 2 en 6 uur na toediening van de diureticatherapie.
WRF bij patiënten met AHF leidt in de praktijk vaak tot een vermindering van de decongestieve therapie met de veronderstelling dat verdere behandeling zou kunnen leiden tot schade aan de niertubuli. Dit is echter onterecht en decongestieve therapie zou gecontinueerd moeten worden als persisterende congestie aanwezig is, aangezien residuele congestie wel geassocieerd is met een verminderde prognose. In het geval van WRF en persisterende congestie moeten zoals aangegeven in de flowchart steeds andere oorzaken worden uitgesloten. Hemodynamisch stabiele patiënten met WRF en een verminderde diuretische respons zijn vermoedelijk diureticaresistent, waarbij diureticatherapie best opgedreven wordt en gebruikgemaakt wordt van een combinatie van diuretica agens die op verschillende plaatsen in de tubulus de natriumreabsorptie verhinderen.
Chronisch hartfalen
D. Banerjee - Londen, Verenigd Koninkrijk
De nieren zijn een rijkelijk gevasculariseerd orgaan en ze ontvangen gemiddeld 1/5 van de cardiale output (1-1,2 liter/ minuut). De glomerulaire en tubulaire functie zijn nauw met elkaar verbonden via de macula densa in de distale tubulus. Als er een hoog aanbod van chloride is in de distale tubulus, zal de macula densa adenosine vrijzetten om een vasoconstrictie in de afferente arteriool teweeg te brengen om op die manier hyperfiltratie te voorkomen. Als er een laag chloride-aanbod is, zal de macula densa prostaglandines vrijzetten die een vasodilaterend effect hebben op de afferente arteriool en het juxtaglomerulaire apparaat stimuleren om renine vrij te zetten met een vasoconstrictie van de efferente arteriool als gevolg.
Ondanks de snellere deterioratie van de nierfunctie bij patiënten met chronisch hartfalen, heeft hartfalentherapie aangetoond dat ze de graad van achteruitgang kan verminderen. Het is daarom belangrijk om te streven naar vroege initiatie van alle vier trappen van de hartfalentherapie met nadien een snelle optitratie in functie van de klinische en biochemische evolutie (figuur 3). Na opstart is echter een mogelijke daling in de nierfunctie te verwachten. Bij opstart van renine-angiotensine-aldosteronsysteeminhibitoren (RAASi) gaat de efferente arteriool dilateren waardoor de hydrostatische druk in de glomerulaire cappillair afneemt en de GFR daalt onmiddellijk na opstart met nadien opnieuw een stabilisatie.8 De STOP-ACE-studie heeft recent aangetoond dat het continueren van een angiotensineconverterende-enzyme-inhibitor (ACEi) of angiotensinereceptorblokker (ARB) in patiënten met gevorderd chronisch nierlijden niet leidt tot een snellere achteruitgang van de resterende nierfunctie en dus veilig is.9 Natriumglucose-cotransporter 2-inhibitoren (SGLT2i) blokkeren de natrium- en glucosereabsorptie in de proximale tubulus waardoor het aanbod ter hoogte van de macula densa in de distale tubulus toeneemt.10 Dit leidt tot een vasoconstrictie van de afferente arteriool met eveneens als gevolg een daling in de GFR. Dit is puur een hemodynamische aanpassing na opstart van therapie om hyperfiltratie te voorkomen met als voordeel dat de nierfunctie op lange termijn stabiliseert en minder snel verergert. Deze afname van de graad van verslechtering zou op lange termijn ook aanwezig zijn bij angiotensineblokkerneprilysin-inhibitoren (ARNI).11 Bijgevolg mag een initiële daling in de GFR tot 20-30 % worden aanvaard, aangezien dit een uiting is van hemodynamische aanpassingen en geen teken van glomerulaire schade.1,12 Het opstarten van alle hartfalenmedicamenten is veilig tot een GFR > 30 ml/min/1,73 m2 en deze evidentie kan mogelijks worden doorgetrokken tot een GFR van 20ml/min/1,73 m2.12
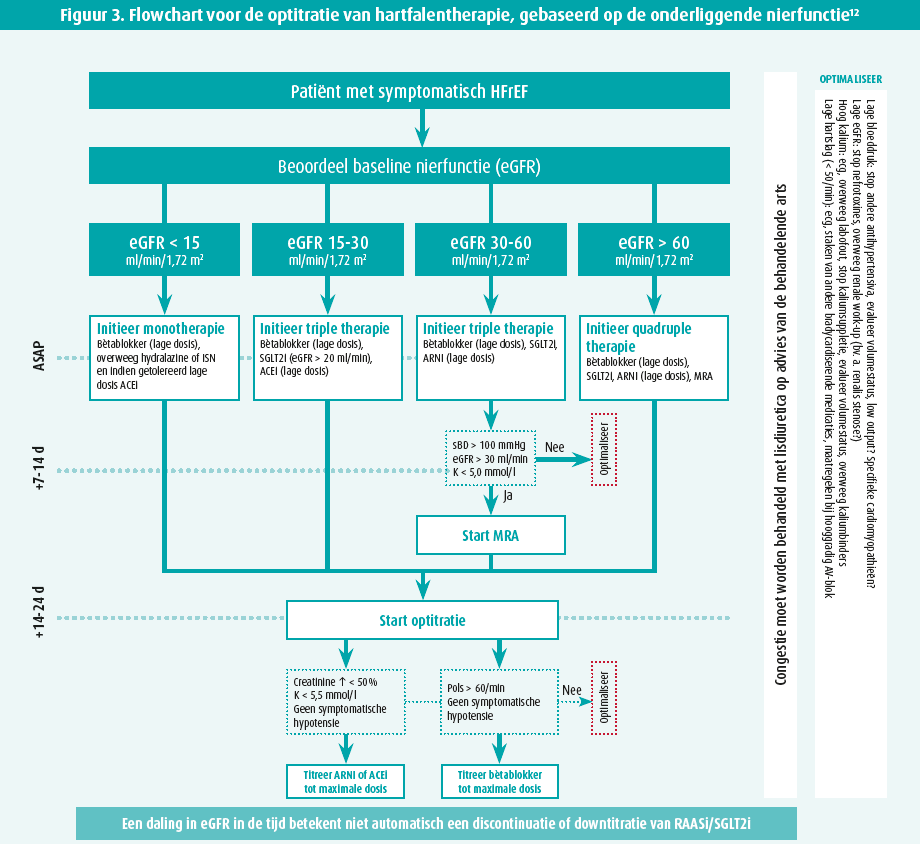
Naarmate de graad van nierinsufficiëntie toeneemt, neemt het risico voor het ontwikkelen van hyperkaliëmie ook toe. Indien dit problematisch is voor de optitratie van de hartfalentherapie, kan worden geopteerd om een kaliumbinder te associëren.13 Angst voor hyperkaliëmie, hypotensie en WRF zijn de grootste redenen voor onderdosage of discontinuatie van hartfalentherapie. Een consensusdocument werd opgesteld door de ESC met een voorstel voor de introductie van de vierledige hartfalentherapie, gebaseerd op de nierfunctie met klinische en biochemische controle voor optitratie (figuur 3).12 Bij patiënten met hartfalen en een chronische nierinsufficiëntie is een multidisciplinaire aanpak noodzakelijk, met een goede samenwerking tussen de cardioloog, nefroloog en huisarts.
Referenties
- Mullens, W., Damman, K., Testani, J.M., Martens, P., Mueller, C., Lassus, J. et al. Evaluation of kidney function throughout the heart failure trajectory - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22 (4), 584-603.
- Mullens, W., Damman, K., Harjola, V., Mebazaa, A., Rocca, H.B., Martens, P. et al. The use of diuretics in heart failure with congestion — a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2019, 21, 137-155.
- McDonagh, T.A., Metra, M., Adamo, M., Gardner, R.S., Baumbach, A., Böhm, M. et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 42 (36), 3599-3726.
- Felker, G.M., Ellison, D.H., Mullens, W., Cox, Z.L., Testani, J.M. Diuretic Therapy for Patients With Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol, 2020, 75 (10), 1178-1195.
- Felker, G.M., Lee, K.L., Bull, D.A., Redfield, M.M., Stevenson, L.W., Goldsmith, S.R. et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med, 2011, 364 (9), 797-805.
- Beldhuis, I.E., Streng, K.W., van der Meer, P., Ter Maaten, J.M., O'Connor, C.M., Metra, M. et al. Trajectories of Changes in Renal Function in Patients with Acute Heart Failure. J Card Fail, 2019, 25 (11), 866-874.
- Metra, M., Davison, B., Bettari, L., Sun, H., Edwards, C., Lazzarini, V. et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail, 2012, 5 (1), 54-62.
- Wright Jackson, T.J., Bakris, G., Greene, T., Agodoa, L.Y., Appel, L.J., Charleston, J. et al. Effect of Blood Pressure Lowering and Antihypertensive Drug Class on Progression of Hypertensive Kidney DiseaseResults From the AASK Trial. JAMA, 2002, 288 (19), 2421-2431.
- Bhandari, S., Mehta, S., Khwaja, A., Cleland, J.G.F., Ives, N., Brettell, E. et al. Renin- Angiotensin System Inhibition in Advanced Chronic Kidney Disease. N Engl J Med, 2022, 387 (22), 2021-2032.
- McMurray, J.J.V., Solomon, S.E., Inzucchi, L., Køber, M.N., Kosiborod, F.A., Martinez, P. et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2019, 381 (21), 1995-2008.
- Perkovic, V., Jardine, M.J., Neal, B., Bompoint, S., Heerspink, H.J.L., Charytan, D.M. et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med, 2019, 380 (24), 2295-2306.
- Mullens, W., Martens, P., Testani, J.M., Tang, W.H.W., Skouri, H., Verbrugge, F.H. et al. Renal effects of guideline-directed medical therapies in heart failure: a consensus document from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2022, 24 (4), 603-619.
- Butler, J., Anker, S.D., Lund, L.H., Coats, A.J.S., Filippatos, G., Siddiqi, T.J. et al. Patiromer for the management of hyperkalemia in heart failure with reduced ejection fraction: the DIAMOND trial. Eur Heart J, 2022, 43 (41), 4362-4373.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.