Cet article repose sur le webinaire de l'ESC intitulé 'Renal function changes in heart failure', modéré par W. Mullens (Genk) et animé par K. Damman (Groningen, Pays-Bas) et D. Banerjee (Londres, Royaume-Uni). L'insuffisance rénale chronique est un problème prévalent parmi les patients atteints d'insuffisance cardiaque, quelle que soit la fraction d'éjection sous-jacente. La fonction cardiaque et la fonction rénale sont étroitement liées et, par conséquent, les interactions cardio-rénales sont souvent source de dilemme dans le traitement des patients insuffisants cardiaques. Les modifications de la fonction rénale qui surviennent chez les patients atteints d'insuffisance cardiaque peuvent être la conséquence d'adaptations tant hémodynamiques et liées à la maladie que médicamenteuses. L'insuffisance rénale est un facteur pronostique bien connu chez les patients insuffisants cardiaques et elle est associée à une multiplication par deux du risque de mortalité. Les altérations de la fonction rénales doivent néanmoins toujours être interprétées en fonction du contexte clinique et une mauvaise interprétation peut entraîner un traitement inadéquat du patient.1 Cet article se penche sur l'évolution de la fonction rénale des patients atteints d'insuffisance cardiaque.
Insuffisance cardiaque aiguë
K. Damman - Groningen, Pays-Bas
Les diurétiques de l'anse restent la pierre angulaire du traitement de la congestion chez les patients atteints d'insuffisance cardiaque aiguë (ICA). La dose nécessaire pour obtenir une bonne réponse diurétique varie d'un patient à l'autre. Un document de consensus de l'ESC et les directives actuelles recommandent une dose initiale sur la base de la fonction rénale sous-jacente et de l'éventuelle dose de fond du traitement diurétique (figure 1).2,3 La dose initiale des diurétiques de l'anse doit être plus élevée chez les patients présentant une fonction rénale diminuée, étant donné que ces patients ont une relative résistance aux diurétiques avec une physiologie tubulaire changeante.4 Bien que l'étude DOSE n'ait pu démontrer aucune différence entre une perfusion en bolus et une perfusion continue, le bolus est privilégié étant donné que la perfusion continue complique l'évaluation de la réponse aux diurétiques.3,5 Or, un suivi étroit de la réponse aux diurétiques est essentiel pour permettre un ajustement rapide et adéquat du traitement diurétique.2,3
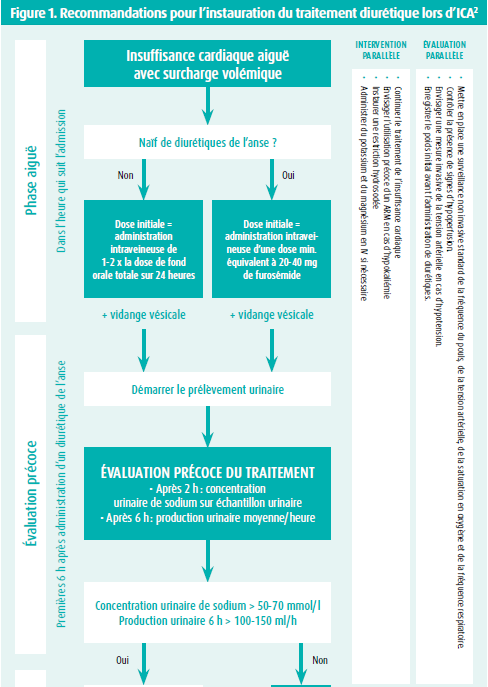

Au cours du traitement diurétique par voie intraveineuse, on craint souvent une dégradation de la fonction rénale. Mais l'évolution et le schéma de la fonction rénale sous traitement diurétique sont imprévisibles et peuvent prendre toutes les directions (stable, worsening or improving renal function), aucune association ne pouvant être établie entre l'évolution de la fonction rénale et la mortalité.6 Une dégradation de la fonction rénale qui s'avère plus importante que prévue est décrite comme une worsening renal function (WRF) et est escomptée chez 20-30 % des patients atteints d'ICA. L'étiologie d'une dégradation de la fonction rénale lors d'ICA est bien définie et est souvent, dans sa phase précoce, la conséquence de changements hémodynamiques qui résultent de l'association d'une perfusion rénale réduite et d'une congestion veineuse. Par ailleurs, une pression intra-abdominale accrue (> 8 mmHg), l'activation neuro-hormonale, l'inflammation, la dysfonction endothéliale et le stress oxydatif jouent également un rôle complémentaire dans la survenue d'une WRF. La fonction rénale initiale est le plus grand facteur prédictif de survenue de WRF lors d'ICA, étant donné qu'il s'agit d'une expression de la réserve rénale sous-jacente.
Si une WRF se produit pendant l'admission, il faut se demander si elle justifie d'ajuster le traitement. Un document de consensus publié en 2020 par l'ESC décrit la prise en charge de la WRF lors d'ICA (figure 2).1
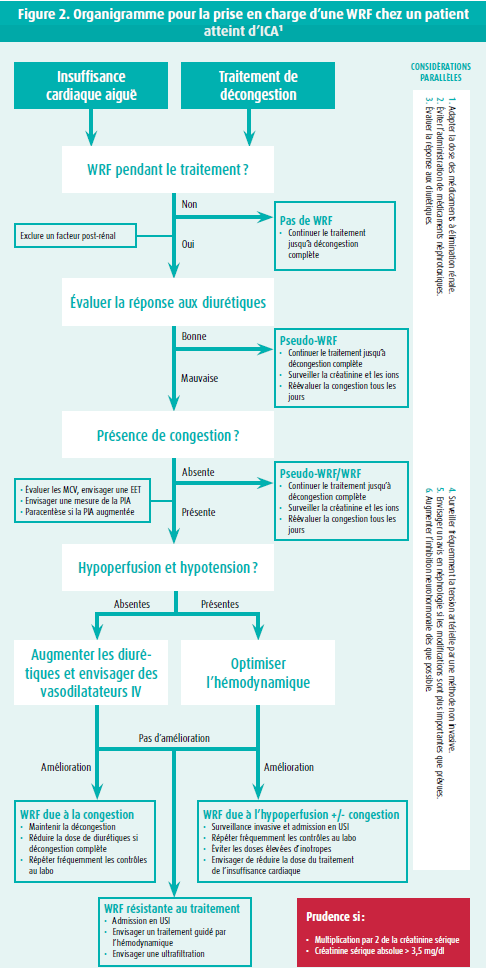

Il est important de noter que, lorsque la dégradation de la fonction rénale sous traitement diurétique est associée à une diurèse préservée, la situation doit être considérée comme une « pseudo-WRF » et n'est pas associée à un pronostic plus défavorable.7 Il est donc primordial de toujours évaluer les modifications rénales en fonction du contexte clinique, en accordant un intérêt tout particulier à l'estimation de la réponse diurétique. Il existe différentes méthodes pour évaluer la réponse aux diurétiques, mais les preuves sont de plus en plus nombreuses à étayer la mesure de la concentration de sodium à l'occasion d'un spot urinaire réalisé quelques heures après l'administration du traitement diurétique. Si le patient présente encore des signes de surcharge volémique, une réponse diurétique adéquate est définie par une concentration urinaire de sodium > 50-70 mmol/l ou une production urinaire totale > 100-150 ml/h, respectivement 2 et 6 heures après l'administration du traitement diurétique.
Dans la pratique, une WRF chez un patient atteint d'ICA entraîne souvent une diminution du traitement de décongestion dans l'hypothèse où le maintien du traitement pourrait conduire à des lésions tubulaires rénales. Cette hypothèse est toutefois incorrecte et le traitement de décongestion devrait être poursuivi en cas de congestion persistante, car une congestion résiduelle est, elle, associée à un pronostic moins favorable. Face à une WRF et à une congestion persistante, il convient toujours d'exclure d'autres causes, comme l'organigramme l'indique. Les patients stables sur le plan hémodynamique qui présentent une WRF et une réponse diurétique réduite sont présumés résistants aux diurétiques, ce qui justifie une intensification du traitement diurétique et l'utilisation d'une association d'agents diurétiques, qui empêchent la réabsorption du sodium à différents endroits du tubule.
Insuffisance cardiaque chronique
D. Banerjee - Londres, Royaume-Uni
Les reins sont des organes richement vascularisés qui reçoivent en moyenne 1/5 du débit cardiaque (1-1,2 litre/minute). La fonction glomérulaire et la fonction tubulaire sont étroitement liées via la macula densa dans le tubule distal. S'il y a un grand afflux de chlorure dans le tubule distal, la macula densa va libérer de l'adénosine pour déclencher une vasoconstriction dans l'artériole afférente et ainsi prévenir une hyperfiltration. S'il y a peu de chlorure présent, la macula densa va libérer des prostaglandines, qui ont un effet vasodilatateur sur l'artériole afférente et qui stimulent l'appareil juxtaglomérulaire à libérer de la rénine, ce qui entraîne une vasoconstriction de l'artériole efférente.
En dépit du déclin plus rapide de la fonction rénale chez les patients atteints d'insuffisance cardiaque chronique, un traitement de l'insuffisance cardiaque a démontré sa capacité à réduire le degré de détérioration. Il est donc important de viser l'initiation précoce des quatre étapes du traitement de l'insuffisance cardiaque, suivie d'une titration rapide en fonction de l'évolution clinique et biochimique (figure 3). Il faut toutefois s'attendre à une possible diminution de la fonction rénale après l'instauration dudit traitement. Lors de l'instauration d'inhibiteurs du système rénine-angiotensine-aldostérone (ISRAA), l'artériole efférente va se dilater, entraînant une diminution de la pression hydrostatique dans les capillaires glomérulaires et une baisse du DFG immédiatement après l'instauration, suivie d'une stabilisation.8 Dernièrement, l'étude STOP-ACE a démontré que la poursuite d'un inhibiteur de l'enzyme de conversion de l'angiotensine (IECA) ou d'un antagoniste des récepteurs de l'angiotensine (ARA) chez les patients atteints d'insuffisance rénale chronique avancée n'entraîne pas une détérioration plus rapide de la fonction rénale résiduelle, ce qui témoigne donc de son innocuité.9 Les inhibiteurs du cotransporteur de sodium-glucose de type 2 (ISGLT2) bloquent l'absorption du glucose et du sodium dans le tubule proximal, entraînant une augmentation de l'offre au niveau de la macula densa.10 Il en résulte une vasoconstriction de l'artériole afférente et, en conséquence, une diminution du DFG. Il s'agit purement et simplement d'une adaptation hémodynamique faisant suite à l'instauration du traitement visant à prévenir l'hyperfiltration, avec l'avantage que la fonction rénale se stabilise à long terme et se détériore moins rapidement. Cette atténuation du degré de détérioration serait également présente à long terme avec les inhibiteurs du récepteur de l'angiotensine-néprilysine (ARNI).11 Par conséquent, une baisse initiale du DFG jusqu'à 20-30 % peut être acceptée, étant donné qu'il s'agit d'une expression d'adaptations hémodynamiques, et non d'un signe d'atteinte glomérulaire.1,12 L'initiation de tous les médicaments contre l'insuffisance cardiaque est sûre jusqu'à un DFG > 30 ml/min/1,73 m2 et cette preuve peut possiblement être étendue jusqu'à un DFG de 20 ml/min/1,73 m2.12 Plus le degré d'insuffisance rénale augmente, plus le risque de développer une hyperkaliémie augmente. Si c'est problématique pour l'intensification du traitement de l'insuffisance cardiaque, il peut être envisagé d'associer un chélateur du potassium.13 La crainte d'une hyperkaliémie, d'une hypotension et d'une WRF sont les principaux motifs de sous-dosage ou d'arrêt du traitement de l'insuffisance cardiaque. Un document de consensus élaboré par l'ESC propose l'introduction du traitement de l'insuffisance cardiaque en quatre étapes, sur la base de la fonction rénale et avec un contrôle clinique et biochimique pour la titration (figure 3).12
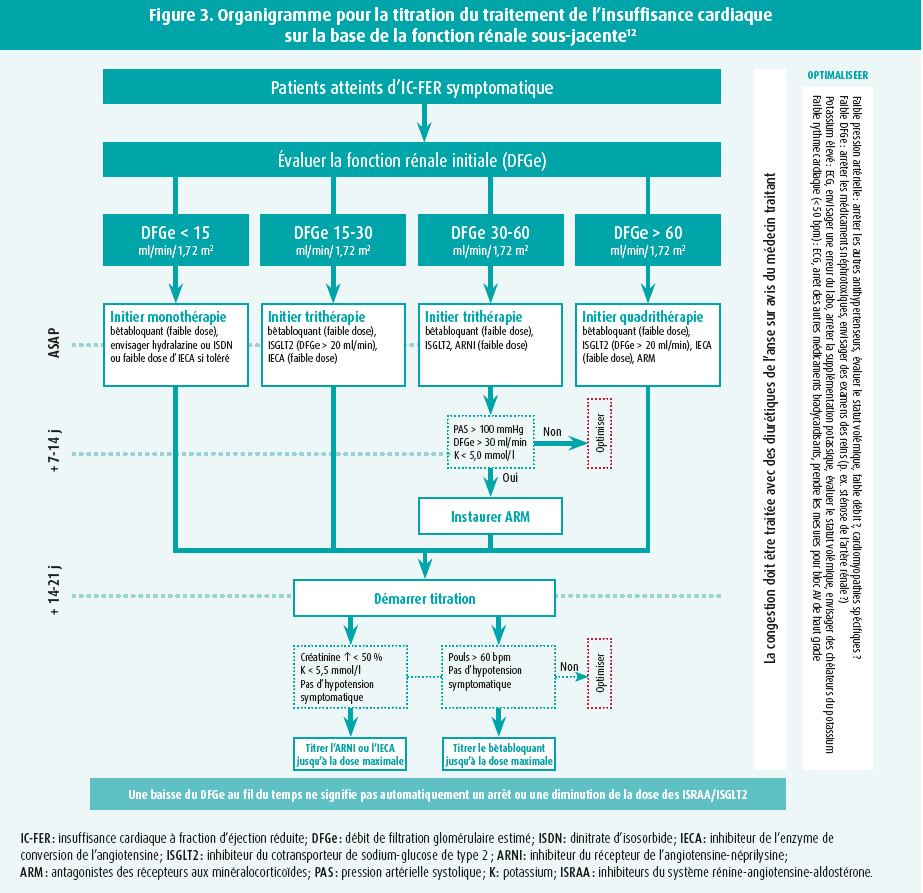
Les patients atteints d'insuffisance cardiaque et d'insuffisance rénale chronique requièrent une prise en charge multidisciplinaire, caractérisée par une bonne collaboration entre le cardiologue, le néphrologue et le médecin généraliste.
Références
- Mullens, W., Damman, K., Testani, J.M., Martens, P., Mueller, C., Lassus, J. et al. Evaluation of kidney function throughout the heart failure trajectory - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22 (4), 584-603.
- Mullens, W., Damman, K., Harjola, V., Mebazaa, A., Rocca, H.B., Martens, P. et al. The use of diuretics in heart failure with congestion — a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2019, 21, 137-155.
- McDonagh, T.A., Metra, M., Adamo, M., Gardner, R.S., Baumbach, A., Böhm, M. et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 42 (36), 3599-3726.
- Felker, G.M., Ellison, D.H., Mullens, W., Cox, Z.L., Testani, J.M. Diuretic Therapy for Patients With Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol, 2020, 75 (10), 1178-1195.
- Felker, G.M., Lee, K.L., Bull, D.A., Redfield, M.M., Stevenson, L.W., Goldsmith, S.R. et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med, 2011, 364 (9), 797-805.
- Beldhuis, I.E., Streng, K.W., van der Meer, P., Ter Maaten, J.M., O'Connor, C.M., Metra, M. et al. Trajectories of Changes in Renal Function in Patients with Acute Heart Failure. J Card Fail, 2019, 25 (11), 866-874.
- Metra, M., Davison, B., Bettari, L., Sun, H., Edwards, C., Lazzarini, V. et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail, 2012, 5 (1), 54-62.
- Wright Jackson, T.J., Bakris, G., Greene, T., Agodoa, L.Y., Appel, L.J., Charleston, J. et al. Effect of Blood Pressure Lowering and Antihypertensive Drug Class on Progression of Hypertensive Kidney DiseaseResults From the AASK Trial. JAMA, 2002, 288 (19), 2421-2431.
- Bhandari, S., Mehta, S., Khwaja, A., Cleland, J.G.F., Ives, N., Brettell, E. et al. Renin- Angiotensin System Inhibition in Advanced Chronic Kidney Disease. N Engl J Med, 2022, 387 (22), 2021-2032.
- McMurray, J.J.V., Solomon, S.E., Inzucchi, L., Køber, M.N., Kosiborod, F.A., Martinez, P. et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med, 2019, 381 (21), 1995-2008.
- Perkovic, V., Jardine, M.J., Neal, B., Bompoint, S., Heerspink, H.J.L., Charytan, D.M. et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med, 2019, 380 (24), 2295-2306.
- Mullens, W., Martens, P., Testani, J.M., Tang, W.H.W., Skouri, H., Verbrugge, F.H. et al. Renal effects of guideline-directed medical therapies in heart failure: a consensus document from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2022, 24 (4), 603-619.
- Butler, J., Anker, S.D., Lund, L.H., Coats, A.J.S., Filippatos, G., Siddiqi, T.J. et al. Patiromer for the management of hyperkalemia in heart failure with reduced ejection fraction: the DIAMOND trial. Eur Heart J, 2022, 43 (41), 4362-4373.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.