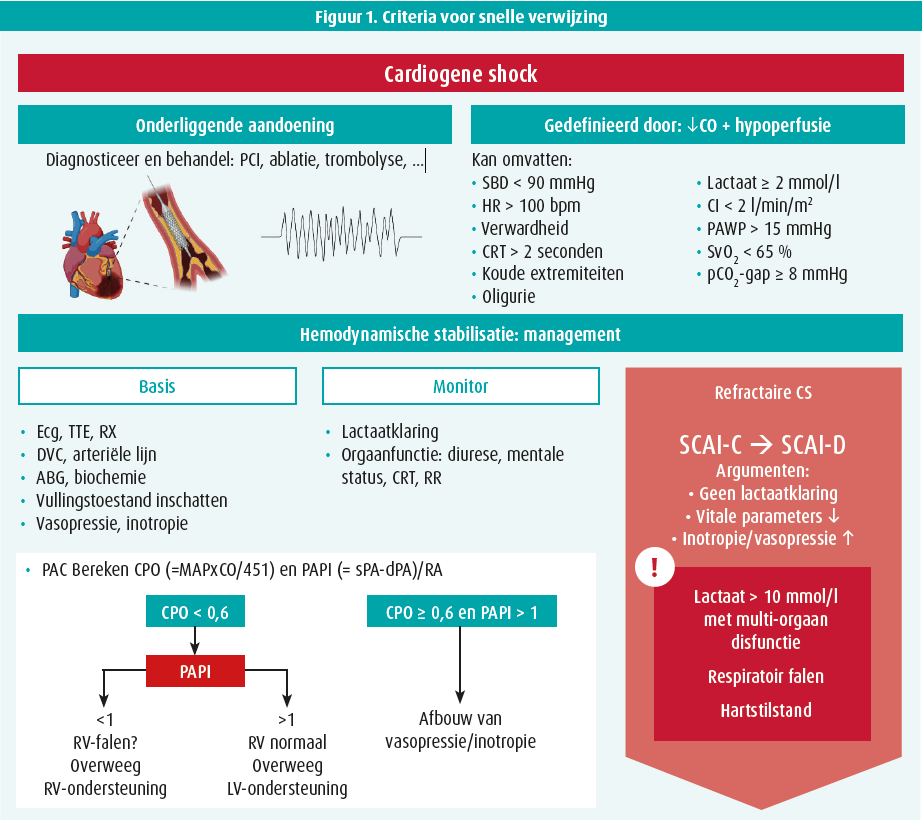
Cardiogene shock (CS) is een complex, multifactorieel syndroom met een zeer hoge mortaliteit (de éénjaarsmortaliteit bedraagt 50 %), ondanks de uitbereiding in therapeutische opties van de afgelopen decennia. In dit artikel wordt een beknopt overzicht gegeven van de definitie, pathofysiologie en classificatie van CS, alsook de behandeling. In het bijzonder wordt gefocust op de plaats van mechanische circulatieondersteuning (mechanical circulatory support [MCS]), waarbij de verschillende opties, indicaties, patiëntselectie, en de optimale timing wordt besproken om artsen te helpen de therapie tijdig te escaleren of patiënten te verwijzen naar MCS-centra (figuur 1).
Definitie, pathofysiologie en classificatie
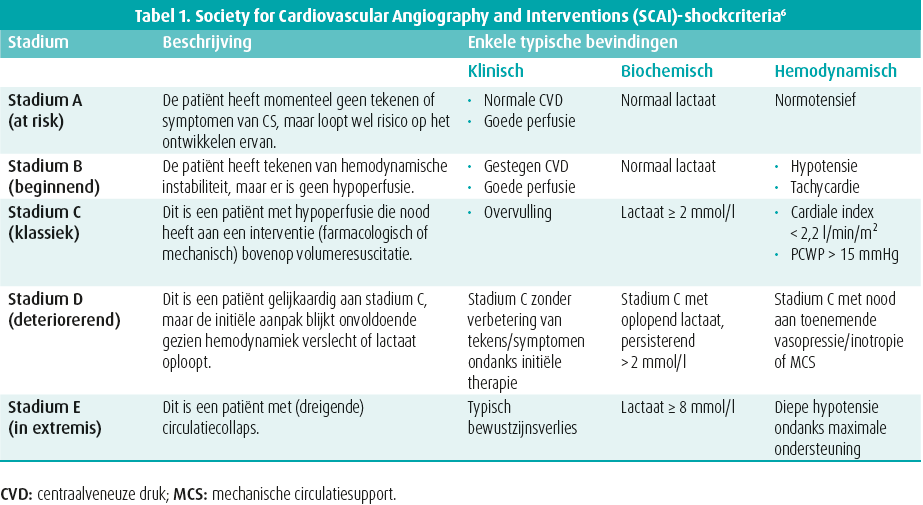
CS is een aandoening van verminderde cardiale output (CO), veroorzaakt door myocardiale disfunctie en resulterend in een spectrum van eindorgaan hypoperfusie en hypoxie.1 CS is een klinische diagnose, gebaseerd op tekens van hypoperfusie (oligurie, marbrering, verwardheid, …) aangevuld met biochemische manifestaties van hypoperfusie (opgelopen lactaat en andere eindorgaanmarkers).2 Hypotensie wordt geïncludeerd in verschillende CS-definities, maar is niet obligaat aanwezig gezien compensatoire mechanismen (vasoconstrictie) de bloeddruk - aanvankelijk - op peil kunnen houden, terwijl er toch verminderde CO en weefselhypoxie is. CS wordt frequent veroorzaakt door een acuut coronair syndroom (ACS), hoewel het aandeel daarvan is afgenomen in de afgelopen twee decennia (van 80 % naar 30-45 %).2,3 Andere oorzaken zijn ischemische cardiomyopathie zonder ACS (ongeveer 20 %), niet-ischemische cardiomyopathie (ongeveer 30 %) en andere cardiale aandoeningen zoals ernstig kleplijden of myocarditis (samen ongeveer 15 %).4 Hoewel de oorzaken dus verschillen bij CS, resulteert het uitlokkende event in verminderde CO, waardoor hemodynamische veranderingen met verhoogde links- en rechtszijdige vullingsdrukken, disfunctie van de microcirculatie, een systemisch inflammatoir responssyndroom (SIRS) en multi-orgaan disfunctie snel optreden. Deze stadia worden vaak als consecutief gezien, maar kunnen elkaar overlappen.5 Bovendien kunnen uitlokkende factoren, zoals infectie of het optreden van cardiale complicaties (bv. papillairespierruptuur bij ACS), het verloop beïnvloeden. Om de ernst van de CS uit te drukken, wordt momenteel meestal gebruik gemaakt van de SCAI (Society for Cardiovascular Angiography and Interventions)-classificatie, die in 2019 ontwikkeld werd en correleert met mortaliteit in verschillende settingen (ACS-geïnduceerde CS, out-of-hospital cardiaal arrest, …).6 In tabel 1 wordt een overzicht gegeven van de verschillende SCAI-stadia en de bijpassende klinische, biochemische en hemodynamische bevindingen.6
Behandeling
De initiële behandeling van CS is gebaseerd op hemodynamische stabilisatie en aanpak van de onderliggende oorzaak. De enige op evidentie gebaseerde behandeling tijdens CS is vroege revascularisatie van de causale coronaire arterie bij ACS geïnduceerde CS; er is géén op evidentie gebaseerde behandeling voor niet-ACS gerelateerde CS.2, 7 In de huidige richtlijnen van de European Society of Cardiology (2021) krijgt het vroegtijdige gebruik van korte termijn MCS in patiënten in CS refractair aan vulling en inotropie/vasopressie een aanbeveling (klasse IIa - 'moet worden overwogen', bewijsniveau C) als brug naar herstel, herevaluatie, transplantatie of linkerventrikelassistdevice (LVAD)-implantatie.1
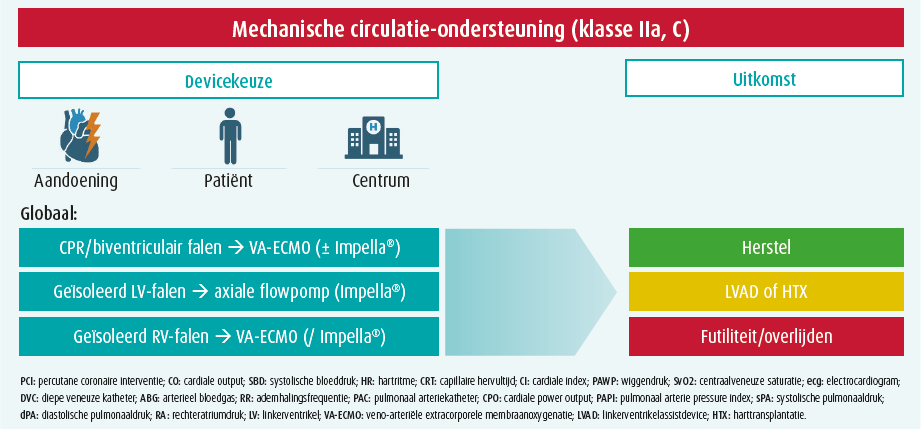
MCS-devices zijn duur en moeten dus weloverwogen worden ingezet. Het is belangrijk om in het achterhoofd te houden dat met geen enkel van deze devices tot nu toe een overlevingsvoordeel aangetoond is in de CS-populatie, ondanks het feit dat ze het centrale probleem (gereduceerde CO) tijdens CS oplossen.8-13 Dit gebrek aan aangetoond overlevingsvoordeel komt enerzijds door de retrospectieve aard van de studies die tot patiëntbias leidt (nl. de ziekere patiënten ontvangen MCS). Anderzijds blijven complicaties zoals bloeding/trombose en hemolyse nog steeds erg frequent tijdens MCS en moet het risico op complicaties dus worden afgewogen tegenover het hemodynamische voordeel. Over het algemeen zijn er geen strikte aanbevelingen over indicaties, timing, devicekeuze en patiëntselectie gezien de schaarsheid van kwalitatieve studies.13 In de richtlijnen wordt geadviseerd om vroegtijdig de patiënten te selecteren die enerzijds ziek genoeg zijn om effect te hebben van hemodynamische verbetering, maar waarbij anderzijds nog geen eindorgaanfalen ontstaan is ten gevolge van de gecompromitteerde hemodynamiek.14 Algemeen wordt dan ook geadviseerd om MCS te overwegen als vasopressie/ inotropie en volumeresuscitatie de hemodynamiek niet verbeteren, hoewel er een toenemende trend is naar een vroegtijdige start van MCS met een voorkeur voor MCS boven inotropie (voor dat laatste geldt trouwens een klasse 2b-aanbeveling - 'kan worden overwogen' in de ESC-richtlijnen van 2021). Een pulmonaire arteriële katheter is aangeraden bij alle patiënten in CS en kan helpen bij de inschatting voor de noodzaak van associatie van MCS (cardiale power output < 0,6) en deviceselectie (rechterventrikelfalen?). Andere richtinggevende elementen om MCS te overwegen zijn geen of onvoldoende snelle lactaatklaring, achteruitgang van vitale parameters, oplopende nood aan inotropie en vasopressie. Doorslaggevende factoren waarbij een beslissing moet worden gemaakt over het al dan niet starten van MCS zijn onder andere lactaat > 10 mmol/l met multi-orgaanfalen, respiratoir falen, hartstilstand. Bij ACS-geïnduceerde CS wordt momenteel onderzocht of de ondersteuning met MCS best kan worden gestart voor of na PCI met reperfusie.
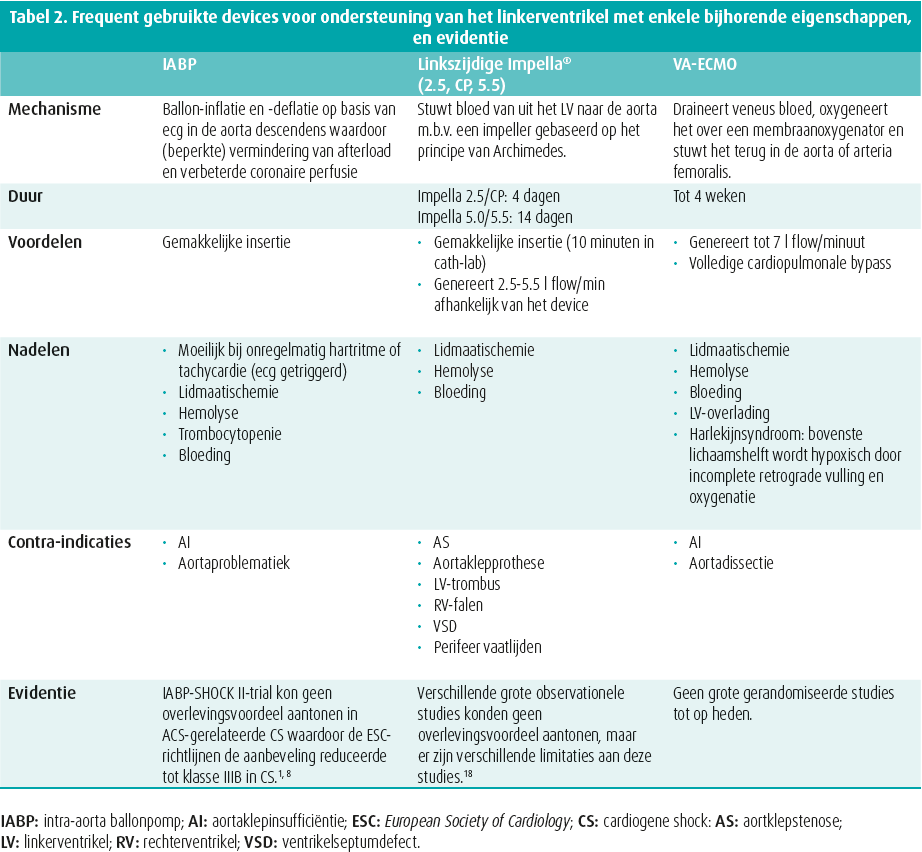
De keuze m.b.t. de selectie van het device hangt af van de aandoening (graad van ondersteuning die nodig is, falen van linkerventrikel [LV] en/of rechterventrikel [RV], specifieke risico's), de patiënt (klinische presentatie, mogelijkheid tot herstel, geassocieerd oxygenatie/ ventilatiefalen), en van het centrum (beschikbaarheid van devices, ervaring, gemak en snelheid van insertie). Het merendeel van de devices biedt enkel hemodynamische ondersteuning, met uitzondering van veno-arteriële extracorporele membraanoxygenatie (VA-ECMO) met ook O2/CO2-uitwisseling. In tabel 2 bespreken we de meest gebruikte devices in België die het LV ondersteunen met hun werkingsmechanisme, voor- en nadelen en contra-indicaties. Devices die specifiek het RV ondersteunen zijn de Impella RP®, en TandemHeart RVAD met de Protek Duo-canule, maar deze worden hier niet besproken omdat zij niet zo frequent gebruikt worden. Idealiter wordt voor de deviceselectie een stapsgewijze benadering gevolgd waarbij vooral gefocust wordt op de onderliggende aandoening van de patiënt.15 In geval van CPR (cardiopulmonary resuscitation), wordt sterk de voorkeur gegeven aan VA-ECMO omdat dit zowel de circulatie als de oxygenatie overneemt en de hoogste graad van ondersteuning kan bieden (tot 7 l/min). Wanneer er biventriculair falen is, moet er uiteraard biventriculaire ondersteuning worden voorzien en is de evidente keuze eveneens VA-ECMO, met lage drempel voor LV-ontlasting (met een micro-axiale pomp zoals de Impella®, een opstelling waarnaar verwezen wordt als 'ECMELLA' of 'ECPELLA', via IABP of via een drainerende apicale katheter geconnecteerd aan de veneuze zijde van het ECMO-circuit). Een gecombineerde links- en rechtszijdige Impella®-opstelling zou een alternatief zijn (BIPELLA), maar dit wordt in de praktijk slechts zelden gebruikt en het management is complex. In geval van geïsoleerd LV-falen, is een microaxiale flowpomp de eerste keuze. De maximale flow met Impella® 5.5 bedraagt 5,5 l/min. Als er meer ondersteuning nodig is (bv. concomitante sepsis), overweegt men ook beter VA-ECMO.
Gerandomiseerde studies omtrent de behandeling met MCS en de optimale timing zijn lopende voor Impella® (DanGer Shock, DTU-STEMI) en VA-ECMO (ECLS-SHOCK, EURO SHOCK), maar focussen zich op de specifieke populatie met CS gerelateerd aan ACS. Gecombineerd met de overige inclusie- en exclusiecriteria, lijkt het dat deze studies slechts een derde van de algemene CS-populatie vertegenwoordigen, wat aantoont dat er voor bepaalde subpopulaties (niet ACS-gerelateerd zoals myocarditis, voorafgaand hartfalen, …) nog steeds nood is aan verder onderzoek.16,17
Conclusie
CS blijft een aandoening met hoge mortaliteit, waarbij nog veel ruimte is voor het optimaliseren van de behandeling. De richtlijnen adviseren het initiëren van MCS bij patiënten in refractaire CS waar initiële therapie met vulling en inotropie/vasopressie geen of onvoldoende effect heeft. Pathofysiologisch lijkt de keuze voor associatie van MCS logisch, maar er is op dit moment voor geen enkel device een verbetering van de mortaliteit aangetoond in de CS-populatie. Dat is vooral het gevolg van de afwezigheid van kwalitatieve data, waardoor dus ook geen harde aanbevelingen omtrent timing, devicekeuze en patiëntselectie kunnen worden gedaan. Dat benadrukt het belang van de resultaten van de gerandomiseerde studies in deze setting die de afgelopen jaren werden opgezet en binnenkort worden verwacht.
Referenties
- McDonagh, T.A., Metra, M., Adamo, M. et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 3599-3726.
- Chioncel, O., Parissis, J., Mebazaa, A. et al. Epidemiology, pathophysiology and contemporary management of cardiogenic shock - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22 (8), 1315-1341.
- Harjola, V.P., Lassus, J., Sionis, A. et al. Clinical picture and risk prediction of shortterm mortality in cardiogenic shock. Eur J Heart Fail, 2015, 17 (5), 501-509.
- Berg, D.D., Bohula, E.A., Van Diepen, S. et al. Epidemiology of Shock in Contemporary Cardiac Intensive Care Units: Data from the Critical Care Cardiology Trials Network Registry. Circ Cardiovasc Qual Outcomes, 2019, 12 (3).
- De Backer, D., Creteur, J., Dubois, M.J., Sakr, Y., Vincent, J.L. Microvascular alterations in patients with acute severe heart failure and cardiogenic shock. Am Heart J, 2004, 147 (1), 91-99.
- Naidu, S.S., Baran, D.A., Jentzer, J.C. et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies. JSCAI, 2022, 1 (1), 100008.
- Ibanez, B., James, S., Agewall, S. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J, 2018, 119-177.
- Thiele, H., Zeymer, U., Thelemann, N. et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the Randomized IABP-SHOCK II Trial. Circulation, 2019, 139 (3), 395-403.
- Ouweneel, D.M., Eriksen, E., Sjauw, K.D. et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. J Am Coll Cardiol, 2017, 69 (3), 278-287.
- Schrage, B., Ibrahim, K., Loehn, T. et al. Impella support for acute myocardial infarction complicated by cardiogenic shock: Matched-pair iabp-shock II trial 30-day mortality analysis. Circulation, 2019, 139 (10), 1249-1258.
- Amin, A.P., Spertus, J.A., Curtis, J.P. et al. The Evolving Landscape of Impella Use in the United States among Patients Undergoing Percutaneous Coronary Intervention with Mechanical Circulatory Support. Circulation, 2020, 141 (4), 273-284.
- Dhruva, S.S., Ross, J.S., Mortazavi, B.J. et al. Association of Use of an Intravascular Microaxial Left Ventricular Assist Device vs Intra-aortic Balloon Pump with In-Hospital Mortality and Major Bleeding among Patients with Acute Myocardial Infarction Complicated by Cardiogenic Shock. JAMA, 2020, 323 (8), 734-745.
- Chieffo, A., Dudek, D., Hassager, C. et al. Joint EAPCI/ACVC expert consensus document on percutaneous ventricular assist devices. Eur Heart J Acute Cardiovasc Care, 2021, 10 (5), 570-583.
- Vranckx, P., Price, S. Handbook on Mechanical Circulatory Support - Quick access to most relevant practical information on Mechanical Circulatory Support 2022 edition. 2022.
- Balthazar, T., Vandenbriele, C., Verbrugge, F.H. et al. Managing Patients With Short- Term Mechanical Circulatory Support. J Am Coll Cardiol, 2021, 77 (9), 1243-1256.
- Schrage, B., Beer, B.N., Savarese, G. et al. Eligibility for mechanical circulatory support devices based on current and past randomised cardiogenic shock trials. Eur J Heart Fail, 2021, 23 (11), 1942-1951.
- Pahuja, M., Johnson, A., Kabir, R. et al. Randomized Trials of Percutaneous Microaxial Flow Pump Devices: JACC Stateof- the-Art Review. J Am Coll Cardiol, 2022, 80 (21), 2028-2049.
- Vandenbriele C., Tavazzi G., Price S. Caution With Conclusions and Context of Mechanical Circulatory Devices. JAMA Intern Med, 2023, 183 (3), 277.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.