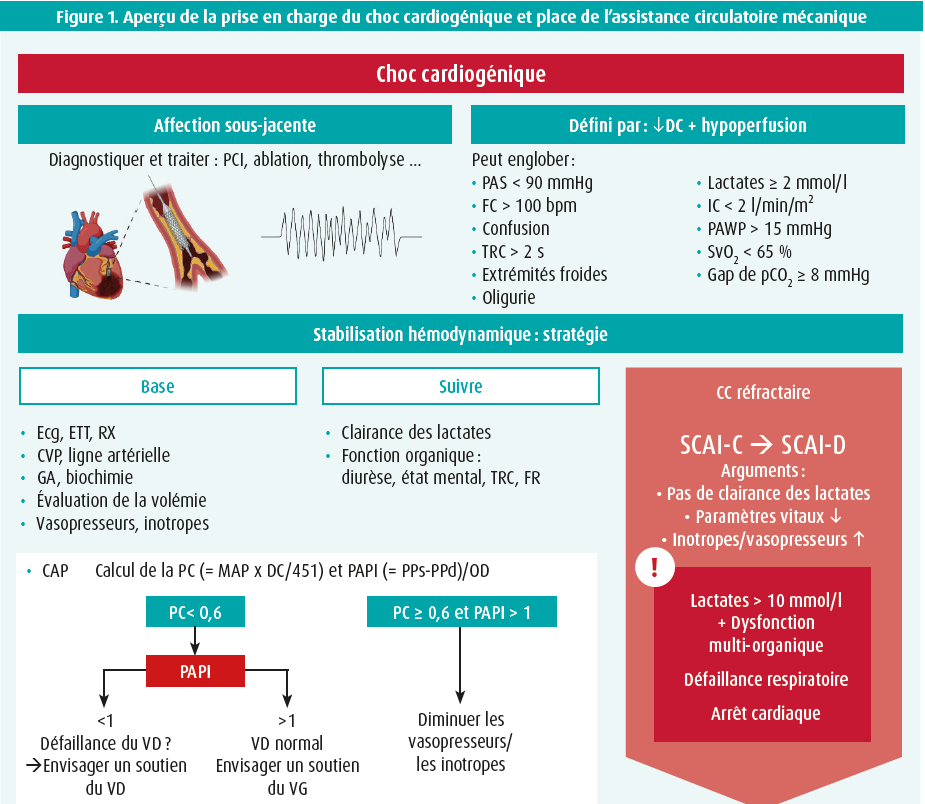
Le choc cardiogénique (CC) est un syndrome multifactoriel complexe grevé d'une mortalité très élevée (la mortalité à 1 an atteint 50 %), malgré l'élargissement des options thérapeutiques au cours des dernières décennies. Cet article donne un bref aperçu de la définition, de la physiopathologie et de la classification du CC, ainsi que du traitement. Il se concentre en particulier sur la place de l'assistance circulatoire mécanique (mechanical circulatory support [MCS]), en discutant des différentes options, des indications, de la sélection des patients et du timing optimal pour aider les médecins à intensifier le traitement à temps ou à adresser les patients vers les centres d'ACM (figure 1).
Définition, physiopathologie et classification
Le CC est une situation de diminution du débit cardiaque (DC), provoquée par une dysfonction myocardique, qui entraîne un spectre d'hypoperfusion et d'hypoxie des organes terminaux.1 Le CC est un diagnostic clinique, basé sur des signes d'hypoperfusion (oligurie, marbrures, confusion …) complétés par des manifestations biochimiques d'hypoperfusion (élévation des lactates et des autres marqueurs des organes terminaux).2 L'hypotension est incluse dans plusieurs définitions du CC, mais elle peut faire défaut, étant donné que des mécanismes compensatoires (vasoconstriction) peuvent - initialement - maintenir la pression artérielle, alors qu'il y a malgré tout une diminution du DC et une hypoxie tissulaire. Le CC est fréquemment provoqué par un syndrome coronarien aigu (SCA), bien que le chiffre ait diminué au cours des deux dernières décennies (de 80 % à 30-45 %).2,3 Les autres causes englobent une cardiomyopathie ischémique sans SCA (environ 20 %), une cardiomyopathie non ischémique (environ 30 %) et d'autres affections cardiaques telles qu'une valvulopathie sévère ou une myocardite (environ 15 % en tout).4 Bien que les causes du CC soient donc différentes, l'événement déclenchant entraîne une diminution du DC, qui provoque l'apparition rapide de modifications hémodynamiques avec des pressions de remplissage gauche et droit élevées, une dysfonction microcirculatoire, un syndrome de réponse inflammatoire systémique (SRIS) et une dysfonction multi-organique. Ces stades sont souvent considérés comme successifs, mais ils peuvent se chevaucher.5 En outre, des facteurs déclenchants, comme une infection ou la survenue de complications cardiaques (p. ex. une rupture d'un muscle papillaire en cas de SCA) peuvent influencer l'évolution. Pour exprimer la sévérité du CC, on utilise actuellement le plus souvent la classification SCAI (Society for Cardiovascular Angiography and Interventions), élaborée en 2019, qui est corrélée avec la mortalité dans différents contextes (CC induit par un SCA, arrêt cardiaque extrahospitalier ...).6 Le tableau 1 donne un aperçu des différents stades SCAI et des observations cliniques, biochimiques et hémodynamiques correspondantes.6

Traitement
Le traitement initial du CC est basé sur la stabilisation hémodynamique et la prise en charge de la cause sous-jacente. Le seul traitement basé sur des preuves pendant le CC est la revascularisation précoce de l'artère coronaire responsable en cas de CC induit par un SCA ; il n'existe aucun traitement basé sur des preuves pour un CC non lié à un SCA.2, 7 Dans les recommandations actuelles de la Société européenne de Cardiologie (2021), l'utilisation précoce de l'ACM à court terme chez les patients souffrant d'un CC réfractaire au remplissage et aux inotropes/ vasopresseurs a reçu une recommandation de classe IIa ('doit être envisagée', niveau de preuve C) en tant que 'pont' vers la récupération, une réévaluation, une transplantation ou l'implantation d'un dispositif d'assistance ventriculaire gauche (DAVG).1
Les dispositifs d'ACM sont coûteux et ils doivent donc être utilisés de manière judicieuse. Il est important de garder à l'esprit que, jusqu'à présent, aucun bénéfice en termes de survie n'a été démontré avec aucun de ces dispositifs dans la population souffrant d'un CC, malgré le fait qu'ils résolvent le problème central (diminution du DC) pendant le CC.8-13 Cette absence de bénéfice démontré en termes de survie est d'une part due à la nature rétrospective des études, ce qui conduit à un biais de sélection (c.-à-d. que les patients les plus malades reçoivent une ACM). D'autre part, les complications, telles que les hémorragies/thromboses et l'hémolyse restent très fréquentes pendant l'ACM et le risque de complications doit donc être mis en balance avec le bénéfice hémodynamique. De manière générale, il n'existe pas de recommandations strictes au sujet des indications, du timing, du choix du dispositif et de la sélection des patients, étant donné la rareté des études qualitatives.13 Les recommandations préconisent une sélection précoce des patients qui sont suffisamment malades pour tirer un bénéfice de l'amélioration hémodynamique, mais qui ne présentent par ailleurs pas encore de défaillance d'un organe terminal suite aux perturbations hémodynamiques.14 Globalement, on conseille donc d'envisager une ACM si les vasopresseurs/inotropes et l'expansion volémique n'améliorent pas l'hémodynamique, bien qu'il y ait une tendance croissante à l'initiation précoce de l'ACM avec une préférence pour une ACM par rapport aux agents inotropes (cette dernière s'est d'ailleurs vu attribuer une classe IIb - 'peut être envisagée' dans les recommandations de l'ESC de 2021). Un cathéter artériel pulmonaire est recommandé chez tous les patients en CC et il peut aider à évaluer la nécessité d'associer une ACM (puissance cardiaque < 0,6) et à choisir le dispositif (défaillance ventriculaire droite ?). L'absence ou l'insuffisance de clairance rapide des lactates, la détérioration des paramètres vitaux, le besoin croissant d'inotropes et de vasopresseurs sont d'autres éléments indiquant qu'il faut envisager une ACM. Les facteurs décisifs sur lesquels on base la décision d'instaurer ou non une ACM sont, entre autres, un taux de lactates > 10 mmol/l avec une défaillance multi-organique, une défaillance respiratoire et un arrêt cardiaque. En cas de CC induit par un SCA, on étudie actuellement s'il est préférable d'instaurer l'ACM avant ou après la PCI avec reperfusion.
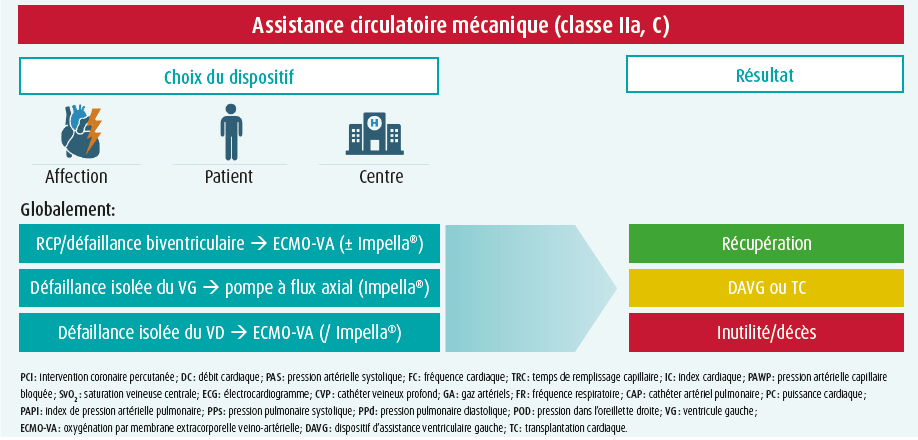
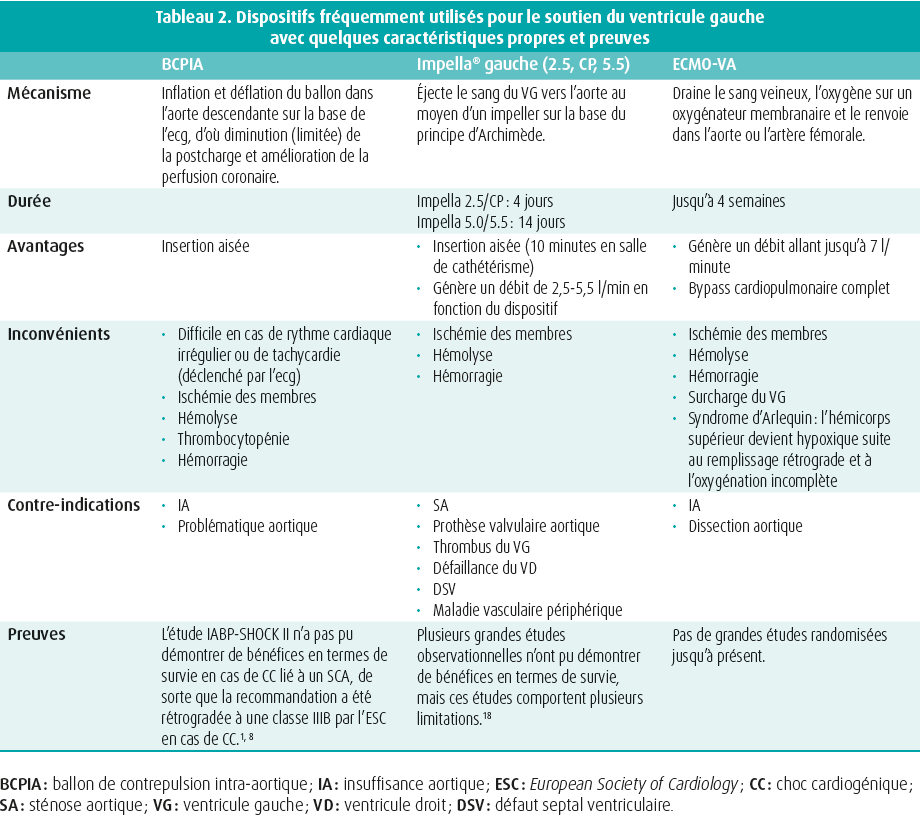
Le choix du dispositif dépend de l'affection (degré d'assistance nécessaire, défaillance du ventricule gauche (VG) et/ou du ventricule droit (VD), risques spécifiques), du patient (tableau clinique, possibilité de récupération, défaillance associée de l'oxygénation/la ventilation) et du centre (disponibilité des dispositifs, expérience, facilité et rapidité d'insertion). La majorité des dispositifs ne fournissent qu'une assistance hémodynamique, à l'exception de l'oxygénation par membrane extracorporelle veino-artérielle (ECMO-VA) qui permet également un échange O2/CO2. Le tableau 2 présente les dispositifs les plus utilisés en Belgique pour le soutien du VG, avec leur mécanisme d'action, leurs avantages et inconvénients et leurs contre-indications. Les dispositifs qui soutiennent spécifiquement le VD sont l'Impella RP® et le TandemHeart RVAD avec la canule Protek Duo, mais nous ne les aborderons pas ici, étant donné que leur utilisation n'est pas si fréquente. Idéalement, le dispositif doit être choisi selon une approche progressive, en se ciblant surtout sur l'affection sous-jacente du patient.15 En cas de RCP (réanimation cardiopulmonaire), on préfère de loin l'ECMO-VA, car elle assure à la fois la circulation et l'oxygénation et peut fournir le plus haut degré d'assistance (jusqu'à 7 l/min). En cas de défaillance biventriculaire, il va de soi qu'il faut prévoir une assistance biventriculaire, et le choix évident est également l'ECMO-VA, avec un seuil bas pour la décharge du VG (avec une pompe micro-axiale comme l'Impella®, une configuration appelée 'ECMELLA' ou 'ECPELLA', via un BCPIA ou via un cathéter apical drainant connecté au côté veineux du circuit d'ECMO). Une installation combinée d'Impella® gauche et droit offrirait une alternative (BIPELLA), mais ceci est rarement utilisé en pratique et la gestion s'avère complexe. En cas de défaillance isolée du VG, une pompe micro-axiale constitue le premier choix. Le débit maximal avec l'Impella® 5.5 atteint 5,5 l/min. Si une assistance plus importante est nécessaire (p. ex. en cas de sepsis concomitant), il est également préférable d'envisager une ECMO-VA.
Des études randomisées concernant le traitement au moyen d'une ACM et le timing optimal sont en cours avec l'Impella® (DanGer Shock, DTU-STEMI) et l'ECMO-VA (ECLS-SHOCK, EURO SHOCK), mais elles se concentrent sur la population spécifique présentant un CC lié à un SCA. Compte tenu des autres critères d'inclusion et d'exclusion, il semble que ces études ne concernent qu'un tiers de la population générale souffrant d'un CC, ce qui montre que de plus amples études restent nécessaires pour certaines sous-populations (CC non lié à un SCA, comme une myocardite, une insuffisance cardiaque préalable ...).16,17
Conclusion
Le CC reste une affection grevée d'une mortalité élevée, avec une grande marge d'optimisation du traitement. Les recommandations préconisent l'initiation d'une ACM chez les patients en CC réfractaire, lorsque le traitement initial par remplissage et inotropes/vasopresseurs n'a pas d'effet (suffisant). D'un point de vue physiopathologique, le choix de l'association de l'ACM semble logique, mais aucune amélioration de la mortalité n'a actuellement été démontrée avec aucun dispositif dans la population de patients souffrant d'un CC. Ceci est principalement dû à l'absence de données qualitatives, de sorte qu'aucune recommandation ferme ne peut être formulée concernant le timing, le choix du dispositif et la sélection des patients. Dans ce contexte, ceci souligne l'importance des résultats des études randomisées mises sur pied ces dernières années, qu'on attend prochainement.
Références
- McDonagh, T.A., Metra, M., Adamo, M. et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 3599-3726.
- Chioncel, O., Parissis, J., Mebazaa, A. et al. Epidemiology, pathophysiology and contemporary management of cardiogenic shock - a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail, 2020, 22 (8), 1315-1341.
- Harjola, V.P., Lassus, J., Sionis, A. et al. Clinical picture and risk prediction of shortterm mortality in cardiogenic shock. Eur J Heart Fail, 2015, 17 (5), 501-509.
- Berg, D.D., Bohula, E.A., Van Diepen, S. et al. Epidemiology of Shock in Contemporary Cardiac Intensive Care Units: Data from the Critical Care Cardiology Trials Network Registry. Circ Cardiovasc Qual Outcomes, 2019, 12 (3).
- De Backer, D., Creteur, J., Dubois, M.J., Sakr, Y., Vincent, J.L. Microvascular alterations in patients with acute severe heart failure and cardiogenic shock. Am Heart J, 2004, 147 (1), 91-99.
- Naidu, S.S., Baran, D.A., Jentzer, J.C. et al. SCAI SHOCK Stage Classification Expert Consensus Update: A Review and Incorporation of Validation Studies. JSCAI, 2022, 1 (1), 100008.
- Ibanez, B., James, S., Agewall, S. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J, 2018, 119-177.
- Thiele, H., Zeymer, U., Thelemann, N. et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction: Long-Term 6-Year Outcome of the Randomized IABP-SHOCK II Trial. Circulation, 2019, 139 (3), 395-403.
- Ouweneel, D.M., Eriksen, E., Sjauw, K.D. et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. J Am Coll Cardiol, 2017, 69 (3), 278-287.
- Schrage, B., Ibrahim, K., Loehn, T. et al. Impella support for acute myocardial infarction complicated by cardiogenic shock: Matched-pair iabp-shock II trial 30-day mortality analysis. Circulation, 2019, 139 (10), 1249-1258.
- Amin, A.P., Spertus, J.A., Curtis, J.P. et al. The Evolving Landscape of Impella Use in the United States among Patients Undergoing Percutaneous Coronary Intervention with Mechanical Circulatory Support. Circulation, 2020, 141 (4), 273-284.
- Dhruva, S.S., Ross, J.S., Mortazavi, B.J. et al. Association of Use of an Intravascular Microaxial Left Ventricular Assist Device vs Intra-aortic Balloon Pump with In-Hospital Mortality and Major Bleeding among Patients with Acute Myocardial Infarction Complicated by Cardiogenic Shock. JAMA, 2020, 323 (8), 734-745.
- Chieffo, A., Dudek, D., Hassager, C. et al. Joint EAPCI/ACVC expert consensus document on percutaneous ventricular assist devices. Eur Heart J Acute Cardiovasc Care, 2021, 10 (5), 570-583.
- Vranckx, P., Price, S. Handbook on Mechanical Circulatory Support - Quick access to most relevant practical information on Mechanical Circulatory Support 2022 edition. 2022.
- Balthazar, T., Vandenbriele, C., Verbrugge, F.H. et al. Managing Patients With Short- Term Mechanical Circulatory Support. J Am Coll Cardiol, 2021, 77 (9), 1243-1256.
- Schrage, B., Beer, B.N., Savarese, G. et al. Eligibility for mechanical circulatory support devices based on current and past randomised cardiogenic shock trials. Eur J Heart Fail, 2021, 23 (11), 1942-1951.
- Pahuja, M., Johnson, A., Kabir, R. et al. Randomized Trials of Percutaneous Microaxial Flow Pump Devices: JACC Stateof- the-Art Review. J Am Coll Cardiol, 2022, 80 (21), 2028-2049.
- Vandenbriele C., Tavazzi G., Price S. Caution With Conclusions and Context of Mechanical Circulatory Devices. JAMA Intern Med, 2023, 183 (3), 277.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.