étant donné la prévalence élevée de la carence martiale chez les patients souffrant d'insuffisance cardiaque, une recherche systématique d'une carence martiale est nécessaire, qu'il y ait ou non une anémie. Cette approche permet d'identifier les candidats à un traitement intraveineux par fer (III)-carboxymaltose, dans le but d'améliorer les critères d'évaluation de substitution.
Introduction
La carence en fer est l'une des carences nutritionnelles les plus fréquentes. à l'échelle mondiale, plus de deux milliards de personnes manquent de fer.1 Ce sont surtout les enfants, les adultes jeunes, les sujets âgés, les femmes en âge de procréer ou enceintes et les personnes souffrant d'une affection inflammatoire chronique qui sont susceptibles de présenter une carence en fer.2 Outre son rôle essentiel en tant qu'élément pour l'érythropoïèse, le fer joue également un rôle important au niveau du transport de l'oxygène, de la fonction mitochondriale, de la synthèse et de la dégradation des protéines, des lipides et de l'ARN/ADN, de la fonction normale du tissu musculaire squelettique et cardiaque, de la fonction thyroïdienne, de l'intégrité et de la fonction du système nerveux central et enfin également du système immunitaire.3, 4 En dépit de l'effet pléiotrope du fer dans l'organisme, les réserves de fer sont prioritairement destinées à l'érythropoïèse. Ainsi, un trouble de l'érythropoïèse avec développement d'une anémie ferriprive ne se manifestera que tardivement dans le processus pathologique de la carence martiale.4 Les patients souffrant d'insuffisance cardiaque sont extrêmement sensibles au développement d'une carence en fer, laquelle est rapportée chez 30 à 50 % des patients de cette population.5, 6 Cette carence martiale est considérée comme l'une des comorbidités les plus fréquentes dans le cadre du syndrome d'insuffisance cardiaque, et elle est associée à une diminution de la qualité de vie, à des hospitalisations fréquentes et à une mortalité accrue.7 Les effets néfastes de la carence en fer vont bien au-delà de la seule anémie ferriprive, et ils sont déjà perceptibles dès les stades les plus précoces de carence martiale, même en l'absence d'anémie.8 étant donné le rôle central du fer dans le processus pathologique de l'insuffisance cardiaque, plusieurs études ont testé l'effet d'une correction du taux de fer. Cet article de synthèse étudie le rôle, le diagnostic et le traitement de la carence martiale chez les patients souffrant d'insuffisance cardiaque.
2 Physiologie du métabolisme du fer
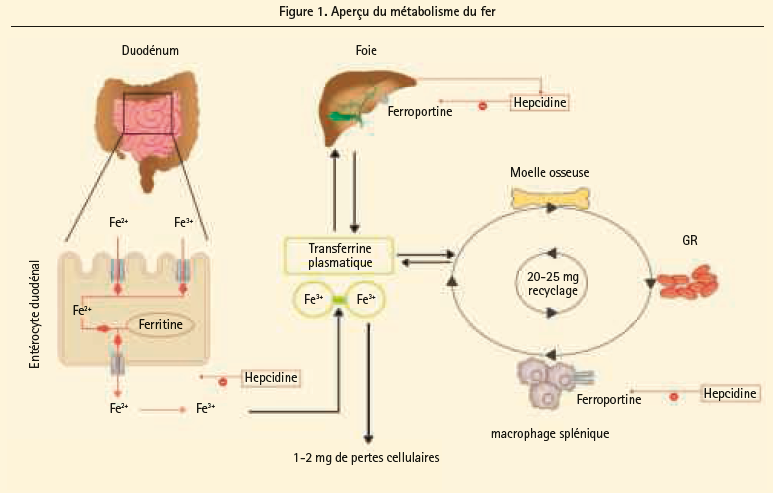
Tant une carence en fer que son accumulation excessive sont associées à des maladies.9, 10 C'est pour cette raison qu'une régulation stricte du métabolisme du fer dans l'organisme est souhaitable. étant donné l'absence d'un mécanisme permettant l'excrétion active du fer par voie rénale ou gastro-intestinale, c'est surtout l'absorption du fer qui est régulée.10 Une alimentation occidentale apporte 10 à 20 mg de fer par jour, dont 10 à 20 % sont absorbés par les entérocytes duodénaux. Le fer existe sous deux formes différentes dans l'alimentation, à savoir le fer héminique (Fe2+) et le fer non héminique (Fe3+). 90 % du fer alimentaire sont constitués de fer non héminique mais, étant donné sa meilleure biodisponibilité, le fer héminique représentera quand même 40 % du fer total absorbé.11, 12 Les besoins quotidiens en fer d'un homme adulte en bonne santé atteignent 1 mg, contre 3 mg pour une femme adulte en période de menstruations. 11 Ces besoins visent à compenser les pertes quotidiennes de fer résultant de la desquamation cellulaire et des pertes de sang physiologiques. Le processus de l'absorption du fer est fortement régulé, étant donné que le fer libre peut induire un stress oxydatif, via des réactions de Fenton.13 Outre l'absorption intestinale du fer, son recyclage est également un processus soumis à une régulation stricte. Chaque jour, on a besoin de 20 à 25 mg de fer pour assurer la production de globules rouges et le fonctionnement intact du métabolisme cellulaire. Il est clair que la quantité de fer qui parvient quotidiennement au niveau entéral est insuffisante pour répondre à ces besoins cellulaires, de sorte que le recyclage du fer est essentiel. L'étape limitant la vitesse au niveau de l'absorption intestinale du fer se situe au niveau du transporteur, la ferroportine, qu'on trouve au côté basolatéral de l'entérocyte. Ce transporteur est essentiel pour la libération des réserves de fer au départ de l'entérocyte, des macrophages spléniques et du foie. La régulation de ce transporteur implique l'hormone peptidique appelée hepcidine, dont les concentrations élevées ont un effet inhibiteur sur le transport. De cette manière, l'hepcidine régule la concentration de fer circulant. La carence martiale et l'hypoxémie inhibent l'hepcidine, tandis que l'excès de fer et l'inflammation stimulent son expression.14 On sait que le statut inflammatoire chronique observé chez les patients souffrant d'insuffisance cardiaque influence négativement le processus d'absorption entérale du fer. Ceci explique également l'absorption gastro-intestinale plutôt limitée des suppléments de fer administrés par voie entérale. La figure 1 donne un aperçu schématique du métabolisme normal du fer.
3 évaluation de la carence martiale
Les symptômes d'une carence martiale sont souvent vagues et aspécifiques, de sorte que l'anamnèse ne permet pas de poser un diagnostic fiable. Pour cette raison, l'évaluation systématique des paramètres relatifs au fer est préconisée dans les recommandations européennes relatives au traitement de l'insuffisance cardiaque, avec un niveau de preuve IC.15 Il existe plusieurs tests biochimiques pour évaluer l'homéostasie du fer.16 Une bonne connaissance de la sensibilité, de la spécificité et des imperfections diagnostiques est nécessaire pour diagnostiquer correctement une carence martiale. Le tableau 1 donne un aperçu des caractéristiques diagnostiques des tests biochimiques disponibles. La définition de la carence martiale dans le cadre de la cardiologie provient de la littérature au sujet de l'insuffisance cardiaque à fraction d'éjection réduite, étant donné que la carence martiale a été étudiée en détail dans ce contexte. Le diagnostic de déficience en fer chez le patient souffrant d'insuffisance cardiaque peut être posé si la ferritine sérique est inférieure à 100 μg/l, ou si elle est inférieure à 300 μg/l, conjointement à une saturation de la transferrine inférieure à 20 %.17 La valeur seuil de la ferritine en cas d'insuffisance cardiaque est plus élevée que la valeur classiquement rapportée chez les personnes en bonne santé (en l'occurrence une ferritine < 30 μg/l).18-20 étant donné que l'environnement pro-inflammatoire qui caractérise l'insuffisance cardiaque entraîne une carence martiale fonctionnelle (séquestration intracellulaire du fer), en plus d'une carence martiale absolue, les seuils diagnostiques en cas d'insuffisance cardiaque sont plus élevés. Ainsi, même un taux de ferritine allant jusqu'à 300 μg/l peut cadrer avec un diagnostic de carence martiale, pour autant qu'il y ait également un autre signe de biodisponibilité limitée du fer, comme une saturation de la transferrine basse (< 20 %). Dans la plupart des études portant sur l'insuffisance cardiaque, ces critères sont considérés comme diagnostiques de la carence en fer.21, 22

4 Prévalence de la carence martiale en cas d'insuffisance cardiaque
Tant la carence martiale que l'anémie sont fréquentes chez les patients souffrant d'insuffisance cardiaque. En dépit du fait que la carence martiale soit une importante cause d'anémie chez les patients souffrant d'insuffisance cardiaque, plusieurs mécanismes physiopathologiques contribuent à l'anémie dans cette population. On rapporte que la prévalence d'anémie chez les patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite varie entre 13,2 % et 42,6 %,22-27 tandis qu'elle varie entre 18,7 % et 38,0 % chez les patients ayant une fraction d'éjection préservée.23, 25, 26 Une étude canadienne portant sur 12 065 patients chez qui on avait posé un nouveau diagnostic d'insuffisance cardiaque (indépendamment de la fraction d'éjection) indique que seuls 21 % des patients anémiques présentent une carence martiale sous-jacente.28 Toutefois, cette étude avait utilisé des critères plus stricts pour le diagnostic de la carence martiale, à savoir une ferritine sérique inférieure à 30 μg/l, de sorte qu'on n'a pas tenu compte de la carence martiale fonctionnelle. Si nous utilisons les critères classiques de la carence martiale (ferritine < 100 μg/l ou < 300 μg/l, conjointement à une saturation de la transferrine < 20 %), une étude européenne observationnelle prospective conduite chez des patients souffrant d'insuffisance cardiaque (fraction d'éjection moyenne égale à 26 % et classes NYHA II et III) indique que 37 % des patients présentaient une carence martiale, que 57 % de ces patients présentaient une anémie sous-jacente, et que 32 % n'étaient pas anémiques.5 Dans cette population, la carence martiale était associée au critère d'évaluation combiné de mortalité et de risque de transplantation cardiaque, et ce, indépendamment de la présence ou non d'une anémie. Une analyse de la banque de données américaine NHANES ('US National Health and Nutrition Examination Survey') indique que 352 des 574 patients souffrant d'insuffisance cardiaque (61 %) présentent une carence martiale, selon les critères classiques (ferritine < 100 μg/l ou < 300 μg/l, conjointement à une saturation de la transferrine < 20 %).29 Une analyse rétrospective effectuée sur 310 patients stables, souffrant de HFrEF, suivis dans notre service d'insuffisance cardiaque, ayant une classe fonctionnelle NYHA (New York Heart Association) II-IV et une fraction d'éjection moyenne de 30 % nous apprend que la prévalence de la carence martiale atteint 53 %.
5 Effets néfastes de la carence martiale en cas d'insuffisance cardiaque
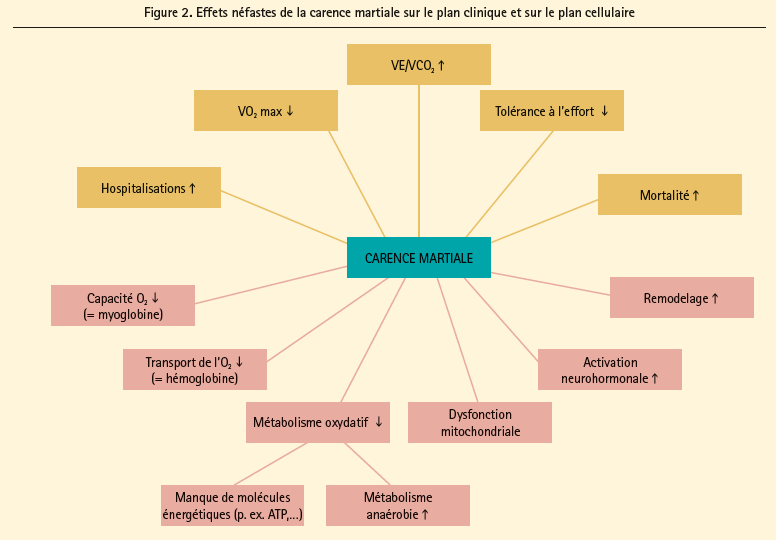
Le rôle de la carence martiale en tant que composante physiopathologique et cible thérapeutique dans le cadre du syndrome d'insuffisance cardiaque a été étudié en détail.7 La figure 2 schématise les effets néfastes de la carence martiale en cas d'insuffisance cardiaque. Les informations relatives aux conséquences cliniques ont surtout été étudiées chez des patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite. Les patients souffrant d'insuffisance cardiaque chronique à fraction d'éjection réduite et d'une carence martiale présentent une diminution de la VO2-max, une réponse ventilatoire plus élevée à l'effort (VE/VCO2) et une diminution de la tolérance à l'effort, et ce, indépendamment de la présence ou non d'une anémie.30 En ce qui concerne le pronostic à long terme, une étude prospective observationnelle indique que les patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite, déficients en fer, courent un risque accru d'atteindre le critère d'évaluation combiné de mortalité ou de transplantation cardiaque, au bout de 3 ans de suivi.30 Une deuxième étude a montré que la présence d'une carence martiale est un important déterminant de la survie au bout de 30 mois de suivi, dans une population similaire de patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite, déficients en fer, chez qui une intervention coronaire était planifiée.31 Contrairement à ces critères d'évaluation cliniques, les effets néfastes de la carence martiale au niveau moléculaire sont surtout documentés dans des modèles animaux dans lesquels on a induit une insuffisance cardiaque. Outre son rôle comme constituant de l'hémoglobine, le fer joue également un rôle important dans la chaîne de transport des électrons des mitochondries. C'est de cette manière que le métabolisme oxydatif peut diminuer, même indépendamment du taux d'hémoglobine. étant donné le rôle majeur de la chaîne de transport des électrons dans la production d'ATP qui, via une navette de la créatine-phosphokinase, fournit un substrat énergétique aux myofilaments cardiaques, mais également vu le rôle important dans la production de NADPH qui contribue à protéger du stress oxydatif, les conséquences cellulaires de la carence martiale sont pléiotropes. Dans les modèles animaux, la carence martiale entraîne en effet une activité sympathique accrue,32 une hypertrophie ventriculaire gauche33-35 débouchant en fin de compte sur une dilatation ventriculaire gauche,36 un remodelage de la matrice extracellulaire,37 une dysfonction mitochondriale38 et des concentrations plus élevées d'ANP et de BNP.39 Cette constellation d'observations néfastes associées à la carence martiale forme la base des études interventionnelles qui évaluent l'effet du traitement à base de fer en cas d'insuffisance cardiaque.
6 Traitements pour la correction de la carence martiale
Les options thérapeutiques disponibles pour corriger la carence martiale consistent en l'administration entérale ou parentérale de fer. L'utilisation de fer entéral en cas d'insuffisance cardiaque est limitée, étant donné la biodisponibilité réduite du fer entéral et les inconforts pour le patient (goût métallique et troubles gastro-intestinaux).10 Classiquement, on prescrit une dose de 200 mg de Fe2+ aux patients souffrant d'anémie ferriprive. En raison de la saturation, à cette dose, des récepteurs basolatéraux au niveau des entérocytes duodénaux, des doses plus élevées ne sont pas efficaces.10 D'un point de vue physiopathologique, le fer entéral n'est pas un traitement de choix pour les patients souffrant d'insuffisance cardiaque et d'une carence martiale, car une grande partie de ces patients présentent une anémie fonctionnelle, dans laquelle on observe une libération limitée des réserves de fer intracellulaire, suite à une régulation positive de l'hepcidine (voir 2. Physiologie du métabolisme du fer).7 étant donné la régulation positive de l'hepcidine, l'absorption entérale du fer sera également perturbée chez les patients souffrant d'insuffisance cardiaque (figure 1). Jusqu'à présent, il n'existe pas d'études randomisées méthodologiquement étayées ayant testé l'effet du fer entéral vs parentéral chez des patients souffrant d'insuffisance cardiaque.
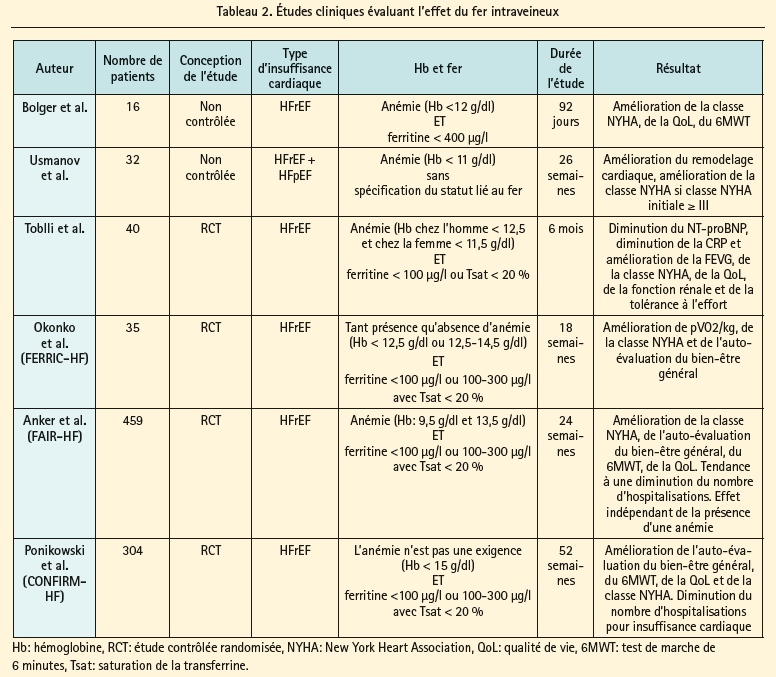
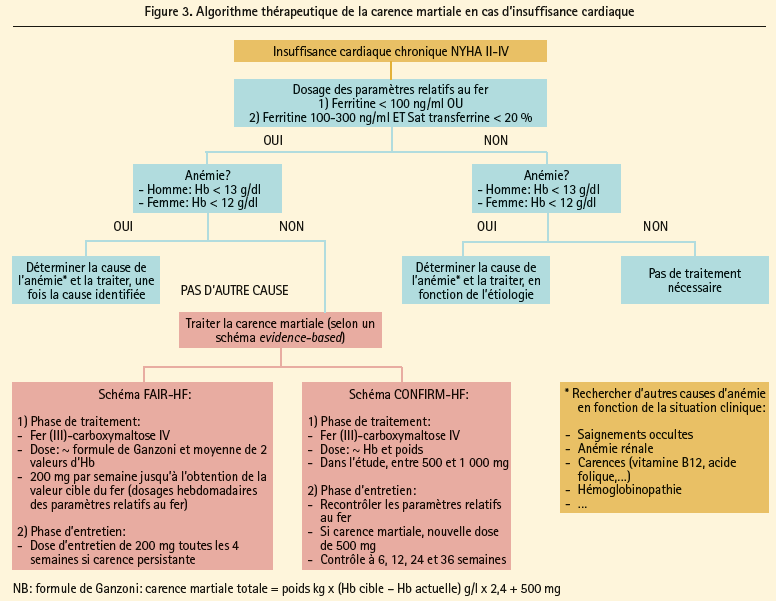
Le fer intraveineux a l'avantage théorique d'être efficace, même en cas de carence martiale fonctionnelle induite par des concentrations d'hepcidine élevées. En tout, 6 études différentes (tant ouvertes que randomisées en double aveugle) ont examiné l'effet du fer intraveineux chez des patients souffrant d'insuffisance cardiaque.40-45 Le tableau 2 donne un aperçu schématique des caractéristiques de ces études. La plupart d'entre elles portaient sur des patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite (classiquement < 45 %), présentant des signes de carence martiale (ferritine < 100 μg/l ou ferritine < 300 μg/l avec une saturation de la transferrine < 20 %), avec ou sans anémie. Parmi toutes ces études, l'étude FAIR-HF et l'étude CONFIRM-HF ont le protocole le plus rigoureux et méthodologiquement étayé.44, 45 Ces deux études ont démontré que l'utilisation de fer (III)-carboxymaltose chez les patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite associée à une carence martiale (indépendamment de la présence ou non d'une anémie) est efficace en ce qui concerne l'amélioration des critères d'évaluation de substitution que sont la qualité de vie, l'auto-évaluation du bien-être général, les classes NYHA et les marqueurs de capacité à l'effort tels que le test de marche de 6 minutes. Tant l'étude CONFIRM-HF que les méta-analyses des différentes études indiquent une diminution du nombre d'hospitalisations pour insuffisance cardiaque.45, 46 Jusqu'à présent, aucune étude ne disposait d'une puissance statistique suffisante pour évaluer les effets sur la survie. étant donné que ces études ont essentiellement été conduites auprès de patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite, on ne peut tirer de conclusions au sujet de l'utilité du fer intraveineux chez les patients souffrant d'insuffisance cardiaque à fraction d'éjection préservée. Actuellement, une étude internationale randomisée en double aveugle est en cours, laquelle teste l'effet de l'administration intraveineuse de fer (III)-carboxymaltose chez des patients souffrant d'insuffisance cardiaque à fraction d'éjection préservée (étude FAIR-HFpEF). étant donné les effets bénéfiques de l'administration intraveineuse de fer (III)-carboxymaltose, les recommandations européennes de 2012 relatives au traitement de l'insuffisance cardiaque préconisent l'utilisation de fer intraveineux chez les patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite.15 Actuellement, le fer (III)-carboxymaltose intraveineux est remboursé en Belgique pour le traitement de la carence martiale, si on ne peut administrer de suppléments de fer par voie orale, ou si ce traitement n'est pas assez efficace. Cette analyse permet bien entendu de comprendre que la justification de l'administration orale de fer est limitée et qu'elle correspond aux notions physiopathologiques de la carence martiale en cas d'insuffisance cardiaque. En cas d'anémie ferriprive, il va de soi qu'il faut toujours rechercher la cause de l'anémie. En cas de carence en fer, on recommande d'administrer 500-1 000 mg de fer (III)-carboxymaltose IV (Injectafer®), avec un contrôle 6 à 12 semaines plus tard. La plupart des patients ont des réserves de fer suffisantes pour un an, après un traitement à une dose de 1 000-1 500 mg. Enfin, la figure 3 illustre une proposition d'algorithme thérapeutique pour la carence martiale chez les patients souffrant d'insuffisance cardiaque et d'une diminution de la fraction d'éjection.
Références
- DeMaeyer, E., Adiels-Tegman, M. The prevalence of anaemia in the world. World Health Stat Q, 1985, 38, 302-316.
- Stoltzfus, R. Defining iron-deficiency anemia in public health terms: a time for reflection. J Nutr, 2001, 131, 565S-567S.
- Andrews, N.C. Disorders of iron metabolism. N Engl J Med, 1999, 341 (26), 1986-1995.
- Andrews, N.C. Iron homeostasis: insights from genetics and animal models. Nat Rev Genet, 2000, 1, 208-217.
- Jankowska, E.A., Rozentryt, P., Witkowska, A. et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J, 2010, 31 (15), 1872-1880.
- Klip, I.T., Comin-Colet, J., Voors, A.A. et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, 165, 575-582.
- Jankowska, E.A., von Haehling, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34, 816-829.
- Besarab, A., Horl, W.H., Silverberg, D. Iron metabolism, iron deficiency, thrombocytosis, and the cardiorenal anemia syndrome. Oncologist, 2009, 14, Suppl 1, 22-33.
- Fleming, R.E., Ponka, P. Iron overload in human disease. N Engl J Med, 2012, 366 (4), 348-359.
- Lopez, A., Cacoub, P., Macdougall, I.C., Peyrin-Biroulet, L. Iron deficiency anaemia. Lancet, 2015 [E-pub ahead of print].
- Hurrell, R., Egli, I. Iron bioavailability and dietary reference values. Am J Clin Nutr, 2010, 91, 1461S-1467S.
- McDermid, J.M., Lonnerdal, B. Iron. Adv Nutr, 2012, 3, 532-533.
- Munzel, T., Gori, T., Keaney, J.F., Jr., Maack, C., Daiber, A. Pathophysiological role of oxidative stress in systolic and diastolic heart failure and its therapeutic implications. Eur Heart J, 2015, 36, 2555-2564.
- Weiss, G., Goodnough, L.T. Anemia of chronic disease. N Engl J Med, 2005, 352, 1011-1023.
- McMurray, J.J., Adamopoulos, S., Anker, S.D. et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2012, 14, 803-869.
- Wish, JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol, 2006, 1, Suppl 1, S4-S8.
- von Haehling, S., Jankowska, E.A., van Veldhuisen, D.J., Ponikowski, P., Anker, S.D. Iron deficiency and cardiovascular disease. Nat Rev Cardiol, 2015, 12, 659-669.
- Pasricha, S.R., Flecknoe-Brown, S.C., Allen, K.J. et al. Diagnosis and management of iron deficiency anaemia: a clinical update. Med J Aust, 2010, 193, 525-532.
- Goodnough, L.T., Nemeth, E., Ganz, T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood, 2010, 116, 4754-4761.
- Koulaouzidis, A., Said, E., Cottier, R., Saeed, A.A. Soluble transferrin receptors and iron deficiency, a step beyond ferritin. A systematic review. J Gastrointestin Liver Dis, 2009, 18, 345-352.
- Okonko, D.O., Grzeslo, A., Witkowski, T. et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol, 2008, 51, 103-112.
- Anker, S.D., Comin, C.J., Filippatos, G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Felker, G.M., Shaw, L.K., Stough, W.G., O'Connor, C.M. Anemia in patients with heart failure and preserved systolic function. Am Heart J, 2006, 151, 457-462.
- Komajda, M., Anker, S.D., Charlesworth, A. et al. The impact of new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J, 2006, 27, 1440-1446.
- O'Meara, E., Clayton, T., McEntegart, M.B. et al. Clinical correlates and consequences of anemia in a broad spectrum of patients with heart failure: results of the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) Program. Circulation, 2006, 113, 986-994.
- von, H.S., van Veldhuisen, D.J., Roughton, M. et al. Anaemia among patients with heart failure and preserved or reduced ejection fraction: results from the SENIORS study. Eur J Heart Fail, 2011, 13, 656-663.
- Anker, S.D., Voors, A., Okonko, D. et al. Prevalence, incidence, and prognostic value of anaemia in patients after an acute myocardial infarction: data from the OPTIMAAL trial. Eur Heart J, 2009, 30, 1331-1339.
- Ezekowitz, J.A., McAlister, F.A., Armstrong, P.W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new-onset heart failure. Circulation, 2003, 107, 223-225.
- Parikh, A., Natarajan, S., Lipsitz, S.R., Katz, S.D. Iron deficiency in community-dwelling US adults with self-reported heart failure in the National Health and Nutrition Examination Survey III: prevalence and associations with anemia and inflammation. Circ Heart Fail, 2011, 4, 599-606.
- Jankowska, E.A., Rozentryt, P., Witkowska, A. et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail, 2011, 17, 899-906.
- Varma, A., Appleton, D.L., Nusca, A. et al. Iron deficiency anemia and cardiac mortality in patients with left ventricular systolic dysfunction undergoing coronary stenting. Minerva Cardioangiol, 2010, 58, 1-10.
- Turner, L.R., Premo, D.A., Gibbs, B.J. et al. Adaptations to iron deficiency: cardiac functional responsiveness to norepinephrine, arterial remodeling, and the effect of beta-blockade on cardiac hypertrophy. BMC Physiol, 2002, 2, 1.
- Olivetti, G., Lagrasta, C., Quaini, F. et al. Capillary growth in anemia-induced ventricular wall remodeling in the rat heart. Circ Res, 1989, 65, 1182-1192.
- Olivetti, G., Quaini, F., Lagrasta, C. et al. Myocyte cellular hypertrophy and hyperplasia contribute to ventricular wall remodeling in anemia-induced cardiac hypertrophy in rats. Am J Pathol, 1992, 141, 227-239.
- Rossi, M.A., Carillo, S.V. Electron microscopic study on the cardiac hypertrophy induced by iron deficiency anaemia in the rat. Br J Exp Pathol, 1983, 64, 373-387.
- Medeiros, D.M., Beard, J.L. Dietary iron deficiency results in cardiac eccentric hypertrophy in rats. Proc Soc Exp Biol Med, 1998, 218, 370-375.
- Chvapil, M., Hurych, J., Ehrlichova, E. The effect of iron deficiency on the synthesis of collagenous and noncollagenous proteins in wound granulation tissue and in the heart of rats. Exp Med Surg, 1968, 26, 52-60.
- Dong, F., Zhang, X., Culver, B., Chew, H.G., Jr., Kelley, R.O., Ren, J. Dietary iron deficiency induces ventricular dilation, mitochondrial ultrastructural aberrations and cytochrome c release: involvement of nitric oxide synthase and protein tyrosine nitration. Clin Sci (Lond), 2005, 109, 277-286.
- Naito, Y., Tsujino, T., Matsumoto, M., Sakoda, T., Ohyanagi, M., Masuyama, T. Adaptive response of the heart to long-term anemia induced by iron deficiency. Am J Physiol Heart Circ Physiol, 2009, 296, H585-H593.
- Toblli, J.E., Lombrana, A., Duarte, P., Di, G.F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol, 2007, 50, 1657-1665.
- Bolger, A.P., Bartlett, F.R., Penston, H.S. et al. Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol, 2006, 48, 1225-1227.
- Usmanov, R.I., Zueva, E.B., Silverberg, D.S., Shaked, M. Intravenous iron without erythropoietin for the treatment of iron deficiency anemia in patients with moderate to severe congestive heart failure and chronic kidney insufficiency. J Nephrol, 2008, 21, 236-242.
- Okonko, D.O., Grzeslo, A., Witkowski, T. et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol, 2008, 51, 103-112.
- Anker, S.D., Comin, C.J., Filippatos, G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiencydagger. Eur Heart J, 2015, 36, 657-668.
- Qian, C., Wei, B., Ding, J., Wu, H., Wang, Y. The Efficacy and Safety of Iron Supplementation in Patients With Heart Failure and Iron Deficiency: A Systematic Review and Meta-analysis. Can J Cardiol, 2015, [E-pub ahead of print].
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.