Gezien de hoge prevalentie van ijzertekort bij hartfalenpatiënten, is systematische screening naar ijzertekort ongeacht de aanwezigheid van anemie noodzakelijk. Deze aanpak laat toe kandidaten te identificeren voor intraveneuze therapie met ijzer (III)-carboxymaltose met als doel surrogaateindpunten te verbeteren.
1 Inleiding
IJzertekort is een van de meest frequente nutritionele deficiënties. Wereldwijd lijden meer dan twee miljard mensen aan ijzertekort.1 Vooral kinderen, jongvolwassenen, bejaarden, vrouwen in de vruchtbare periode of zwangerschap en personen met een chronisch inflammatoire aandoening zijn vatbaar voor ijzertekort.2 Naast een essentiële rol als bouwsteen tijdens de erythropoiesis, speelt ijzer ook een belangrijke rol in het zuurstoftransport, de mitochondriale functie, de synthese en biodegradatie van eiwitten, in lipiden en RNA/DNA, in de normale functie van skelet- en hartspierweefsel, de schildklierfunctie, de integriteit en functie van het centraal zenuwstelsel en ten slotte ook in het immuunsysteem.3, 4 Ondanks het pleiotrope effect van ijzer in het lichaam is er een voorrang van de ijzerreserves als substraat bestemd voor de erythropoiesis. Op deze manier zal een gestoorde erythropoiesis met het ontwikkelen van ferriprieve anemie zich pas laat manifesteren in het ziekteproces van ijzertekort.4 Patiënten met hartfalen zijn extreem gevoelig voor het ontwikkelen van ijzertekort. IJzertekort wordt in deze populatie gerapporteerd bij 30 tot 50 % van de patiënten.5, 6 Deze ijzerdeficiëntie wordt beschouwd als een van de meest frequente comorbiditeiten binnen het hartfalensyndroom en is geassocieerd aan een verminderde kwaliteit van leven, frequente hospitalisatie en toegenomen mortaliteit.7 De nadelige effecten van ijzertekort gaan veel verder dan alleen ferriprieve anemie en zijn al voelbaar in vroegere stadia van ijzertekort, zelfs in de afwezigheid van anemie.8 Gezien de centrale rol van ijzer in het ziekteproces van hartfalen hebben meerdere studies het effect van ijzercorrectie getest. Dit overzichtsartikel bestudeert de rol, de diagnose en de behandeling van ijzertekort bij hartfalenpatiënten.
2 Fysiologie van het ijzermetabolisme
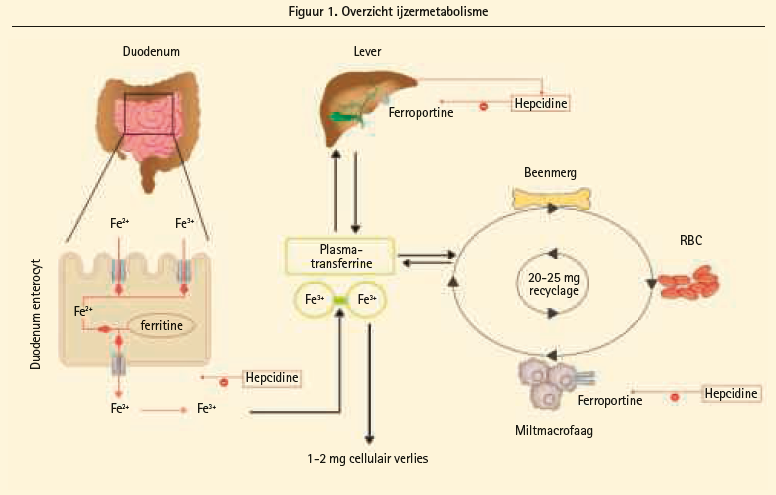
Zowel tekorten aan ijzer als excessieve stapeling van ijzer zijn geassocieerd met ziekte.9, 10 Daarom is een strenge regulatie van het ijzermetabolisme in het lichaam wenselijk. Gezien de afwezigheid van een mechanisme dat actieve excretie van ijzer via een renale of gastro-intestinale tractus toelaat, is het vooral de absorptie van ijzer die gereguleerd wordt.10 Een westers dieet bevat 10 à 20 mg ijzer per dag, waarvan 10 tot 20 % geabsorbeerd wordt door de duodenale enterocyten. IJzer komt in twee verschillende vormen voor in de voeding, namelijk als haemijzer (Fe2+) en als niet-haemijzer (Fe3+). 90 % van het dieetijzer bestaat uit niet-haemijzer, maar gezien de betere biobeschikbaarheid zal het haemijzer toch 40 % deel uitmaken van het totaal geabsorbeerd ijzer.11, 12 De dagelijkse ijzerbehoefte van een volwassen gezonde man bedraagt 1 mg, voor een volwassen menstruerende vrouw is dit 3 mg.11 Deze behoefte is erop gericht het dagelijkse ijzerverlies ten gevolge van cellulaire shedding en fysiologisch bloedverlies te compenseren. Het proces van ijzerabsorptie is sterk gereguleerd, aangezien vrij ijzer voor de inductie van oxidatieve stress kan zorgen via fentonreacties.13 Naast de intestinale opname van ijzer is ook de recyclage van ijzer een proces dat onderhevig is aan een strenge regulatie. Dagelijks is er een ijzerbehoefte van 20 tot 25 mg om te voorzien in de productie van rode bloedcellen en het intact functioneren van het cellulaire metabolisme. Het is duidelijk dat de dagelijkse enteraal aangeboden ijzerconcentratie onvoldoende is om aan deze cellulaire noden te voorzien, zodat recyclage van ijzer essentieel is. De snelheidsbepalende stap in de intestinale absorptie van ijzer bevindt zich op het niveau van de transporter ferroportine dat voorkomt aan de basolaterale zijde van de enterocyt. Deze transporter is essentieel voor het vrijzetten van de ijzerreserves uit de enterocyt, de miltmacrofagen en de lever. De regulatie van deze transporter verloopt via het signaalhormoon hepcidine, waarbij hoge concentraties een inhiberend effect hebben op het transport. Op deze manier reguleert hepcidine de concentratie aan circulerend ijzer. IJzerdeficiëntie en hypoxemie onderdrukken hepcidine, terwijl ijzerexces en inflammatie de expressie van hepcidine stimuleren.14 Het is geweten dat de chronisch inflammatoire status bij hartfalenpatiënten het proces van enterale ijzerabsorptie negatief beïnvloedt. Dit verklaart ook de eerder beperkte gastro-intestinale absorptie van enteraal toegediende ijzersupplementen. Figuur 1 geeft een schematisch overzicht van het normale ijzermetabolisme.
3 Evaluatie van ijzerdeficiëntie
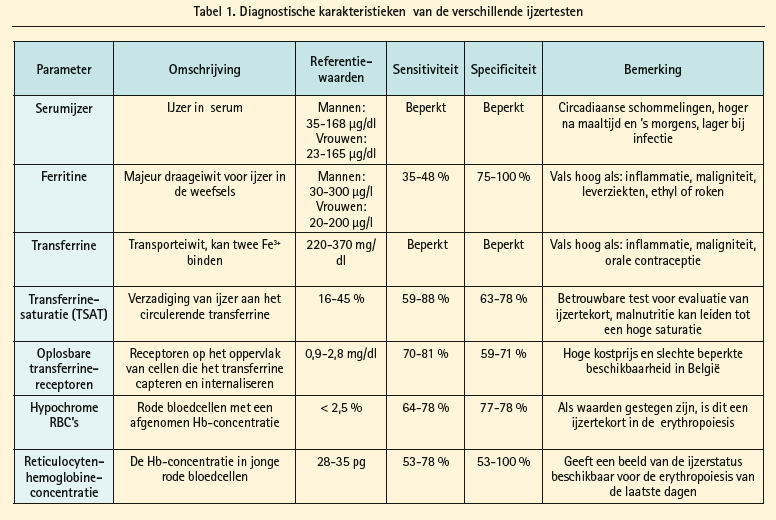
Klachten van ijzertekort zijn vaak vaag en aspecifiek, zodat er via de anamnese geen betrouwbare diagnose gesteld kan worden. Systematische evaluatie van de ijzerset wordt om deze reden geadviseerd in de Europese richtlijnen voor de behandeling van hartfalen met klasse IC-evidentie.15 Verschillende biochemische testen zijn beschikbaar om de ijzerhomeostase te evalueren.16 Goede kennis over sensitiviteit, specificiteit en diagnostische onvolkomenheden is vereist voor het correct diagnosticeren van ijzertekort. Tabel 1 geeft een overzicht van de diagnostische karakteristieken van de beschikbare biochemische testen. De definitie van ijzertekort binnen de cardiologie komt uit de literatuur over hartfalen met verminderde ejectiefractie aangezien ijzertekort in deze setting extensief bestudeerd is geweest. De diagnose van ijzerdeficiëntie bij de hartfalenpatiënt kan gesteld worden zo de serumferritine minder dan 100 μg/L bedraagt of als de serumferritine minder dan 300 μg/L bedraagt met tevens een transferrinesaturatie van minder dan 20 %.17 De cutoffwaarde van ferritine bij hartfalen ligt hoger dan klassiek gerapporteerd wordt bij gezonde personen (namelijk ferritine < 30 μg/L).18-20 Aangezien het pro-inflammatoire hartfalenmilieu aanleiding geeft tot een functioneel ijzertekort (intracellulaire sekwestratie van ijzer) naast een absoluut ijzertekort, zijn de diagnostische grenzen bij hartfalen hoger. Zo laat dus zelfs een ferritinegehalte tot 300 μg/L toe ijzertekort te diagnosticeren, zolang er ook een ander teken is van beperkte ijzerbiobeschikbaarheid, zoals een lage transferrinesaturatie (< 20 %). Deze criteria worden in de meeste hartfalentrials gehanteerd als zijnde diagnostisch voor ijzerdeficiëntie.21, 22
4 Prevalentie van ijzertekort bij hartfalen
Zowel ijzertekort als anemie komt frequent voor bij de hartfalenpatiënt. Ondanks dat ijzertekort een belangrijke oorzaak is van anemie bij hartfalenpatiënten, zijn er meerdere pathofysiologische mechanismen die bijdragen tot de anemie in deze populatie. De prevalentie van anemie bij hartfalenpatiënten met verminderde ejectiefractie wordt gerapporteerd tussen de 13,2 % en 42,6 %,22-27 voor patiënten met een bewaarde ejectiefractie is dit tussen 18,7 % en 38,0 %.23, 25, 26 Een Canadese studie bij 12 065 patiënten met een nieuwe diagnose van hartfalen (ongeacht ejectiefractie) toont dat slechts 21 % van de patiënten met anemie een onderliggend ijzertekort hebben.28 Deze studie maakte echter gebruik van strengere criteria voor de diagnose van ijzertekort, namelijk een serumferritine van minder dan 30 μg/L zodat er geen rekening gehouden werd met functioneel ijzertekort. Als we de klassieke criteria van ijzertekort (ferritine < 100 μg/L of < 300 μg/L met tevens een transferrinesaturatie van < 20 %) toepassen, toont een prospectieve Europese observationele studie bij hartfalenpatiënten (ejectiefractie gemiddeld 26 % en NYHA-klasse II en III) dat 37 % van de patiënten ijzertekort heeft, onderliggend had 57 % van deze patiënten anemie en was 32 % niet-anemisch.5 In deze populatie was ijzertekort, ongeacht de aanwezigheid van anemie, geassocieerd met het gecombineerd eindpunt mortaliteit en kans op harttransplantatie. Een analyse van de Amerikaanse NHANES-databank ('US National Health and Nutrition Examination Survey') toont dat 352 van de 574 hartfalenpatiënten (61 %) ijzertekort hebben volgens de klassieke criteria (ferritine < 100 μg/L of < 300 μg/L met tevens een transferrinesaturatie van < 20 %).29 Een retrospectieve analyse bij 310 stabiele HFrEF-patiënten gevolgd binnen onze hartfalendienst met een functionele status New York Heart Association klasse (NYHA) II-IV en een gemiddelde ejectiefractie van 30 % leert dat ijzertekort een prevalentie heeft van 53 %.
5 Nadelige effecten van ijzertekort bij hartfalen
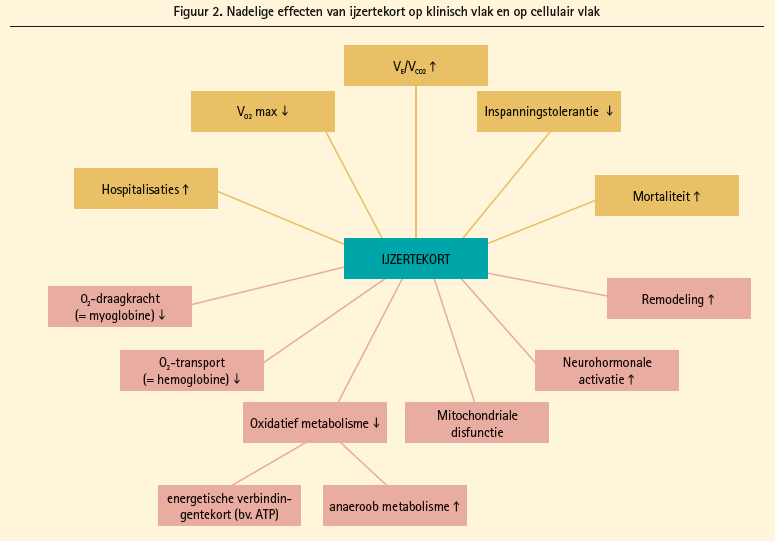
De rol van ijzertekort als pathofysiologische component en therapeutische target binnen het hartfalensyndroom is extensief bestudeerd.7 Figuur 2 geeft een schematisch overzicht van de nadelige effecten van ijzertekort bij hartfalen. Informatie met betrekking tot de klinische consequenties zijn vooral bestudeerd in patiënten met hartfalen met verminderde ejectiefractie. Patiënten met chronisch hartfalen met verminderde ejectiefractie en tevens ijzertekort vertonen een verminderde VO2-max, een hogere ventilatoire respons bij inspanning (VE/VCO2) en een afgenomen inspanningstolerantie ongeacht de aanwezigheid van anemie.30 Wat betreft de langetermijnprognose, toont één prospectieve observationele studie dat ijzerdeficiënte hartfalenpatiënten met verminderde ejectiefractie na 3 jaar follow-up een hoger risico hebben op het bereiken van het gecombineerde eindpunt mortaliteit of harttransplantatie.30 Een tweede studie toont in een soortgelijke populatie van ijzerdeficiënte hartfalenpatiënten met verminderde ejectiefractie gepland voor coronaire interventie dat aanwezigheid van ijzertekort een belangrijke determinant is van overleving na 30 maanden followup.31 In tegenstelling tot deze klinische eindpunten zijn de nadelige effecten van ijzertekort op moleculair niveau vooral gedocumenteerd in diermodellen met geïnduceerd hartfalen. IJzer speelt naast zijn rol als bouwsteen voor hemoglobine, tevens een belangrijke rol in de elektronentransportketen van de mitochondriën. Op deze manier kan het oxidatief metabolisme afnemen, zelfs los van de hemoglobineconcentratie. Gezien de belangrijke rol van de elektronentransportketen in de productie van ATP, dat via een creatine-kinase-shuttle de cardiale myofilamenten voorziet van energiesubstraat, maar ook gezien de belangrijke rol in het produceren van NADPH dat meehelpt te beschermen tegen oxidatieve stress, zijn de cellulaire gevolgen van ijzertekort pleiotroop. IJzertekort in diermodellen toont inderdaad toegenomen sympathische activiteit,32 linkerventrikelhypertrofie33-35 en uiteindelijk linkerventrikeldilatatie,36 remodellering van de extracellulaire matrix,37 mitochondriale disfunctie38 en hogere concentraties van ANP en BNP.39 Deze constellatie van nadelige bevindingen geassocieerd met ijzertekort vormt de basis voor interventionele studies die het effect van ijzertherapie bij hartfalen evalueren.
6 Therapieën voor het corrigeren van ijzertekort
De therapeutische opties die de arts voorhanden heeft in het corrigeren van het ijzertekort bestaan uit enterale toediening van ijzer en parenterale toediening van ijzer. Het gebruik van enteraal ijzer als behandelingsoptie bij hartfalen is gelimiteerd vanwege de beperkte biobeschikbaarheid van enteraal ijzer, ongemakken van de patiënt door een metalen smaak en gastro-intestinale last.10 Klassiek wordt een dosis van 200 mg Fe2+ voorgeschreven bij patiënten met ferriprieve anemie. Ten gevolge van saturatie bij deze dosis van de basolaterale receptoren ter hoogte van de duodenale enterocyt zijn hogere dosissen niet doeltreffend.10 Vanuit pathofysiologisch standpunt is enteraal ijzer geen voorkeursbehandeling bij hartfalenpatiënten met ijzertekort. Dit omdat er bij een groot deel van de patiënten functionele anemie is, waarbij er door up-regulatie van hepcidine een beperkte vrijzetting is van intracellulaire ijzerreserves (zie 2. Fysiologie van het ijzermetabolisme).7 Gezien de up-regulatie van hepcidine zal de enterale opname van ijzer ook gestoord zijn bij de hartfalenpatiënt (figuur 1). Tot op heden zijn er geen methodologisch onderbouwde gerandomiseerde studies beschikbaar die het effect van enteraal vs. parenteraal ijzer bij hartfalenpatiënten testen.
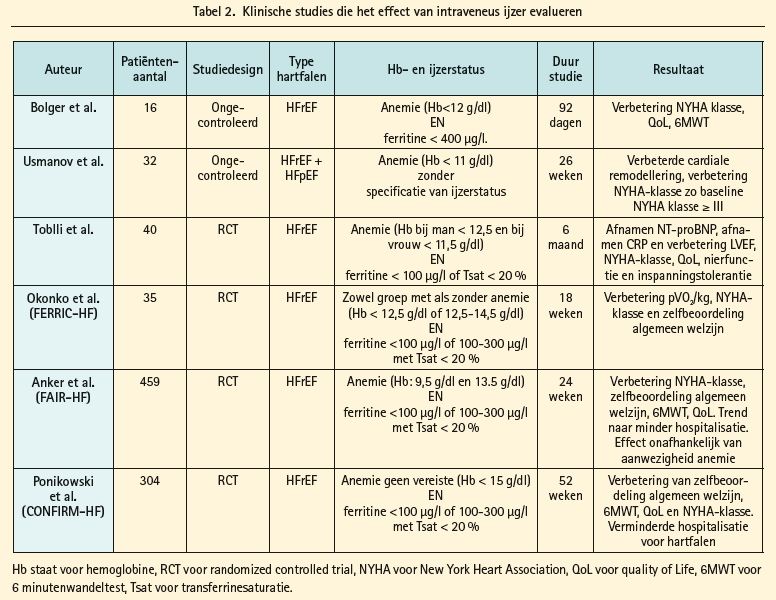
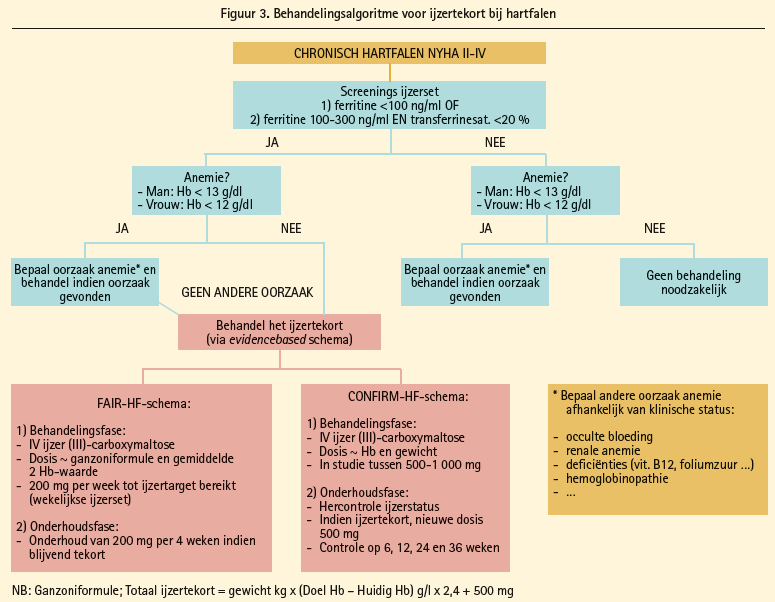
Het theoretische voordeel van intraveneus ijzer is dat het zelfs doeltreffend is in een toestand van functioneel ijzertekort geïnduceerd door hoge hepcidineconcentraties. In totaal hebben 6 verschillende studies (zowel openlabelstudies als dubbelblind gerandomiseerde studies) het effect van intraveneus ijzer bestudeerd bij hartfalenpatiënten.40-45 Tabel 2 geeft een schematisch overzicht van de studiekenmerken. Het merendeel van deze studies bestudeerde patiënten met hartfalen met verminderde ejectiefractie (klassiek < 45 %) en kenmerken van ijzertekort (ferritine < 100 μg/L of ferritine < 300 μg/L en transferrinesaturatie van < 20 %) met al dan niet aanwezigheid van anemie. Van de verschillende studies hebben de FAIR-HF-studie en de CONFIRM-HF-studie het meest rigoureuze en methodologisch onderbouwde studieprotocol.44, 45 Deze beide studies tonen aan dat het gebruik van ijzer (III)-carboxymaltose bij hartfalenpatiënten met verminderde ejectiefractie en aanwezigheid van ijzertekort (ongeacht aanwezigheid anemie), doeltreffend is wat betreft het verbeteren van de surrogaateindpunten kwaliteit van leven, zelfbeoordeling algemeen welzijn, NYHA-klassen en markers van inspanningscapaciteit zoals de 6 minutenwandeltest. Zowel de CONFIRM-HF-studie als meta-analysen van de verschillende studies duiden op een verminderde hospitalisatie voor hartfalen.45, 46 Geen enkele studie tot op heden beschikte over voldoende statistische power om effecten op overleving te beoordelen. Omdat deze studies predominant zijn uitgevoerd in een hartfalenpopulatie met verminderde ejectiefractie, kan er geen besluit gevormd worden over het nut van intraveneus ijzer bij hartfalenpatiënten met bewaarde ejectiefractie. Momenteel is een internationale dubbelblind gerandomiseerde studie lopende die het effect van intraveneus ijzer (III)-carboxymaltose test bij hartfalenpatiënten met bewaarde ejectiefractie (FAIR-HFpEF-studie). Door de gunstige effecten van intraveneus ijzer (III)-carboxymaltose suggereren de Europese richtlijnen voor de behandeling van hartfalen van 2012 het gebruik van intraveneus ijzer bij hartfalenpatiënten met verminderde ejectiefractie.15 Op dit ogenblik is intraveneus ijzer (III)-carboxymaltose terugbetaald in België voor de behandeling van ijzertekort als er geen ijzersupplementen via orale weg toegediend kunnen worden, of als deze behandeling onvoldoende efficiënt is. Men verstaat natuurlijk uit deze uiteenzetting, dat de rationale voor peroraal ijzer beperkt is en strookt met de pathofysiologische inzichten van ijzertekort bij hartfalen. Vanzelfsprekend moet in geval van ferriprieve anemie de oorzaak van de anemie altijd opgespoord worden. Ingeval van ijzertekort wordt aangeraden om 500-1 000 mg iv ijzer (III)-carboxymaltose (injectafer) te geven, met controle een 6-12-tal weken later. De meeste patiënten hebben voldoende ijzerreserve voor een jaar na een behandeling van 1 000-1 500 mg. Figuur 3, ten slotte, geeft een voorstel van een behandelingsalgoritme voor ijzertekort bij patiënten met hartfalen en verminderde ejectiefractie.
Referenties
- DeMaeyer, E., Adiels-Tegman, M. The prevalence of anaemia in the world. World Health Stat Q, 1985, 38, 302-316.
- Stoltzfus, R. Defining iron-deficiency anemia in public health terms: a time for reflection. J Nutr, 2001, 131, 565S-567S.
- Andrews, N.C. Disorders of iron metabolism. N Engl J Med, 1999, 341 (26), 1986-1995.
- Andrews, N.C. Iron homeostasis: insights from genetics and animal models. Nat Rev Genet, 2000, 1, 208-217.
- Jankowska, E.A., Rozentryt, P., Witkowska, A. et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J, 2010, 31 (15), 1872-1880.
- Klip, I.T., Comin-Colet, J., Voors, A.A. et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J, 2013, 165, 575-582.
- Jankowska, E.A., von Haehling, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34, 816-829.
- Besarab, A., Horl, W.H., Silverberg, D. Iron metabolism, iron deficiency, thrombocytosis, and the cardiorenal anemia syndrome. Oncologist, 2009, 14, Suppl 1, 22-33.
- Fleming, R.E., Ponka, P. Iron overload in human disease. N Engl J Med, 2012, 366 (4), 348-359.
- Lopez, A., Cacoub, P., Macdougall, I.C., Peyrin-Biroulet, L. Iron deficiency anaemia. Lancet, 2015 [E-pub ahead of print].
- Hurrell, R., Egli, I. Iron bioavailability and dietary reference values. Am J Clin Nutr, 2010, 91, 1461S-1467S.
- McDermid, J.M., Lonnerdal, B. Iron. Adv Nutr, 2012, 3, 532-533.
- Munzel, T., Gori, T., Keaney, J.F., Jr., Maack, C., Daiber, A. Pathophysiological role of oxidative stress in systolic and diastolic heart failure and its therapeutic implications. Eur Heart J, 2015, 36, 2555-2564.
- Weiss, G., Goodnough, L.T. Anemia of chronic disease. N Engl J Med, 2005, 352, 1011-1023.
- McMurray, J.J., Adamopoulos, S., Anker, S.D. et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail, 2012, 14, 803-869.
- Wish, JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol, 2006, 1, Suppl 1, S4-S8.
- von Haehling, S., Jankowska, E.A., van Veldhuisen, D.J., Ponikowski, P., Anker, S.D. Iron deficiency and cardiovascular disease. Nat Rev Cardiol, 2015, 12, 659-669.
- Pasricha, S.R., Flecknoe-Brown, S.C., Allen, K.J. et al. Diagnosis and management of iron deficiency anaemia: a clinical update. Med J Aust, 2010, 193, 525-532.
- Goodnough, L.T., Nemeth, E., Ganz, T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood, 2010, 116, 4754-4761.
- Koulaouzidis, A., Said, E., Cottier, R., Saeed, A.A. Soluble transferrin receptors and iron deficiency, a step beyond ferritin. A systematic review. J Gastrointestin Liver Dis, 2009, 18, 345-352.
- Okonko, D.O., Grzeslo, A., Witkowski, T. et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol, 2008, 51, 103-112.
- Anker, S.D., Comin, C.J., Filippatos, G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Felker, G.M., Shaw, L.K., Stough, W.G., O'Connor, C.M. Anemia in patients with heart failure and preserved systolic function. Am Heart J, 2006, 151, 457-462.
- Komajda, M., Anker, S.D., Charlesworth, A. et al. The impact of new onset anaemia on morbidity and mortality in chronic heart failure: results from COMET. Eur Heart J, 2006, 27, 1440-1446.
- O'Meara, E., Clayton, T., McEntegart, M.B. et al. Clinical correlates and consequences of anemia in a broad spectrum of patients with heart failure: results of the Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity (CHARM) Program. Circulation, 2006, 113, 986-994.
- von, H.S., van Veldhuisen, D.J., Roughton, M. et al. Anaemia among patients with heart failure and preserved or reduced ejection fraction: results from the SENIORS study. Eur J Heart Fail, 2011, 13, 656-663.
- Anker, S.D., Voors, A., Okonko, D. et al. Prevalence, incidence, and prognostic value of anaemia in patients after an acute myocardial infarction: data from the OPTIMAAL trial. Eur Heart J, 2009, 30, 1331-1339.
- Ezekowitz, J.A., McAlister, F.A., Armstrong, P.W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new-onset heart failure. Circulation, 2003, 107, 223-225.
- Parikh, A., Natarajan, S., Lipsitz, S.R., Katz, S.D. Iron deficiency in community-dwelling US adults with self-reported heart failure in the National Health and Nutrition Examination Survey III: prevalence and associations with anemia and inflammation. Circ Heart Fail, 2011, 4, 599-606.
- Jankowska, E.A., Rozentryt, P., Witkowska, A. et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail, 2011, 17, 899-906.
- Varma, A., Appleton, D.L., Nusca, A. et al. Iron deficiency anemia and cardiac mortality in patients with left ventricular systolic dysfunction undergoing coronary stenting. Minerva Cardioangiol, 2010, 58, 1-10.
- Turner, L.R., Premo, D.A., Gibbs, B.J. et al. Adaptations to iron deficiency: cardiac functional responsiveness to norepinephrine, arterial remodeling, and the effect of beta-blockade on cardiac hypertrophy. BMC Physiol, 2002, 2, 1.
- Olivetti, G., Lagrasta, C., Quaini, F. et al. Capillary growth in anemia-induced ventricular wall remodeling in the rat heart. Circ Res, 1989, 65, 1182-1192.
- Olivetti, G., Quaini, F., Lagrasta, C. et al. Myocyte cellular hypertrophy and hyperplasia contribute to ventricular wall remodeling in anemia-induced cardiac hypertrophy in rats. Am J Pathol, 1992, 141, 227-239.
- Rossi, M.A., Carillo, S.V. Electron microscopic study on the cardiac hypertrophy induced by iron deficiency anaemia in the rat. Br J Exp Pathol, 1983, 64, 373-387.
- Medeiros, D.M., Beard, J.L. Dietary iron deficiency results in cardiac eccentric hypertrophy in rats. Proc Soc Exp Biol Med, 1998, 218, 370-375.
- Chvapil, M., Hurych, J., Ehrlichova, E. The effect of iron deficiency on the synthesis of collagenous and noncollagenous proteins in wound granulation tissue and in the heart of rats. Exp Med Surg, 1968, 26, 52-60.
- Dong, F., Zhang, X., Culver, B., Chew, H.G., Jr., Kelley, R.O., Ren, J. Dietary iron deficiency induces ventricular dilation, mitochondrial ultrastructural aberrations and cytochrome c release: involvement of nitric oxide synthase and protein tyrosine nitration. Clin Sci (Lond), 2005, 109, 277-286.
- Naito, Y., Tsujino, T., Matsumoto, M., Sakoda, T., Ohyanagi, M., Masuyama, T. Adaptive response of the heart to long-term anemia induced by iron deficiency. Am J Physiol Heart Circ Physiol, 2009, 296, H585-H593.
- Toblli, J.E., Lombrana, A., Duarte, P., Di, G.F. Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol, 2007, 50, 1657-1665.
- Bolger, A.P., Bartlett, F.R., Penston, H.S. et al. Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol, 2006, 48, 1225-1227.
- Usmanov, R.I., Zueva, E.B., Silverberg, D.S., Shaked, M. Intravenous iron without erythropoietin for the treatment of iron deficiency anemia in patients with moderate to severe congestive heart failure and chronic kidney insufficiency. J Nephrol, 2008, 21, 236-242.
- Okonko, D.O., Grzeslo, A., Witkowski, T. et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol, 2008, 51, 103-112.
- Anker, S.D., Comin, C.J., Filippatos, G. et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med, 2009, 361, 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiencydagger. Eur Heart J, 2015, 36, 657-668.
- Qian, C., Wei, B., Ding, J., Wu, H., Wang, Y. The Efficacy and Safety of Iron Supplementation in Patients With Heart Failure and Iron Deficiency: A Systematic Review and Meta-analysis. Can J Cardiol, 2015, [E-pub ahead of print].
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.