Introduction
À l'échelle mondiale, on estime que 12,6 millions de femmes et 20,9 millions d'hommes souffrent de fibrillation auriculaire (FA). Chez les adultes de plus de 20 ans, la prévalence est estimée à 3 %, avec des chiffres plus élevés dans la population âgée et chez les patients souffrant d'hypertension artérielle, de maladies coronariennes, de valvulopathies, d'insuffisance cardiaque, d'obésité, de diabète et d'insuffisance rénale chronique. La FA entraîne une augmentation de la mortalité (x 2 chez les femmes et x 1,5 chez les hommes) et une morbidité accrue, comme l'insuffisance cardiaque et les AVC. Ceci génère des coûts énormes au niveau des soins de santé (1 % du budget total au RU et 6-26 billions de dollars aux États-Unis en 2008). Un traitement anticoagulant oral par warfarine ou NOAC entraîne une réduction considérable des AVC et de la mortalité, tandis que le contrôle du rythme et de la fréquence réduit les symptômes et peut contribuer à la préservation de la fonction ventriculaire gauche, tout en n'ayant pas d'effet prouvé sur la morbidité à long terme et la survie. L'incidence annuelle moyenne d'AVC chez les patients souffrant de FA atteint 1 % et la mortalité annuelle 3 %, seule une minorité des décès étant attribuables aux AVC, tandis que la mort subite et l'insuffisance cardiaque sont plus souvent en cause.
Bien qu'une prédisposition génétique puisse certainement jouer un rôle sur le plan de l'apparition d'une FA, les tests génétiques n'ont encore aucune place. Des cardiopathies structurelles, l'hypertension artérielle, le diabète (peutêtre) et la FA elle-même peuvent être à l'origine du remodelage structurel des oreillettes, à la base de phénomènes de réentrée et de l'apparition de la FA. Couplé à la stase sanguine, le remodelage structurel crée un milieu prothrombogène dans l'oreillette, et plus spécifiquement souvent dans l'auricule gauche.
Diagnostic
Le diagnostic de FA nécessite un ecg montrant impérativement des intervalles RR irréguliers et l'absence d'ondes P. L'épisode doit durer au moins 30 secondes. L'ecg, les enregistrements Holter et les Holter prolongés peuvent et doivent parfois être utilisés pour poser le diagnostic. La recherche systématique d'une FA dans la population plus âgée (ecg et prise du pouls) et les groupes à haut risque se révèle rentable. Chez les patients porteurs de pacemakers ou de défibrillateurs, on détecte régulièrement des AHRE (accelerated high rate events) (10-15 % des patients PM) et ceci est associé à une incidence plus élevée de FA et d'AVC,mais l'incidence d'AVCest plus faible que celle enregistrée en cas de FA, et tous les AHRE ne sont pas synonymes de FA. La décision de donner des anticoagulants à ces patients doit dépendre du risque d'AVC du patient et du fait qu'une FA est - ou non - documentée sur l'ecg/le Holter. Chez les patients qui ont présenté un AVC, la recherche d'une FA au moyen d'un ecg et d'un monitoring de Holter est indiquée. On distingue cinq types de FA: le premier épisode diagnostiqué, la FA paroxystique (le plus souvent spontanément résolutive au bout de < 48 heures à 7 jours), la FA persistante (> 7 jours,même si le RS est rétabli après une cardioversion après 7 jours), la FA persistante prolongée (> 1 an lorsqu'on opte pour une stratégie de contrôle du rythme) et la FA permanente (FA acceptée).
Symptômes
Les patients souffrant de FA ont une qualité de vie considérablement moins bonne que les volontaires en bonne santé, et souffrent de fatigue, palpitations, dyspnée, oppression, troubles du sommeil et stress psychosocial. Le score EHRA détermine la sévérité des symptômes (de légère à sévère) selon les classes I, IIa, IIb, III et IV. On décrit une amélioration de la qualité de vie, tant avec un traitement médical qu'avec un traitement interventionnel, mais il existe peu de données au sujet de la comparaison des différentes stratégies thérapeutiques.
Facteurs de risque et maladies cardiovasculaires concomitantes
Une prédisposition génétique, l'âge, l'insuffisance cardiaque, l'hypertension artérielle, le diabète, les maladies valvulaires, les maladies coronariennes, une dysfonction thyroïdienne, l'obésité, les BPCO, les apnées du sommeil, l'insuffisance rénale chronique, le tabagisme, la consommation d'alcool et les efforts intenses réguliers sont autant de situations qui sont indépendamment associées à la FA. Étant donné cette association, il est logique de prêter une attention suffisante au traitement - si possible correct - de tous ces facteurs.
Traitement
1 Un traitement correct de la FA nécessite une stratégie intégrée
Un traitement correct de la FA nécessite une stratégie intégrée dans le cadre de laquelle le patient, une équipe médicale pluridisciplinaire, la technologie nécessaire et toutes les options thérapeutiques doivent être disponibles pour pouvoir déterminer le traitement correct pour chaque patient individuel.
2 Volet diagnostique
La première étape est constituée par une anamnèse incluant les antécédents et la détermination de toutes les affections concomitantes, la détermination du type de FA, du risque d'AVC et des symptômes liés à la FA, ainsi que des complications liées à l'arythmie telles que thrombo-embolie et insuffisance cardiaque. La deuxième étape est l'ecg, qui permet de poser le diagnostic, de déterminer la réponse ventriculaire, de détecter des troubles de la conduction, une ischémie ou des signes de cardiopathie structurelle. Une analyse de sang avec détermination de la fonction thyroïdienne et de la fonction rénale, dosage des électrolytes et détermination de la formule sanguine hématologique ainsi qu'une ETT (échocardiographie transthoracique) évaluant le statut valvulaire, une éventuelle cardiopathie structurelle sous-jacente et la détermination des dimensions et de la fonction du ventricule gauche ainsi que du volume de l'oreillette gauche et de la fonction cardiaque droite complètent la mise au point standard pour poser le diagnostic de FA. Un Holter visant à évaluer le contrôle de la réponse ventriculaire ou à détecter des épisodes de FA résiduels sous traitement - ou après traitement - et une échocardiographie transoesophagienne pour une meilleure évaluation du statut valvulaire sous-jacent et pour exclure un thrombus auriculaire gauche avant une cardioversion urgente ou avant une ablation sont des examens complémentaires recommandés dans des cas de FA spécifiques.
3 Prévention des AVC chez les patients souffrant de FA
Les anticoagulants oraux permettent d'éviter la plupart des AVC ischémiques et d'allonger la survie. Le traitement par ACO se révèle supérieur au traitement par aspirine ou à l'absence de traitement pour la prévention des AVC. Le bénéfice clinique net concerne pratiquement tous les patients souffrant de FA, excepté ceux courant un très faible risque d'AVC; par conséquent, pratiquement tous les patients doivent être mis sous ACO. La seule exception (hormis, bien entendu, les patients présentant une contre-indication absolue aux ACO dans le cadre d'un risque hémorragique élevé) est dès lors constituée par les patients ayant un score CHA2DS2-VASc égal à 0 (et les femmes n'ayant pas d'autres facteurs de risque - score CHA2DS2-VASc = 1). Ces patients ne doivent pas recevoir d'ACO ni d'aspirine pour la prévention des thrombo-embolies dans le cadre d'une FA. Tous les hommes ayant un score CHA2DS2-VASc ≥ 2 et les femmes ayant un score CHA2DS2- VASc ≥ 3, ne courant pas de risque hémorragique élevé, doivent recevoir des ACO. Si les patients sont porteurs d'une prothèse mécanique ou s'il s'agit de patients souffrant d'une sténose valvulaire mitrale modérément sévère (FA valvulaire), il faut administrer un antagoniste de la vitamine K. Chez les autres patients, on donnera la préférence à un NOAC. Chez les hommes ayant un score CHA2DS2-VASc égal à 1 et les femmes ayant un score CHA2DS2- VASc égal à 2, les ACO ont le plus souvent un effet positif sur l'évolution de la maladie, mais il faut évaluer chaque cas individuellement, en tenant compte de l'effet de réduction du risque thrombo-emboligène, du risque hémorragique et des préférences du patient. Dans ce groupe de patients, l'âge > 65 ans joue un rôle plus décisif en faveur de l'anticoagulation. Il est également important d'évaluer le risque hémorragique (HAS-BLED) chez chaque patient souffrant de FA. Sur ce plan, un risque hémorragique élevé ne signifie pas nécessairement qu'il faut s'abstenir de donner des anticoagulants, mais bien qu'il faut - si possible - traiter activement ce risque hémorragique élevé. Étant donné le profil de sécurité supérieur des NOAC par rapport aux AVK, on donne la préférence aux NOAC lors de l'instauration d'un nouveau traitement, ainsi que chez les patients qui ont besoin d'ACO et qui prennent des AVK, si ces patients préfèrent les NOAC et si l'intervalle thérapeutique sous AVK est insuffisant.
Chez les patients présentant une véritable contre-indication aux anticoagulants, on peut envisager une occlusion de l'auricule gauche (LAA). De plus amples études sont encore nécessaires pour déterminer quels patients sont les meilleurs candidats pour ce dispositif: les patients présentant une contre-indication aux ACO, ou ceux qui ont présenté un AVC sous ACO. La fermeture chirurgicale peut également être envisagée si le patient souffrant de FA doit subir une autre intervention, mais les ACO doivent être poursuivis après la fermeture chirurgicale, étant donné la fréquence élevée de flux résiduel dans l'auricule gauche.
Les guidelines reprennent des organigrammes en cas de survenue d'un AVC sous ACO (figure 1) et en cas de survenue de saignements sous ACO (figure 2) et, dans le cadre de la combinaison d'un traitement antiagrégant plaquettaire et d'ACO, on insiste pour que la trithérapie soit réduite à un minimum et pour qu'on passe le plus rapidement possible à la combinaison d'ACO et de clopidogrel (sans aspirine).
Une monothérapie antiagrégante plaquettaire n'a aucune indication sur le plan de la prévention des AVC en cas de FA.

4 Contrôle de la fréquence
Le but du contrôle de la fréquence est d'amener la FC au repos en deçà de 110/min, sans induire de bradycardie. Souvent, le contrôle de la fréquence suffit pour soulager les symptômes de la FA. À cet égard, on peut utiliser des bêtabloquants, des antagonistes calciques (diltiazem et vérapamil) et de la digoxine, parfois combinés. L'amiodarone, la dronédarone et le sotalol peuvent également être utilisés, mais uniquement s'ils le sont également pour le contrôle du rythme. Pour le contrôle aigu de la fréquence, on donnera la préférence aux bêtabloquants et au diltiazem/ vérapamil. Chez les patients souffrant d'HFrEF, on donnera la préférence à la digitale et aux bêtabloquants. Chez les patients instables, très atteints, présentant une forte diminution de la FEVG, on peut utiliser l'amiodarone. En cas d'instabilité hémodynamique, il faut penser à une cardioversion électrique urgente. Pour le contrôle de la fréquence à long terme, on pense en premier lieu aux bêtabloquants. Il est toutefois important de noter que l'effet pronostique bénéfique des bêtabloquants disparaît chez les patients souffrant d'HFrEF. Les antagonistes calciques non-dihydropyridines peuvent être utilisés pour le contrôle de la fréquence à long terme, mais pas chez les patients souffrant d'HFrEF. La digitale peut également être utilisée de manière chronique pour le contrôle de la fréquence, et il est possible que les doses plus faibles, < 250 mcg/j, soient associées à un meilleur pronostic. Sur ce plan, l'amiodarone ne peut être envisagée qu'en dernier recours, étant donné les effets indésirables possibles à plus long terme. Le choix entre un bêtabloquant, un antagoniste calcique ou la digitale dépendra des caractéristiques du patient individuel. On peut proposer une ablation du noeud AV, mais uniquement chez les patients chez qui le contrôle du rythme et un contrôle correct de la fréquence, par tous les médicaments possibles, se sont avérés inefficaces, et lorsqu'on escompte que le patient deviendra dépendant d'un pacemaker.
5 Contrôle du rythme
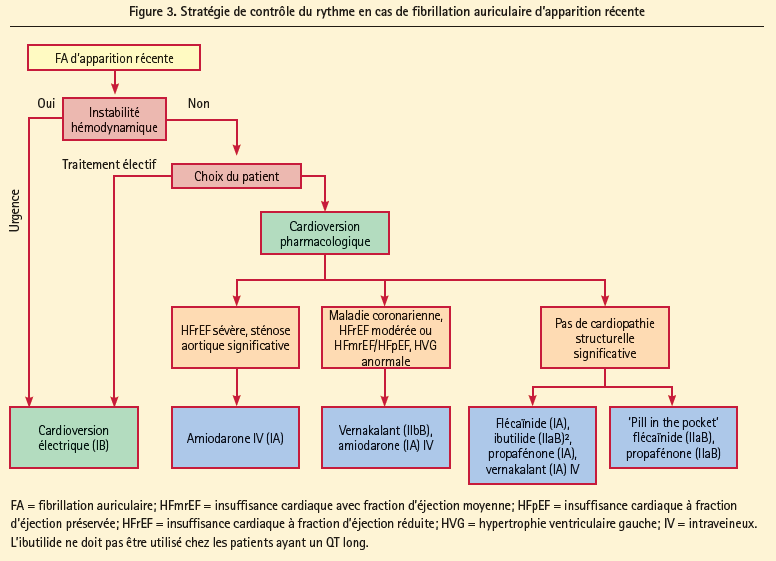
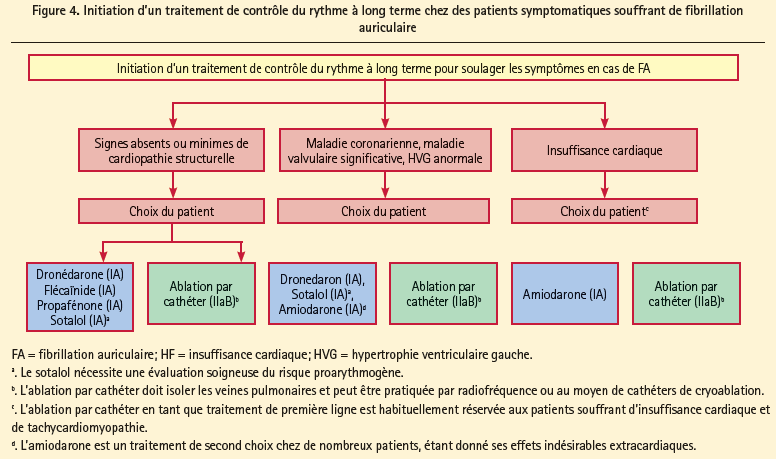
Les antiarythmiques doublent le maintien du rythme sinusal par rapport au placebo. Une stratégie médicamenteuse de contrôle du rythme n'a jamais pu démontrer une meilleure survie que le contrôle de la fréquence couplé à des ACO. Des études actuellement en cours devront établir si les procédures d'ablation peuvent prouver une meilleure survie. Jusqu'à présent, le contrôle du rythme est indiqué pour l'amélioration des symptômes chez les patients qui restent symptomatiques malgré un traitement médicamenteux correct, visant à ralentir le rythme. Les recommandations pour l'utilisation d'une cardioversion médicamenteuse (figure 3 pour une FA d'apparition récente et figure 4 pour le contrôle du rythme à long terme, l'ablation étant également une alternative possible) et d'une cardioversion électrique sont décrites dans les guidelines. Ici, la sécurité doit être à l'avant-plan (effet pro-arythmogène des antiarythmiques versus risque d'effets indésirables d'une ablation). On ne peut administrer d'antiarythmiques aux patients ayant un QT long (> 500 ms) ou aux patients souffrant de troubles de la conduction sino-auriculaire ou de troubles de la conduction AV, porteurs d'un pacemaker.
6 Ablation par cathéter
L'ablation est efficace pour le rétablissement et le maintien du rythme sinusal chez les patients souffrant de FA symptomatique, qu'elle soit paroxystique, persistante ou - probablement aussi - persistante prolongée. La plupart du temps, l'ablation est envisagée en deuxième ligne, en cas d'échec des antiarythmiques. Dans cette indication, l'ablation se révèle supérieure au traitement médical. Utilisée en traitement de première ligne pour une FA paroxystique, l'ablation n'entraîne qu'une amélioration modérée du contrôle du rythme, par rapport aux antiarythmiques. Dans les centres expérimentés, les complications n'étaient pas plus fréquentes qu'avec les antiarythmiques; l'ablation peut donc constituer un premier choix pour certains patients qui préfèrent ce type de traitement. Dans les autres groupes de FA, l'ablation est également plus efficace en termes de maintien du rythme sinusal, mais elle n'a pas pu démontrer que la survie cardiovasculaire était supérieure, pas plus qu'elle n'avait d'effet prouvé sur le raccourcissement de la durée de l'hospitalisation.
7 Chirurgie de la fibrillation auriculaire
On peut proposer une procédure de contrôle du rythme lors d'une chirurgie à coeur ouvert aux patients chez qui le contrôle du rythme est souhaitable en vue d'une amélioration de leur symptomatologie, après l'accord de l'équipe cardiaque, et après avoir informé le patient (la mortalité et la morbidité majeure ne sont pas influencées par la chirurgie concomitante du rythme, mais la chirurgie du rythme augmente le nombre d'implantations de pacemakers). La chirurgie du rythme durant un CABG ou une intervention valvulaire semble essentiellement efficace pour le maintien du rythme sinusal chez les patients souffrant de FA paroxystique. La chirurgie isolée du rythme pourrait s'avérer un peu plus efficace que l'ablation par cathéter pour le maintien du rythme sinusal, mais au prix de complications plus nombreuses.
8 La FA dans des situations particulières
8a Le patient âgé et fragile
La stratégie de traitement des patients âgés devrait à tout le moins être équivalente à celle utilisée dans la population plus jeune et, pourtant, les patients âgés sont souvent soustraités. Le fait de tendre à une diminution du risque cardiovasculaire est aussi efficace. Le risque thromboemboligène de la FA est plus élevé que dans la population plus jeune. Le contrôle de la fréquence et du rythme, incluant les pacemakers et l'ablation par cathéter, est aussi efficace (bien qu'il y ait moins de preuves dans ce groupe d'âge).
8b Cardiomyopathies héréditaires, affections des canaux ioniques, faisceaux de conduction accessoires
Les patients souffrant d'un WPW et ayant une conduction rapide au niveau de leur faisceau accessoire doivent subir une ablation de ce faisceau (risque de réponse ventriculaire rapide et de fibrillation ventriculaire), et ceci est également nécessaire - et urgent! - chez les patients souffrant d'un WPW, ayant survécu à une mort subite. Chez les patients souffrant d'unWPW, qui présentent une nette préexcitation et une FA, il faut également envisager l'ablation, après une discussion approfondie avec le patient. Pour le ralentissement de la réponse ventriculaire, on peut utiliser le procaïnamide, la propafénone et l'ajmaline, tandis que la digoxine, le vérapamil et le diltiazem sont contre-indiqués, et que la prudence est de rigueur avec l'amiodarone. Chez les patients souffrant d'une cardiomyopathie hypertrophique, un diagnostic de FA constitue une indication d'anticoagulation absolue, étant donné le risque thromboemboligène élevé. Pour le contrôle du rythme et de la fréquence, on peut utiliser des bêtabloquants, du diltiazem et du vérapamil, tandis que la digoxine peut être utilisée, avec ou sans bêtabloquants, chez les patients ne présentant pas d'obstruction de la LVOT. L'amiodarone semble être un antiarythmique sûr dans cette population, et le disopyramide pourrait s'avérer bénéfique chez les patients présentant une obstruction de la LVOT. L'ablation est un traitement efficace de la FA dans cette population. Bon nombre de cardiomyopathies héréditaires et d'affections des canaux ioniques sont associées à la FA. Dès lors, la découverte d'une FA chez des patients jeunes doit faire penser à ces affections. Il faut envisager un testing génétique chez les patients souffrant de FA, présentant une suspicion de cardiomyopathies héréditaires ou d'affections des canaux ioniques.
8c Sport et FA
Alors que l'activité physique réduit le risque de FA, les sports intensifs, et surtout les sports d'endurance, induisent un risque accru de FA plus tard dans la vie, ce qui débouche sur une relation en forme de U entre le sport et la FA. Le traitement de la FA chez les sportifs est identique à celui utilisé dans la population générale, mais certains points méritent une attention particulière. Les sports de contact ou les sports impliquant un risque élevé de traumatismes sont contre-indiqués chez les patients sous ACO. Les bêtabloquants sont mal tolérés. La digoxine, le vérapamil et le diltiazem ne sont souvent pas assez puissants pour assurer un contrôle suffisant de la fréquence en cas de FA liée à l'effort. Selon toute vraisemblance, l'ablation par cathéter est aussi efficace chez les athlètes que dans la population générale. On peut envisager une stratégie 'pill-in-thepocket' avec de la flécaïnide ou de la propafénone, mais l'activité sportive ne pourra être reprise qu'après l'arrêt de la FA et au bout d'un délai correspondant à 2 fois la demi-vie du médicament.
8d Grossesse
La FA est rare dans cette population, et sa présence traduit le plus souvent une cardiopathie sous-jacente. Une grossesse compliquée d'une FA doit être considérée comme une grossesse à haut risque, tant pour la mère que pour le foetus. Pour le contrôle de la fréquence, on peut utiliser des bêtabloquants, du vérapamil et du diltiazem (les bénéfices sont supérieurs aux risques, excepté pour l'aténolol) mais, étant donné la possibilité d'un retard de croissance avec les bêtabloquants, il faut surveiller la croissance à partir de 20 semaines de grossesse. Le diltiazem ne constitue qu'un second choix en cas d'allaitement (après les bêtabloquants, le vérapamil et la digoxine). Pour le contrôle du rythme, l'ablation n'est citée qu'à titre anecdotique, et l'amiodarone est nocive pour le foetus. On peut utiliser la flécaïnide et le sotalol pour le traitement des arythmies foetales, et ces produits peuvent donc être utilisés pour le traitement d'une FA symptomatique chez la mère. La cardioversion électrique est sûre en cas de FA avec instabilité hémodynamique, mais elle doit être effectuée sous monitoring foetal, avec possibilité de réalisation d'une césarienne en urgence. Lors du premier trimestre, les ACO doivent être évités, et les HBPM constituent une alternative sûre. Au troisième trimestre, de fréquents contrôles de l'INR sont nécessaires, car il faut parfois administrer des doses élevées d'ACO et d'héparine pour obtenir une anticoagulation correcte. En présence de FA et de prothèses valvulaires mécaniques, si les patientes souhaitent - en concertation avec l'équipe médicale - interrompre les ACO, l'administration continue d'héparine fractionnée IV est nécessaire, ou encore l'administration de doses adaptées d'HBPM SC. Les NOAC doivent être évités, par manque de données concernant l'utilisation pendant la grossesse.
8e FA postopératoire
L'administration périopératoire de bêtabloquants est recommandée afin de prévenir une FA postopératoire. En cas d'instabilité hémodynamique, on recourt à une cardioversion électrique ou médicamenteuse, cette dernière pouvant être réalisée au moyen d'amiodarone et de vernakalant. En revanche, une FA asymptomatique doit tout d'abord être traitée au moyen d'un contrôle de la fréquence et d'anticoagulants. Il faut administrer des ACO à long terme, en tenant compte du risque d'AVC et du risque hémorragique.
8f GUCH
Les CIA seront de préférence corrigées avant la quatrième décennie, afin d'éviter une FA paroxystique. Il faut envisager une intervention de Cox-Maze lors de toutes les interventions chirurgicales correctrices chez les patients GUCH souffrant de FA symptomatique. Les ACO sont d'application pour tous les patients GUCH ayant subi une réparation intracardiaque, ou présentant une cyanose, une intervention de Fontan ou un ventricule droit systémique et ayant un antécédent de FA, de flutter auriculaire ou de tachycardie par réentrée intra-atriale. Chez tous les autres patients GUCH, il faut administrer des ACO si le score CHA2DS2-VASc est ≥ 1. On peut envisager une ablation par cathéter pour des troubles du rythme auriculaires, dans des centres expérimentés.
8g Flutter auriculaire
La prise en charge est identique à celle de la FA, et ce, tant en ce qui concerne le traitement antiarythmique que la stratégie d'anticoagulation. L'ablation peut être proposée en traitement de première ligne ou en cas d'échec des médicaments, en tenant compte des préférences du patient.
Conclusion
Enfin, les recommandations pointent encore toute une série d'imprécisions au niveau des connaissances relatives à la FA, tant sur le plan de la physiopathologie et du diagnostic que du traitement.
Références
- 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Benussi S et al. European Heart Journal doi:10.1093/eurheartj/ehw210.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.