Inleiding
Het aantal vrouwen en mannen met voorkamerfibrillatie (VKF) wereldwijd wordt geschat op respectievelijk 12,6 en 20,9 miljoen. Bij volwassenen > 20 jaar wordt de prevalentie geschat op 3 % met hogere cijfers in de bejaarde populatie en bij patiënten met arteriële hypertensie, coronaire ziekte, kleplijden, hartfalen, obesitas, diabetes mellitus en chronische nierinsufficiëntie. VKF leidt tot een verhoging van de mortaliteit (2 x bij vrouwen en 1,5 x bij mannen) en verhoogde morbiditeit zoals hartfalen en beroerte. Dit leidt tot een enorme kost in de gezondheidszorg (1 % van het totale budget in het VK en 6-26 biljoen dollar in de USA in 2008). OAC met warfarine of met NOAC leidt tot een aanzienlijke reductie in beroerte en mortaliteit terwijl ritme- en ratecontrole de symptomen onderdrukken en kunnen helpen in het bewaren van de linkerkamerfunctie maar geen bewezen effect hebben op de langetermijnmorbiditeit en overleving. De gemiddelde jaarlijkse incidentie van beroerte bij patiënten met VKF bedraagt 1 % en de jaarlijkse mortaliteit 3 %, waarbij slechts een minderheid van de overlijdens te wijten is aan beroerte, terwijl plotse dood en hartfalen meer frequent de oorzaak zijn.
Alhoewel genetische voorbeschikking zeker een rol kan spelen in het ontstaan van VKF bestaat er actueel nog geen plaats voor genetische testing. Structurele hartziekten, arteriële hypertensie, mogelijk diabetes en ook VKF zelf kunnen leiden tot het structurele remodelleren van de voorkamers die de aanleiding kan zijn tot re-entryfenomenen en het ontstaan van VKF. Het structurele remodelleren samen met stase van bloed creëert dan weer het protrombogene milieu in de voorkamer en meer specifiek vaak in het linker hartoortje.
Diagnose
De diagnose van VKF vereist een ecg met een absoluut onregelmatig RR-interval en de afwezigheid van P-toppen. De episode moet minstens 30 seconden aanhouden. Het ecg, de holteropnames en de langdurige holteropnames kunnen en moeten soms gebruikt worden om de diagnose te stellen. Het systematisch screenen van VKF in de oudere populatie (ecg en polsdetectie) en in de hoogrisicogroepen is kostenefficiënt. Bij patiënten met pacemakers of defibrillatoren wordt regelmatig AHRE (accelerated high rate events) gedetecteerd (10-15 % PM-patiënten) en dit is geassocieerd met een hogere incidentie van VKF en beroerte, maar de incidentie van beroerte is lager dan die bij VKF en niet elke AHRE is VKF. De beslissing om deze patiënten te anticoaguleren moet afhangen van het beroerterisico van de patiënt en het feit of op ecg/holtermonitoring bewezen VKF gedocumenteerd wordt of niet. Bij patiënten die een beroerte hebben gehad wordt screenen naar VKF met ecg en holtermonitoring aangeraden. Vijf types van VKF worden onderscheiden: de eerste gediagnosticeerde episode, de paroxismale (zelf eindigend meestal < 48 uren tot 7 dagen), de persisterende (> 7 dagen ook als SR wordt herwonnen na cardioversie na 7 dagen), de lang aanhoudende persisterende (> 1 jaar wanneer voor ritmecontrolestrategie wordt gekozen) en de permanente (aanvaarde VKF) episode.
Symptomen
Patiënten met VKF hebben een beduidend slechtere levenskwaliteit dan gezonde vrijwilligers met vermoeidheid, palpitaties, dyspneu, benauwdheid, slaapstoornissen en psychosociale stress. De EHRA-score bepaalt de ernst van de symptomen (van licht naar ernstig) in klasse I, IIa, IIb, III en IV. Een verbetering van de levenskwaliteit is beschreven zowel met medische als met interventionele behandeling, maar weinig gegevens bestaan omtrent de vergelijking van de verschillende therapeutische strategieën.
Risicofactoren en concomitante cardiovasculaire aandoeningen
Genetische voorbeschiktheid, leeftijd, hartfalen, arteriële hypertensie, diabetes, kleplijden, coronarialijden, schildklierdisfunctie, obesitas, COPD, slaapapneu, chronische nierinsufficiëntie, roken, alcoholconsumptie en regelmatig intense inspanningen zijn alle condities die onafhankelijk geassocieerd zijn aan VKF. Gezien deze associatie is het logisch voldoende aandacht te besteden aan de correcte behandeling, zo mogelijk, van al deze factoren.
Behandeling
Een correcte behandeling van VKF vereist een geïntegreerd beleid waarbij de patiënt, een multidisciplinair medisch team, de nodige technologie en alle behandelingsopties beschikbaar moeten zijn om voor elke individuele patiënt de juiste behandeling uit te stippelen.
Diagnostisch luik: Anamnese met voorgeschiedenis en bepaling van alle concomitante aandoeningen, bepaling van het type VKF, van het beroerterisico en van aan VKF gerelateerde symptomen, alsook van de aritmie gerelateerde complicaties zoals trombo-embolie en hartfalen zijn de eerste stap. Het ecg voor het stellen van de diagnose, de bepaling van de ventrikelrespons, het opsporen van geleidingsstoornissen, ischemie of tekens van structureel hartlijden is stap twee. Een bloedafname met bepaling van schildklier- en nierfunctie, elektrolytenstatus en bepaling van het hematologisch bloedbeeld alsook een TTE (transthoracale echocardiografie) voor klepstatus, onderliggend structureel hartlijden en bepaling van linkerkamerafmetingen en -functie alsook linkervoorkamervolume en rechterhartfunctie vervolledigen een standaardnazicht bij de diagnose van VKF. Holtermonitoring ter evaluatie van de controle van de ventrikelrespons of ter detectie van residuele VKFepisodes onder of na behandeling en transoesofageale echocardiografie voor betere evaluatie van de onderliggende klepstatus en ter uitsluiting van linkervoorkamertrombus pre-urgente cardioversie of pre-ablatie zijn bijkomende aanbevolen onderzoeken in specifieke situaties van VKF.
Beroertepreventie bij patiënten met VKF: orale anticoagulantia kunnen de meeste ischemische beroertes vermijden en verlengen het leven. De behandeling met OAC is superieur aan de behandeling met aspirine of geen behandeling voor de preventie van beroerte. Het netto klinisch voordeel geldt voor bijna alle VKF-patiënten behalve voor deze met een zeer laag beroerterisico en bijgevolg moeten bijna alle patiënten onder OAC gezet worden. De enige uitzondering (behalve uiteraard de patiënten met een absolute contraindicatie voor OAC in het kader van hoog bloedingsrisico) is dan ook de patiënt met een CHA2DS2-Vasc-score van 0 (en vrouwen met geen andere risicofactoren- CHA2DS2-Vasc-score = 1). Deze patiënten mogen geen OAC, noch aspirine krijgen voor de preventie van trombo-embolie in het kader van VKF. Alle mannen met een CHA2DS2-VASc-score ≥ 2 en vrouwen met een CHA2DS2-Vasc-score ≥ 3 en zonder hoog bloedingsrisico moeten onder OAC komen. Hebben de patiënten een mechanische prothese of gaat het om een patiënt met een matig ernstige mitralisklepstenose (valvulaire VKF) dan moet een vitamine K-antagonist gegeven worden. Voor andere patiënten wordt de voorkeur gegeven aan een NOAC. Voor mannen met een CHA2DS2-Vasc-score = 1 en vrouwen met een CHA2DS2-Vasc-score = 2 hebben OAC meestal een positief effect op de outcome van de patiënt maar moet een gebalanceerde evaluatie individueel gebeuren rekening houdende met het trombo-emboligene risicoreductie-effect, het bloedingsrisico en de voorkeur van de patiënt. Een leeftijd > 65 jaar heeft in deze groep van patiënten wel een meer doorslaggevende rol in het voordeel van de anticoagulatie. Het is belangrijk bij elk van de VKF-patiënten ook het bloedingsrisico in te schatten (HAS-BLED) waarbij een hoog bloedingsrisico meestal niet de noodzaak tot het onthouden van anticoagulatie betekent, maar wel de actieve behandeling van het bloedingsrisico waar mogelijk inhoudt. Gezien het superieure veiligheidsprofiel van NOAC t.o.v. VKA wordt de voorkeur gegeven aan NOAC bij het instellen van een nieuwe behandeling alsook bij die patiënten die OAC nodig hebben en onder VKA staan als de voorkeur van de patiënt naar NOAC uitgaat en als de tijd binnen de therapeutische range onder VKA onvoldoende is.
Bij deze patiënten met een echte contra-indicatie voor anticoagulatie kan een LAA-occlusie overwogen worden. Bijkomende studies zijn nog nodig om uit te maken welke patiënten de meest geschikte zijn voor dit device: patiënten met een contra-indicatie voor OAC of patiënten die een beroerte gekregen hebben onder OAC. Chirurgische sluiting kan ook overwogen worden als de patiënt met VKF een andere ingreep moet ondergaan maar OAC moet verdergezet worden na chirurgische sluiting, gezien de hoge frequentie van residuele flow in het LAA.
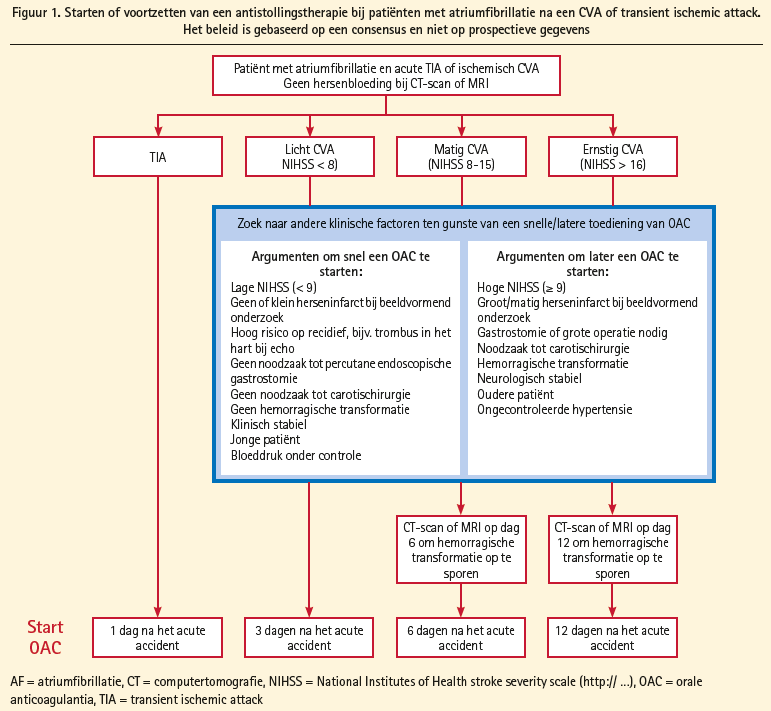
Flowcharts worden in de guidelines voorgesteld als er een beroerte optreedt onder OAC (figuur 1) en als er bloedingen optreden onder OAC (figuur 2) en bij de combinatie antiaggregatietherapie met OAC wordt de nadruk gelegd om tripeltherapie tot een minimum te herleiden en zo snel als kan over te stappen op de combinatie OAC en clopidogrel (zonder aspirine).

Antiplaatjesmonotherapie heeft geen enkele indicatie in beroertepreventie van VKF.
Ratecontrole: Het doel van ratecontrole is de rust-HF onder de 110/min te krijgen zonder het induceren van bradycardie. Vaak is ratecontrole voldoende om de symptomen van VKF te verhelpen. Bètablokkers, calciumantagonisten diltiazem en verapamil, en digoxine kunnen hiervoor gebruikt worden, soms in combinatie. Amiodaron, dronedaron en sotalol kunnen eveneens gebruikt worden maar alleen als ze ook gebruikt worden voor ritmecontrole. Voor acuteratecontrole zal de voorkeur uitgaan naar bètablokkers en diltiazem/verapamil. Bij patiënten met HFrEF zal de voorkeur uitgaan naar digitalis en bètablokkers. Bij erg zieke instabiele patiënten met sterk verminderde LVEF kan amiodaron gebruikt worden. Bij hemodynamische instabiliteit moet aan urgente elektrische cardioversie gedacht worden. Voor langetermijnsratecontrole wordt eerst gedacht aan bètablokkers. Belangrijk is wel op te merken dat bij patiënten met HFrEF het prognostisch gunstig effect van bètablokkers verloren gaat. Non-dihydropyridine-calciumantagonisten kunnen gebruikt worden voor langetermijnratecontrole maar niet bij patiënten met HFrEF. Ook in de chronische behandeling kan digitalis gebruikt worden voor ratecontrole en mogelijk zijn de lagere dosissen < 250 mcg/d geassocieerd aan een betere prognose. Amiodaron kan voor dit doel alleen als laatste oplossing dienen gezien de mogelijke bijwerkingen op langere termijn. De keuze tussen bètablokker, calciumantagonist of digitalis zal gemaakt worden in functie van de individuele patiëntkarakteristieken. AV-knoopablatie kan voorgesteld worden, maar alleen voor die patiënten bij wie ritmecontrole en correcte ratecontrole met alle mogelijke medicijnen zonder succes gebleken zijn en waarbij aanvaard wordt dat de patiënt pacemakerafhankelijk gemaakt wordt.
Ritmecontrole: Antiaritmische medicijnen leiden tot een verdubbeling van het behoud van het sinusritme t.o.v. placebo. Medicamenteuze ritmecontrolestrategie heeft nooit een betere overleving kunnen aantonen dan ratecontrole met OAC. Of ablatieprocedures dit wel zullen kunnen bewijzen zal moeten blijken uit studies die momenteel aan de gang zijn. Tot op heden is ritmecontrole aangewezen voor symptomatische verbetering van die patiënten die symptomatisch blijven onder correcte vertragende medicamenteuze therapie. Aanbevelingen voor het gebruik van medicamenteuze cardioversie (figuur 3 voor recent ontstane VKF en figuur 4 voor langetermijnritmecontrole met ook ablatie als mogelijk alternatief) en elektrische cardioversie staan beschreven in de richtlijnen. Veiligheid moet hier op de eerste plaats komen (proaritmogeen effect van antiaritmische medicatie versus risico bijwerkingen van ablatie). Antiaritmica mogen niet gegeven worden aan patiënten met verlengd QT (> 500 msec) of aan patiënten met sinoatriale geleidingsstoornissen of AVgeleidingsstoornissen die pacemaker dragen.
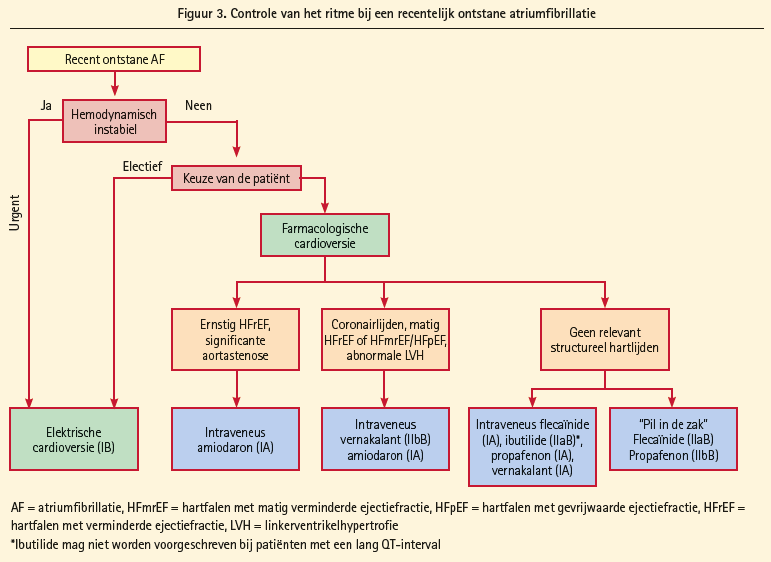
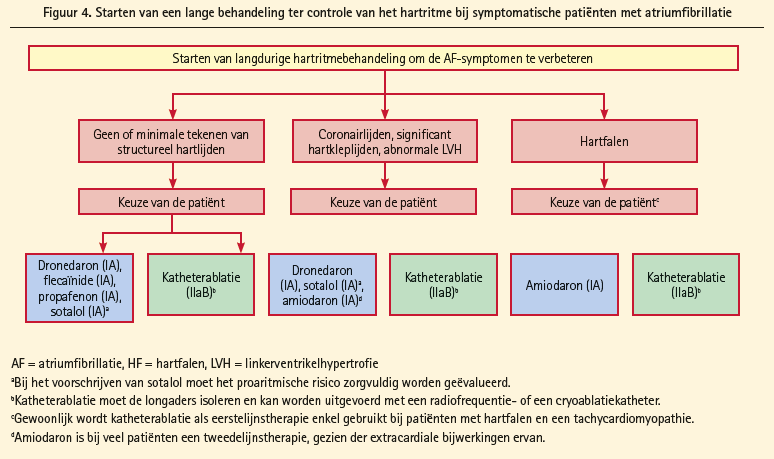
Katheterablatie: Ablatie is efficiënt voor het herstellen en het behouden van het sinusritme in patiënten met symptomatische VKF, zowel voor paroxismale, als persisterende als waarschijnlijk ook voor lang aanhoudende, persisterende VKF, meestal in tweede lijn gegeven, nadat antiaritmische medicatie gefaald heeft. In deze indicatie is ablatie superieur aan medische therapie. Als eerstelijnstherapie voor paroxismale VKF heeft ablatie slechts een matig betere ritmecontrole bewezen vergeleken met antiaritmische medicatie. Complicaties waren niet frequenter dan met antiaritmische medicatie in expertcentra, wat de keuze als eerstelijnstherapie mogelijk maakt bij sommige patiënten die de voorkeur geven aan dit type behandeling. Ook in de andere groepen van VKF leidt ablatie tot een betere efficiëntie voor wat betreft behoud van het sinusritme, maar ablatie kon geen superieure cardiovasculaire overleving aantonen, noch bewezen effect op de reductie van de hospitalisatieduur.
Atrialefibrillatiechirurgie: Ritmecontroleprocedure tijdens openhartchirurgie kan aangeboden worden aan deze patiënten bij wie ritmecontrole van de VKF wenselijk is voor verbetering van de symptomatologie na goedkeuring van het hartteam en na het informeren van de patiënt (mortaliteit en majeure morbiditeit worden niet beïnvloed door gelijktijdige ritmechirurgie, maar ritmechirurgie leidt wel tot meer pacemakerimplantaties). Ritmechirurgie tijdens CABG of klepinterventie lijkt voornamelijk efficiënt voor het behoud van sinusritme in patiënten met paroxismale VKF. Geïsoleerde ritmechirurgie zou wat efficiënter kunnen zijn dan katheterablatie voor het behoud van sinusritme, maar ten koste van meer complicaties.
VKF in bijzondere situaties:
De oudere en fragiele patiënt
van de jongere populatie en toch worden oudere patiënten vaak onderbehandeld. Het nastreven van een reductie van het cardiovasculair risico is even efficiënt. Het tromboemboligene risico van VKF is hoger dan in de jongere populatie. Rateen ritmecontrole met inbegrip van pacemakers en katheterablatie is even efficiënt (wel minder evidentie in deze leeftijdsgroep).
Erfelijke cardiomyopathieën, aandoeningen van de ionenkanalen, bijkomende geleidingsbanen
Patiënten met een WPW en een snelle geleiding over hun bijkomende geleidingsbaan moeten hiervan een ablatie ondergaan (risico op snel ventriculair antwoord en ventrikelfibrillatie) en dit is ook noodzakelijk en dringend bij deze WPW-patiënten die een plotse dood hebben overleefd. Ook bij de WPW-patiënten met duidelijke pre-excitatie en VKF moet ablatie overwogen worden na uitgebreid overleg met de patiënt. Voor het vertragen van de ventrikelrespons van VKF kunnen procaïnamide, propafenon en ajmaline gebruikt worden terwijl digoxine, verapamil en diltiazem gecontra-indiceerd zijn en voorzichtigheid aan de dag gelegd moet worden met amiodaron. Bij patiënten met hypertrofe cardiomyopathie leidt diagnose van VKF tot een absolute indicatie voor antistolling gezien het hoge tromboemboligene risico. Voor ritme- en ratecontrole kunnen bètablokkers, diltiazem en verapamil gebruikt worden en digoxine al of niet met bètablokkers bij patiënten zonder LVOT-obstructie. Amiodaron lijkt een veilig antiaritmicum in deze populatie en disopyramide zou voordelig kunnen zijn bij deze patiënten met LVOT-obstructie. Ablatie is een efficiënte behandeling van VKF in deze populatie. Heel wat erfelijke cardiomyopathieën en ionenkanaalaandoeningen zijn geassocieerd met VKF. Wanneer bij jonge patiënten VKF wordt teruggevonden moet dan ook aan deze aandoeningen gedacht worden. Genetische testing moet overwogen worden in patiënten met VKF en vermoeden van erfelijke cardiomyopathieën of ionenkanaalaandoeningen.
Sport en VKF
Terwijl fysieke activiteit de kans op VKF vermindert, leidt intensief sporten met vooral uithoudingssporten tot een hogere kans op VKF later in het leven, wat leidt tot de U-vormige relatie tussen sport en VKF. De behandeling van VKF bij sportmensen is zoals die bij de gewone populatie, maar vergt enkele speciale aandachtspunten. Contactsporten of sporten met hoge kans op trauma zijn tegenaangewezen bij patiënten onder OAC. Bètablokkers worden slecht verdragen. Digoxine, verapamil en diltiazem zijn vaak niet krachtig genoeg om voldoende ratecontrole te verzekeren bij inspanningsgebonden VKF. Vermoedelijk is katheterablatie in atleten even efficiënt als bij de gewone populatie. Pill-in-the-pocket-strategie met flecaïnide of propafenon kan gebruikt worden maar sportactiviteit kan pas hernomen worden na het stoppen van de VKF en na tweemaal de halfwaardetijd van de medicatie.
Zwangerschap
VKF is zeldzaam in deze populatie en aanwezigheid wijst meestal op een onderliggende hartaandoening. Zwangerschap met VKF moet beschouwd worden als hoogrisicozwangerschap voor moeder en foetus. Voor ratecontrole kunnen bètablokkers, verapamil en diltiazem gebruikt worden (voordeel groter dan nadeel behalve voor atenolol) maar aangezien groeiachterstand mogelijk is met bètablokkers moeten groeiscans voorzien worden vanaf 20 weken zwangerschap. Diltiazem is slechts tweede keuze bij borstvoeding (na bètablokkers, verapamil en digoxine). Voor ritmecontrole werd ablatie slechts als anekdote vermeld en amiodaron is schadelijk voor de foetus. Flecaïnide en sotalol kunnen gebruikt worden voor de behandeling van foetale aritmieën en kunnen dus gebruikt worden voor de behandeling van symptomatische VKF bij de moeder. Electrische cardioversie is veilig voor VKF met hemodynamische instabiliteit maar moet gebeuren onder foetale monitoring en mogelijke back-up met urgente sectio. In het eerste trimester moeten OAC vermeden worden en zijn LMWH een veilig alternatief. In het derde trimester is frequente INR-monitoring vereist omdat soms hoge dosissen OAC en heparine vereist zijn voor een correcte antistolling. In de aanwezigheid van VKF en mechanische klepprothesen en waarbij patiënten wensen, in samenspraak met het specialistenteam, de OAC te onderbreken is een continue toediening niet gefractioneerde IV heparine vereist of dosisaangepaste SC LMWH. NOAC moeten vermeden worden aangezien er geen data bestaan tijdens de zwangerschap.
Postop VKF
Perioperatieve toediening van bètablokkers wordt aangeraden ter preventie van postoperatieve VKF. Bij hemodynamische instabiliteit moet elektrische of medicamenteuze cardioversie verricht worden. Voor medicamenteuze cardioversie kunnen amiodaron en vernakalant gebruikt worden. Asymptomatische VKF moet daarentegen eerst benaderd worden met ratecontrole en anticoagulatie. OAC op lange termijn moet toegediend worden rekening houdend met beroerte- en bloedingsrisico.
GUCH
ASD-defecten worden best gecorrigeerd voor de vierde levensdecade om paroxismale VKF te vermijden. Cox-mazeprocedure moet overwogen worden bij alle correctieve chirurgische ingrepen bij GUCHpatiënten met symptomatische VKF. OAC geldt voor alle volwassen GUCH-patiënten met intracardiale repair, cyanose, fontaningreep of systemische rechterventrikel en een geschiedenis van VKF, atriale flutter of intra-atriale re-entrytachycardie. Voor alle andere GUCH-patiënten moet OAC gegeven worden bij een CHA2DS2-VASc sssuubbre ≥ 1. Katheterablatie voor atriale ritmestoornissen kan overwogen worden in centra met ervaring.
Atriale flutter
De benadering is dezelfde als voor VKF en dit geldt zowel voor de antiaritmische behandeling als voor de anticoagulatiestrategie. Ablatie kan voorgesteld worden als eerstelijnstherapie of wanneer medicatie gefaald heeft, rekening houdend met de voorkeur van de patiënt.
Tot slot duiden de richtlijnen op nog een heleboel onduidelijkheden die er bestaan in de kennis van VKF, zowel voor wat betreft de fysiopathologie, de diagnose als de behandeling.
Referentie
- 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Benussi S et al. European Heart Journal doi:10.1093/ eurheartj/ehw210.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.