Comme chaque année lors de la réunion annuelle de la Société Européenne de Cardiologie, certains des guidelines européens ont été revus à la lueur de publications plus récentes. C'est un travail toujours impressionnant et même si on peut critiquer certains aspects de ce qui est devenu une mécanique bien huilée, force est d'admettre que cela constitue une ligne de conduite raisonnable pour la majorité de nos patients, certainement au moins du niveau de nos recommandations belges émanant du KCE ou des réunions de 'consensus' (…) et au minimum, une excellente base de discussion pour les experts dans les domaines impliqués. Suivre les guidelines, et cela a été prouvé, permet d'améliorer le pronostic des patients dans leur ensemble, même si on peut toujours imaginer que pour certains points particuliers, un spécialiste en la matière pourrait faire mieux pour un cas bien spécifique. Les auteurs des guidelines ont fait un réel effort pour fournir des figures très didactiques et des arbres décisionnels clairs.
Résumer les guidelines est une tâche impossible car ils constituent déjà un condensé de la littérature et des avis d'experts. Dans cet article, j'essaierai donc d'en tirer les directions générales et d'attirer l'attention sur les nouveautés par rapport à l'ancienne version. Cette année, 4 sujets ont été revus: l'infarctus du myocarde de type STEMI, le traitement antiplaquettaire dans la maladie coronarienne, les maladies valvulaires et les maladies artérielles périphériques. L'accès au niveau du site internet de l'ESC est facile pour obtenir la version complète et le kit des diapositives résumant les guidelines. Il existe également disponible et convivial d'emploi pour la vie de tous les jours une application (ESC Pocket Guidelines) qu'on peut télécharger gratuitement sur son smartphone, permettant de consulter facilement les recommandations et les algorithmes diagnostiques et thérapeutiques ainsi que d'autres outils.
Prise en charge de l'infarctus du myocarde de type STEMI
La dernière version datait de 2012. La nouvelle version reprend pas moins de 159 recommandations, dont 58 % de classe I, mais il faut se rendre compte qu'environ la moitié de ces 159 recommandations est d'un degré d'évidence C, à savoir celui des experts et de petites études rétrospectives, de registres. Moins d'un quart repose sur un degré d'évidence A, le plus élevé. Il reste donc de la place pour réaliser des études randomisées pour confirmer ou rectifier éventuellement le tir!
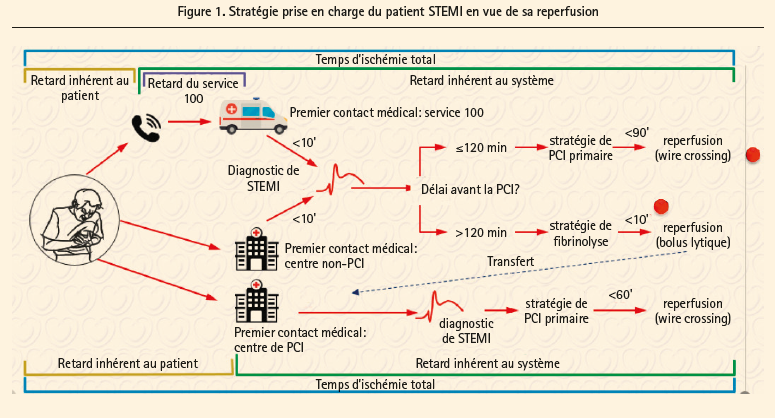
Le point de départ de la démarche a été revu et est maintenant le moment du diagnostic, basé sur l'ECG qui doit être réalisé dans les 10 minutes au plus tard. L'approche invasive (si réalisable en moins de 120 minutes) et radiale si possible (class I contre IIa avant) est clairement privilégiée par rapport à la thrombolyse (figure 1). La thrombolyse doit être suivie d'un transfert vers un centre où existe une possibilité de PCI, réalisée en rescue si nécessaire ou de façon différée entre 2 et 24 heures, si signes de reperfusion (indications de classe IA). Une nouveauté importante consiste à proposer une approche invasive aussi immédiate à des présentations plus 'atypiques' de l'ECG, comme le bloc de branche (gauche ou droit), le rythme pacé, un sous-décalage du segment ST dans les précordiales associé à un sus-décalage de plus de 0,5 mm en V7-V9 (risque de l'infarctus postérieur et de la circonflexe) ainsi qu'un sous-décalage dans au moins 8 dérivations, associé à un sus-décalage en aVR suggérant un tronc commun ou à un équivalent, voir une maladie sévère des 3 vaisseaux. L'oxygène n'est réservé que si réelle hypoxémie (SaO2 < 90 % contre 95 % dans les guidelines précédents) avec une indication IC. Le stent de référence pour le STEMI (comme en fait de façon générale actuellement) est clairement le DES (IA). Une revascularisation complète est maintenant encouragée (classe IIA alors qu'on était en classe III auparavant) avant la sortie de clinique et d'autant plus si le patient présente un choc cardiogénique, où recommande de le faire durant la procédure initiale en plus de la lésion 'culprit'.
Sur le plan pharmacologique, des petites doses d'aspirine (75-100 mg) associées à du ticagrelor ou du prasugel (pour une année, une statine à dose élevée sont toutes des indications de classe I tout comme les inhibiteurs de la pompe à proton (PPI). Le clopidogrel doit être utilisé si le ticagrelor ou le prasugrel ne sont pas disponibles ou contre-indiqués comme par exemple en cas d'utilisation d'un anticoagulant: dans ce cas précis, la durée d'une triple thérapie doit être considérée pour une durée de 1 à 6 mois suivant l'évaluation du risque de récidive coronarienne par rapport au risque de saignement. Les guidelines sont plus nuancés sur l'utilisation des bétabloquants, des inhibiteurs de l'enzyme de conversion (voir de l'angiotensine II) et des inhibiteurs de l'aldostérone qui sont surtout recommandés en fonction de l'altération de la fonction ventriculaire gauche.
Enfin, un nouveau concept est développé, celui d'un 'MINOCA' (Myocardial Infarction with Non-Obstructive Coronary arteries) dont le diagnostic repose sur la présence des critères classiques de survenue d'un infarctus, sur l'absence de sténose significative (≥ 50 %) et sur l'absence de cause spécifique à la présentation aiguë de l'infarctus. Dans le diagnostic différentiel intervient entre autres les myocardites, le syndrome de Tako- Tsubo, l'embolie pulmonaire, des cardiomyopathies hypertrophiques ou dilatées. La prévalence est estimée entre 1 et 13 % de tous les infarctus du myocarde et un examen par résonnance magnétique peut être indiqué quand la cause sous-jacente n'est pas élucidée.
Finalement, un chapitre a été dédié aux indicateurs de qualité dans la prise en charge des STEMI, incluant l'évaluation des structures mises en place (existence d'un network spécifique en particulier), la mesure d'indicateurs de performance pour le traitement de reperfusion (le chrono est mis en route lors du diagnostic!), l'évaluation du risque, le traitement antithrombotique et la médication à la sortie de clinique. On parle aussi d'évaluer certaines données liées au devenir du patient comme la mortalité ou le risque de ré-hospitalisation) à 30 jours. Le problème de mon point de vue porte autant dans la multiplicité des paramètres à relever (toujours facile d'imaginer tout ce qu'on peut 'quantifier') et enregistrer dans une immense banque de données que dans la validation des données colligées et dans leur interprétation. Qui va faire ce travail titanesque … et le payer?
Recommandation sur l'utilisation des antiaggrégants plaquettaires chez les patients coronariens
Le sujet est très controversé ces dernières années et on attendait avec curiosité de savoir dans quelle mesure le groupe de travail réuni pour l'élaboration de ces guidelines allait pouvoir donner une idée claire de la situation 'actuelle', surtout vu le nombre important d'études déjà réalisées … et celles encore à venir. De façon historique, on est parti d'une situation où l'on voulait éviter l'occlusion d'un stent jusqu'à arriver à une problématique de cerner parallèlement le contexte clinique dans laquelle ce stent avait été mis, tout en tenant compte aussi que le patient n'était pas toujours dilaté. L'arbre décisionnel s'est donc porté chez ces patients coronariens à distinguer dans un premier temps le traitement utilisé (PCI, chirurgie ou traitement médical) puis dans un second temps, le contexte stable ou celui d'un syndrome coronarien aigu. L'utilisation de score pour évaluer le risque permet de guider également la décision.
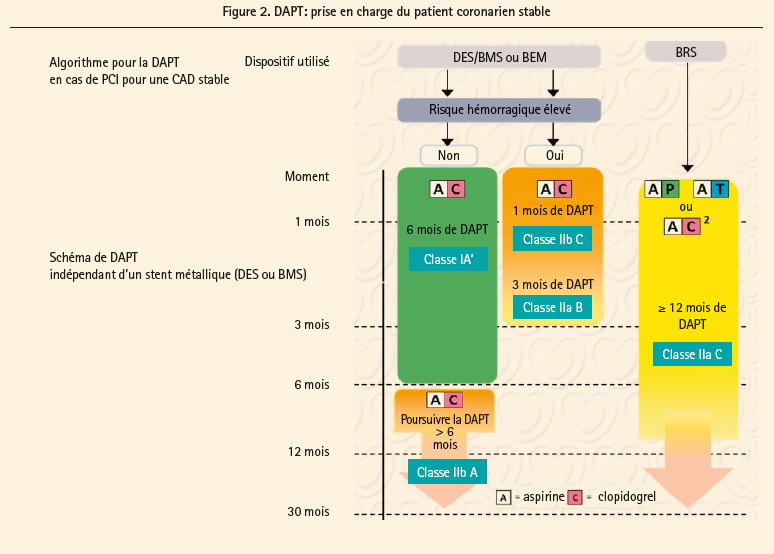
Chez le patient coronarien stable (figure 2), si une angioplastie est réalisée, la drogue de choix à donner en association avec l'aspirine est le clopidogrel, même si la porte reste ouverte pour des cas particuliers (score SYNTAX élevé, thrombose de stent, localisation et nombre de stents implantés …). L'approche radiale est recommandée si l'opérateur est expérimenté dans cette voie (IA) alors que l'évaluation de routine de la fonction plaquettaire est découragée (IIIA). La durée de la double antiaggrégation plaquettaire (DAPT) est de 6 mois (IA), quel que soit le type de stent (DES … ou BMS!). Chez les patients à haut risque de saignement, une durée de 3 mois devrait être considérée (IIa, B), voir même 1 mois si la sécurité est en jeu (IIb, C). Les guidelines indiquent certains facteurs de haut risque dont il faut tenir compte (mais sans préciser les répercussions précises qui restent donc laissées à l'évaluation du médecin), comme une thrombose de stent sous un traitement adéquat, le stenting du dernier vaisseau perméable, la maladie diffuse des 3 vaisseaux surtout chez les diabétiques, l'insuffisance rénale, plus de 3 stents implantés ou plus de 3 lésions traitées, les bifurcations, une longueur de stent supérieure à 60 mm, le traitement d'une occlusion chronique. L'existence d'une maladie artérielle périphérique est aussi un facteur dont il faut tenir compte à ce niveau. Le concept d'une plus longue durée est donc laissé ouvert chez les patients où le risque ischémique dépasse le risque de saignement.
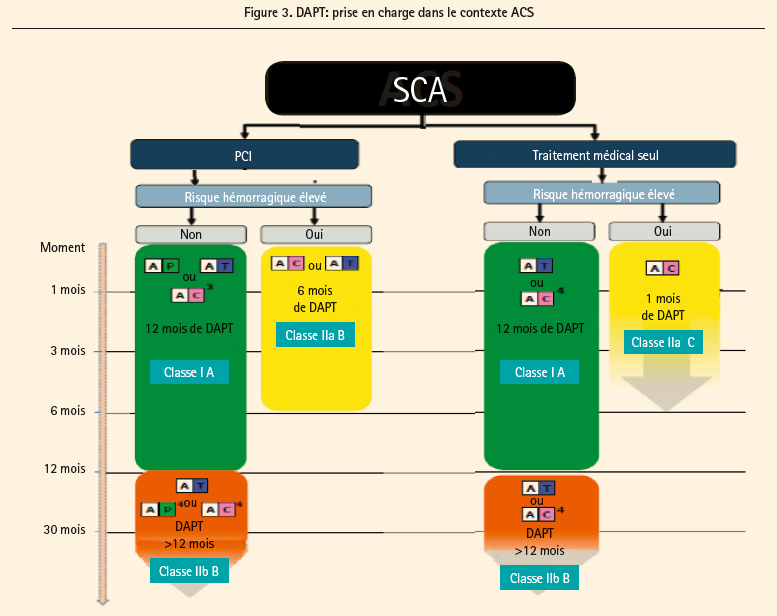
Chez le patient qui a présenté un syndrome coronarien aigu (figure 3), le ticagrelor et le prasugrel sont les drogues de choix par rapport au clopidogrel, à l'exception des patients nécessitant une anticoagulation orale. Un prétraitement est recommandé chez les patients prévus pour PCI dont l'anatomie coronarienne est connue de même que pour les STEMI (IA). Chez les patients qui ont un syndrome coronarien sans élévation du segment ST et qui vont bénéficier d'une approche invasive, un prétraitement par du ticagrelor devait être considéré (IIa, C) alors qu'il n'est pas recommandé avec le prasugrel (IIIB). Après stenting, la durée de DAPT recommandée est de 12 mois (IA), pouvant être réduite à 6 mois chez les patients à haut risque de saignement. Inversément, cette durée peut être prolongée chez les patients qui n'ont pas présenté de saignement, de préférence avec du ticagrelor 2 × 60 mg par rapport au clopidogrel ou au prasugrel. En cas de traitement médical, une durée de DAPT d'un an est aussi recommandée comme étant la base de discussion, en préférant le ticagrelor mais en excluant le prasugrel. Le clopidogrel est préféré chez les patients à haut risque de saignement pour une durée de base d'au moins 1 mois.
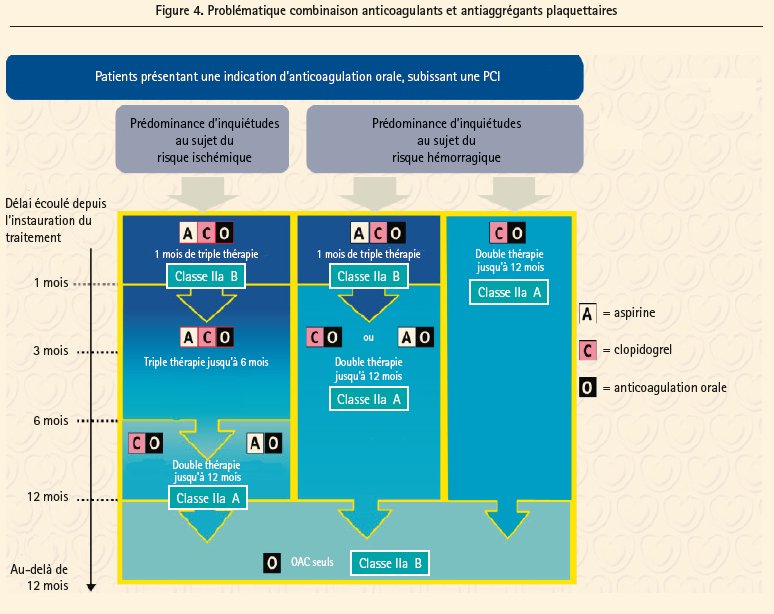
Chez les patients devant prendre une anticoagulation orale (figure 4), le problème est plus compliqué car il s'agit de patients ayant souvent plus de comorbidités et les données ne reposent que sur 3 petites études. Le degré d'évidence dans ce chapitre est d'ailleurs souvent de degré C, celui des experts. La recommandation de base est d'utiliser uniquement le clopidogrel et de considérer une base de triple thérapie pour 1 mois, quel que soit le type de stent employé (mais en pratique, les DES sont devenus la recommandation quasi absolue …). En fonction du contexte clinique (syndrome coronarien aigu) ou de critères anatomiques ou liés à la procédure de la PCI, cette durée peut être étendue à 6 mois chez des patients à faible risque hémorragique. Après cette période de triple thérapie, une bithérapie, clopidogrel ou aspirine et anticoagulant oral, est conseillée jusqu'à un an, période où on ne proposera plus que l'anticoagulant seul. Inversément, si le risque hémorragique est très élevé, on débutera d'emblée une bithérapie, clopidogrel et anticoagulant pour un an, puis seul l'anticoagulant sera poursuivi. Un chapitre a développé la problématique chirurgicale chez ces patients. Concernant la chirurgie cardiaque, il est recommandé de décider en Heart Team suivant le risque ischémique et le risque de saignement. Le concept de base est de continuer l'aspirine (IC), de réaliser la chirurgie chez les patients après un syndrome coronarien aigu en stoppant le ticagrelor au moins 3 jours, le clopidogrel au moins 5 jours et le prasugrel au moins 7 jours (IIa, B). Il est recommandé de reprendre ces derniers médicaments dès que possible ensuite pour une année en principe (IC), durée pouvant être ramenée à 6 mois si risque hémorragique élevé (IIa, C) et même inversément de prolonger la durée jusqu'à 36 mois chez les patients à haut risque ischémique qui ont bien toléré la DAPT, mais le degré d'évidence est plus faible (IIb, C). En ce qui concerne la chirurgie non cardiaque, on recommande la poursuite de l'aspirine si le risque de saignement le permet, d'où l'importance d'une concertation pluridisciplinaire à ce sujet. Chez les patients stentés, on recommande de reporter une chirurgie élective après au moins un mois et cela, sans tenir compte du type de stent, BMS ou DES (IIa, B). La période d'arrêt de la DAPT dépend de la molécule et on retrouve, comme pour la chirurgie cardiaque, le même timing: au moins 3 jours pour le ticagrelor, 5 pour le clopidogrel et 7 pour le prasugrel (indication de type IIa, B également). Chez les patients avec un infarctus récent ou un haut risque ischémique, on peut discuter de reporter une chirurgie élective mais le degré d'évidence est plus faible (IIb, C) prouvant que la place est ouverte à la discussion pluridisciplinaire à ce sujet, contrairement à la période initiale d'un mois après le stenting, où l'arrêt de la DAPT n'est pas recommandé.
Prise en charge des pathologies valvulaires
Très clairement, et peut-être encore plus que pour la pathologie coronarienne, l'accent est mis sur l'approche pluridisciplinaire. Non seulement ici on parle de 'Heart Team' avec une compétence tant sur le plan chirurgical (remplacement et réparation valvulaire) que sur le plan de l'approche percutanée, et cela sans oublier l'imagerie avec toutes les possibilités actuelles, mais on évoque clairement la nécessité d'un 'Heart Valve Center', d'un centre de référence (avec des critères de volume et de qualité tant sur le plan de l'intervention que sur le plan de l'imagerie) avec une équipe spécialisée travaillant en collaboration avec les autres centres hospitaliers ou extrahospitaliers. Par rapport aux anciens guidelines de 2012, l'approche percutanée s'est vue nettement renforcée ce qui a probablement influencé quelques modifications dans les indications. Sur le plan de l'anticoagulation, autre grande modification, les NOACS sont maintenant approuvés chez des patients valvulaires avec une sténose ou une insuffisance aortique, une insuffisance mitrale et également une bioprothèse valvulaire implantée chirurgicalement ou par voie percutanée. Ils ne sont pas recommandés par contre dans la sténose mitrale et en cas de valve mécanique.
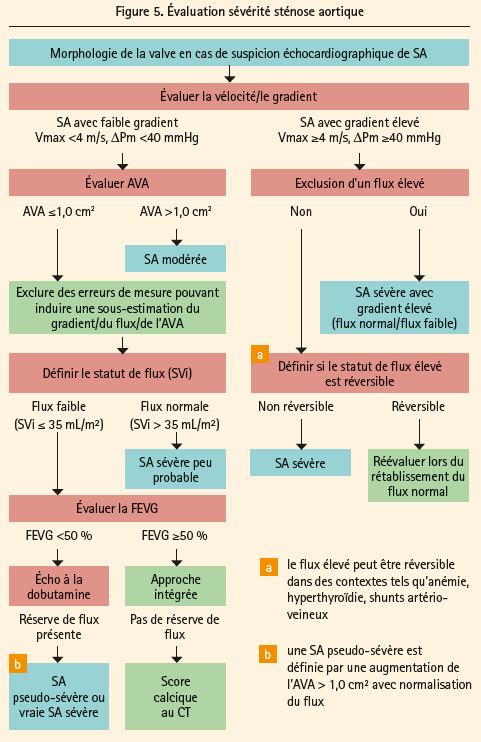
C'est concernant la sténose aortique que la vision a évolué avec l'approche percutanée et les indications pour une intervention. L'évaluation de la sévérité de la sténose aortique a été mieux précisée (figure 5), surtout en ce qui concerne les sténoses à bas gradient, situation nettement plus débattue que la sténose avec un gradient élevé. Si le gradient est bas (Vmax < 4m/s, gradient moyen < 40 mmHg), on propose d'évaluer soigneusement la surface valvulaire. Supérieure à 1 cm², on parle de sténose aortique modérée. Si inférieure, l'étape suivante est d'établir le flux. S'il est normal (SVi > 35 mL/m²), une sténose sévère est peu probable. S'il est diminué, l'évaluation de la fonction ventriculaire gauche est l'étape suivante. Si la FE est ≥ 50 %, une approche intégrée passant par l'évaluation du score calcique prend toute son importance. Si la FE est < 50 %, un test à la dobutamine est recommandé pour départager, s'il existe une réserve de flux, les sténoses pseudo-sévères (surface augmentant > 1 cm²) des sténoses sévères (< 1 cm²). Si pas de réserve, l'algorithme renvoie de nouveau au score calcique. Ce score calcique a donc pris plus d'importance dans ces nouveaux guidelines et doit être interprété selon le sexe et on exige des valeurs plus élevées chez l'homme que chez la femme pour juger de la sévérité de la sténose aortique (2000-3000 chez l'homme, 1200-1600 chez la femme).
Sur le plan interventionnel, la sténose aortique (sévère) symptomatique reste la grande indication, envisagée même en cas de petit gradient-petit débit et une fraction d'éjection diminuée sans réserve contractile, surtout si le score calcique est élevé avec maintenant une indication IIa, C. Il parait évident que les techniques percutanées (TAVI) ont influencé ces guidelines! À noter qu'on fait quand même mention dans toutes ces indications des comorbibités, qui, si elles sont sévères et rendent improbable une amélioration de la qualité de la vie, contre-indiquent une intervention! Chez les patients asymptomatiques, des taux élevés de BNP reçoivent une indication IIa, C tout comme l'existence d'une hypertension pulmonaire sévère (pression systolique de l'artère pulmonaire au repos > 60 mmHg, confirmé par une mesure invasive. Une dysfonction systolique et une mauvaise réponse lors d'un test d'effort ont eux, une indication de degré IC tout comme les patients qui ont une sténose sévère et qui doivent être opérés d'un pontage ou d'une chirurgie de l'aorte ascendante. Le choix entre chirurgie et TAVI doit être discuté, en fonction d'une série de critères anatomiques et techniques de la valve, du contexte cardiaque ainsi que bien évidemment des caractéristiques cliniques du patient au sein d'une 'Heart Team' et réalisé dans un 'Heart Valve Centre', indication de degré IC …
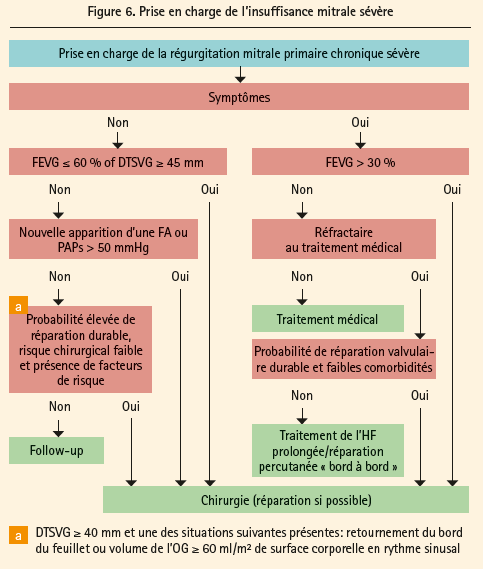
Concernant l'insuffisance aortique, le caractère symptomatique pousse vers la chirurgie. Chez le patient asymptomatique, outre la problématique d'une dilatation de l'aorte ascendante, on retient une dysfonction du VG (FE ≤ 50 % ou LVEDD > 70 mm ou LVESD > 50 mm). Concernant l'insuffisance mitrale sévère (figure 6), la réparation valvulaire reste la technique préférée par rapport au remplacement (IC). Les patients symptomatiques avec un FE > 30 % et les patients asymptomatiques avec une dysfonction du VG (LVESD ≥ 45 mm et/ou FE ≤ 60 %) sont des indications de classe IB alors que le patient asymptomatique avec une fonction VG préservée mais une fibrillation auriculaire secondaire à l'insuffisance mitrale ou la présence d'une hypertension pulmonaire (pression systolique artère pulmonaire > 50 mmHg confirmée de façon invasive) est une indication de classe IIa, B. Plus nuancée (IIa, C) est l'indication chez les patients asymptomatiques avec une FE > 60 % et un LVESD entre 40 et 44 mm: on demande alors non seulement un risque chirurgical bas, une haute probabilité de réparation durable et la présence d'un prolapsus ou d'une dilatation de l'oreillette gauche. Il en va de même chez les patients symptomatiques avec une FE < 30 % et/ou un LVESD > 55 mm (IIa, C). Les patients symptomatiques avec une dysfonction VG sévère (FE < 30 % et/ou LVESD > 55 mm) réfractaires au traitement médical reçoivent une indication de type IIb, surtout si les comorbidités sont basses et qu'on peut réparer la valve. Dans les cas où la chirurgie est jugée impossible ou à très haut risque, l'approche percutanée est maintenant envisageable (IIb, C), surtout avec les techniques de type MitraClip, chez des patients symptomatiques avec une insuffisance mitrale sévère primaire et qui remplissent les critères échographiques d'éligibilité. Concernant l'insuffisance mitrale secondaire sévère, la chirurgie est indiquée essentiellement chez les patients qui ont une indication de revascularisation (et une viabilité prouvée si la fraction d'éjection est < 30 %). Si il n'y a pas de revascularisation, l'indication est plus discutable (IIb, C ) et doit se concerter au sein de la Heart Team, en envisageant également la possibilité d'une procédure percutanée.
Prise en charge des artériopathies périphériques
Un point important soulevé dans ces recommandations repose sur le fait que l'athérosclérose, qui est la cause principale de cette pathologie artérielle, est une pathologie globale et nécessite aussi une approche multidisciplinaire, au sein d'une Vascular Team. La prise en charge des facteurs de risque prend également ici toute son importance qu'elle soit non pharmacologique (arrêt du tabac, perte de poids, régime, exercice) ou médicamenteuse (traitement de l'HTA et du diabète, statines, médication antithrombotique).
Concernant les artères périphériques des membres inférieurs, l'importance de choses simples dans le diagnostic comme la prise de la tension comparée au bras et à la cheville est de nouveau soulignée. Concernant les artères rénales, le traitement médicamenteux garde toute son importance y compris avec les inhibiteurs de l'enzyme de conversion (ou les inhibiteurs de l'angiotensine II) qui sont le traitement recommandé en cas de sténose unilatérale (IB) avec les antagonistes calciques, les bétabloquants et les diurétiques (IC) et qui peuvent être aussi considérés même en cas de sténose bilatérale sévère, si bien tolérés et moyennant un monitoring étroit (IIb, B). La revascularisation de routine n'est pas recommandée en cas de sténose due à l'athérosclérose (III, A) alors qu'elle devrait être considérée en cas de dysplasie fibromusculaire (IIa, B).
Concernant les carotides, chez le patient asymptomatique, la sténose < 60 % ou la carotide occluse (ou presque) constitue une indication de traitement médical. La revascularisation est considérée entre ces deux extrêmes chez des patients ayant une espérance de vie > 5 années et en fonction de la présence d'éléments cliniques ou d'imagerie attestant un risque accru d'accident vasculaire cérébral. Chez le patient symptomatique, on recommande la chirurgie pour des sténoses entre 70 et 99 %, si le risque procédural (AVC/mortalité) est < 6 % (IA). Entre 50 et 69 %, le degré d'évidence est plus faible (IIa, B). Le stenting est une alternative (IIA, B) si le patient est à plus haut risque chirurgical mais si le risque est du niveau du risque chirurgical, soit < 6 %), le degré d'évidence est moindre (IIb, B). En tout cas, chez le patient symptomatique, on recommande une intervention rapide, de préférence dans les 14 jours (IA).
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.