Zoals ieder jaar tijdens de jaarlijkse vergadering van de European Society of Cardiology werd een aantal Europese guidelines tegen het licht van de meest recente publicaties gehouden. Dat is telkens weer een indrukwekkend werk. Ook al kun je kritiek hebben op een aantal aspecten van iets wat een goed geolied mechanisme is geworden, we moeten toegeven dat het een redelijke gedragslijn biedt voor de meeste van onze patiënten, die op z'n minst van hetzelfde niveau is als de Belgische aanbevelingen die van het KCE of van de consensusvergaderingen komen (…) en op z'n minst zijn ze een uitstekende discussiebasis voor de experts in de betrokken gebieden. Het is bewezen dat wie de guidelines volgt de prognose van de patiënten over het algemeen verbetert, hoewel het altijd mogelijk is dat op bepaalde specifieke punten een specialist ter zake het beter kan doen. De auteurs van de guidelines hebben een grote inspanning geleverd om voor erg didactische figuren en duidelijke beslissingsbomen te zorgen.
Het is onmogelijk om de guidelines samen te vatten, omdat ze op zich al een beknopte samenvatting van de literatuur en de adviezen van experts zijn. In dit artikel zal ik daarom proberen om er de algemene richtlijnen uit te halen en zal ik wijzen op wat nieuw is ten opzichte van de oude versie. Dit jaar zijn er 4 onderwerpen herzien: myocardinfarct van het STEMI-type, bloedplaatjesremmers bij coronaire aandoeningen, kleplijden en perifeer arterieel vaatlijden. Via de website van de ESC vind je makkelijk de volledige tekst en de slide-set waarin de guidelines worden samengevat. Er is ook een gebruiksvriendelijke app (ESC Pocket Guidelines) beschikbaar voor dagelijks gebruik, die je gratis kunt downloaden op je smartphone, en waarmee je makkelijk de aanbevelingen, de diagnostische en therapeutische algoritmes en andere tools kunt raadplegen.
Aanpak van myocardinfarct van het STEMI-type
De vorige versie dateerde van 2012. In de nieuwe versie worden niet minder dan 159 aanbevelingen opgenomen, waarvan 58% van klasse I. Houd er wel rekening mee dat ongeveer de helft van deze 159 aanbevelingen een bewijsniveau C heeft, dus van experts, kleine retrospectieve studies en registers. Minder dan een vierde heeft het hoogste bewijsniveau (A). Er is dus ruimte om gerandomiseerde studies uit te voeren die de guidelines bevestigen of bijstellen.
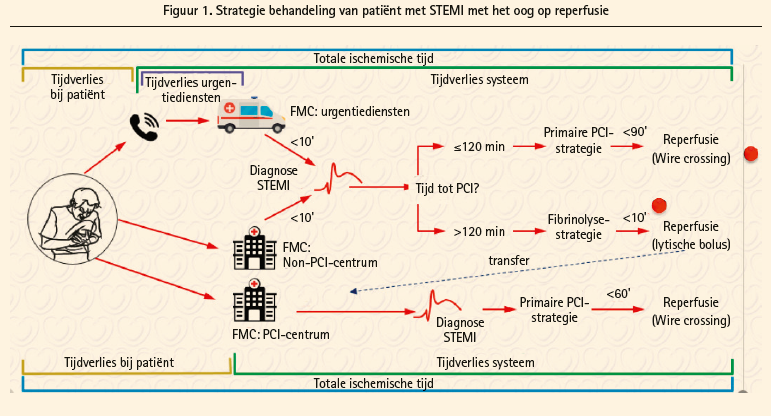
De eerste stap is veranderd, en is nu het moment van de diagnose, gebaseerd op het ecg dat ten laatste na 10 minuten moet worden genomen. De invasieve (indien die in minder dan 120 minuten kan worden gerealiseerd) en indien mogelijk radiale aanpak (klasse I, vroeger IIa), geniet duidelijk de voorkeur boven trombolyse (figuur 1). Een trombolyse moet worden gevolgd door een overbrenging naar een centrum waar een PCI kan worden uitgevoerd, indien het nodig is in rescue of met een uitstel tussen 2 en 24 uur indien er tekenen van reperfusie zijn (indicaties van klasse IA). Een belangrijke nieuwigheid is dat er ook meteen voor een invasieve aanpak wordt gekozen wanneer het ecg atypische kenmerken vertoont, zoals een bundeltakblok (links of rechts), gepaced ritme, een STsegmentdepressie in de precordiale afleidingen die gepaard gaat met een optrekking van meer dan 0,5 mm in V7V9 (risico op posterieur infarct en infarct in de ramus circumflexus) alsook een depressie in minstens 8 afleidingen die gepaard gaat met een stijging in aVR, wat wijst op een infarct in de hoofdstam of iets vergelijkbaars, of zelfs op een ernstig trietakslijden. Er wordt alleen zuurstof gegeven bij een echte hypoxemie (SaO2 < 90 % tegenover 95 % in de vorige guidelines) en tekens van hartinsufficiëntie. De referentiestent voor de STEMI (zoals op dit moment eigenlijk algemeen) is duidelijk de DES (IA). Een volledige revascularisatie wordt op dit moment aanbevolen (klasse IIA en voorheen klasse III) voor het ontslag uit het ziekenhuis, en des te meer wanneer de patiënt een cardiogene shock heeft gehad, waarbij wordt aanbevolen de volledige revascularisatie uit te voeren tijdens de initiële procedure, naast die van het oorzakelijke letsel.
Op farmacologisch vlak zijn kleine doses aspirine (75100 mg) in combinatie met ticagrelor of prasugrel (voor een jaar) en een statine in hoge dosis allemaal indicaties van klasse I, net zoals de protonpompremmers (PPI's). Clopidogrel moet worden gebruikt wanneer ticagrelor of prasugrel niet beschikbaar of gecontraindiceerd is, zoals bij gebruik van een anticoagulans: in dit precieze geval moet worden overwogen gedurende 1 tot 6 maanden een drievoudige therapie te geven na inschatting van het risico op coronair recidief ten opzichte van het risico op bloedingen. De guidelines zijn genuanceerder over het gebruik van bètablokkers, ACEremmers (of angiotensine IIremmers) en aldosteronremmers die vooral worden aanbevolen bij een gestoorde linkerventrikelfunctie.
Ten slotte is er een nieuw concept: 'MINOCA' (Myocardial Infarction with NonObstructive Coronary arteries) waarvan de diagnose berust op de aanwezigheid van de klassieke criteria van een infarct, maar zonder significante stenose (≥ 50 %) en zonder specifieke oorzaak voor het acute infarct. Bij de differentiaaldiagnose moeten we o.a. denken aan myocarditis, takotsubocardiomyopathie, longembolie, hypertrofische of gedilateerde cardiomyopathie. De prevalentie wordt geschat op 1 tot 13 % van alle myocardinfarcten en een MRIscan kan geïndiceerd zijn wanneer de onderliggende oorzaak niet duidelijk is.
Ten slotte is er een hoofdstuk gewijd aan de kwaliteitsindicatoren bij de behandeling van STEMI, met inbegrip van de evaluatie van de opgezette structuren (in het bijzonder het bestaan van een specifiek netwerk), de meting van prestatieindicatoren voor de behandeling van reperfusie (de klok wordt bij de diagnose opgestart!), de inschatting van het risico, de antitrombotische behandeling en de medicatie bij ontslag uit het ziekenhuis. Er wordt ook over gesproken bepaalde gegevens over de toekomst van de patiënt te evalueren (zoals de mortaliteit of het risico om opnieuw opgenomen te worden) na 30 dagen. Voor mij ligt het probleem zowel in de grote hoeveelheid parameters die gemeten moeten worden (het is altijd makkelijk om je alles wat 'gekwantificeerd' kan worden voor te stellen) en geregistreerd moeten worden in een immense gegevensbank, als in de validatie van de verzamelde gegevens en de interpretatie daarvan. Wie pakt dit titanenwerk aan… en wie zal ervoor betalen?
Aanbevelingen voor het gebruik van plaatjesremmers bij coronaire patiënten
De laatste jaren is het onderwerp erg omstreden, en er werd nieuwsgierig uitgekeken naar de mate waarin de werkgroep voor de samenstelling van deze guidelines een duidelijk idee zou kunnen geven over de 'huidige' situatie, vooral omdat er al veel studies naar gebeurd zijn, en er nog veel zullen volgen. Historisch gezien is men vertrokken van een situatie waarin men de occlusie van een stent wou vermijden, en is men aanbeland bij het probleem om parallel de klinische context af te bakenen waarin de stent werd geplaatst, waarbij er rekening mee wordt gehouden dat de patiënt niet altijd gedilateerd was. In de beslissingsboom wordt er bij deze coronaire patiënten daarom in eerste instantie een onderscheid gemaakt tussen de gebruikte behandeling (PCI, chirurgie of medische behandeling) en in een tweede fase tussen een stabiele context of die van een acuut coronair syndroom. Het gebruik van een score om het risico te meten maakt het ook mogelijk de beslissing te sturen.
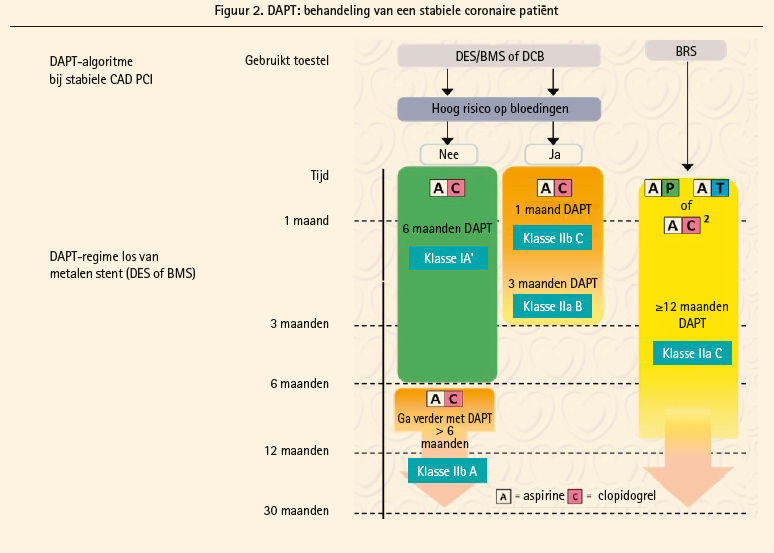
Wanneer bij een stabiele coronaire patiënt (figuur 2) een angioplastiek wordt uitgevoerd, is het eerstekeuzegeneesmiddel dat samen met aspirine moet worden gegeven clopidogrel, ook al blijft de deur openstaan voor bijzondere gevallen (hoge SYNTAX-score, trombose van de stent, plaats en aantal ingeplante stents, enz.) De radiale benadering wordt aanbevolen wanneer de operator hierin (IA) ervaren is, maar de routine-evaluatie van de plaatjesfunctie wordt afgeraden (IIIA). De duur van de DAPT (dual antiplatelet therapy) is 6 maanden (IA), wat ook het type stent is (DES of BMS). Bij patiënten met een hoog risico op bloedingen moet aan een duur van 3 maanden worden gedacht (IIa, B), en zelfs 1 maand wanneer er vragen zijn over de veiligheid (IIb, C). De guidelines geven bepaalde hoogrisicofactoren aan waarmee men rekening moet houden (maar zonder te preciseren wat de juiste gevolgen zijn. Die moeten dus door de arts worden ingeschat), zoals een stenttrombose onder een doeltreffende behandeling, de stenting van het laatste permeabele bloedvat, een diffuse drietaksziekte vooral bij diabetici, nierinsufficiëntie, meer dan 3 geïmplanteerde stents of meer dan 3 behandelde letsels, bifurcaties, een stent die langer is dan 60 mm, de behandeling van een chronische occlusie). Ook een perifere arteriële aandoening is een factor waar in dit stadium rekening mee moet worden gehouden. De mogelijkheid van een langere behandeling wordt dus opengehouden bij patiënten bij wie het ischemische risico hoger is dan het risico op bloedingen.
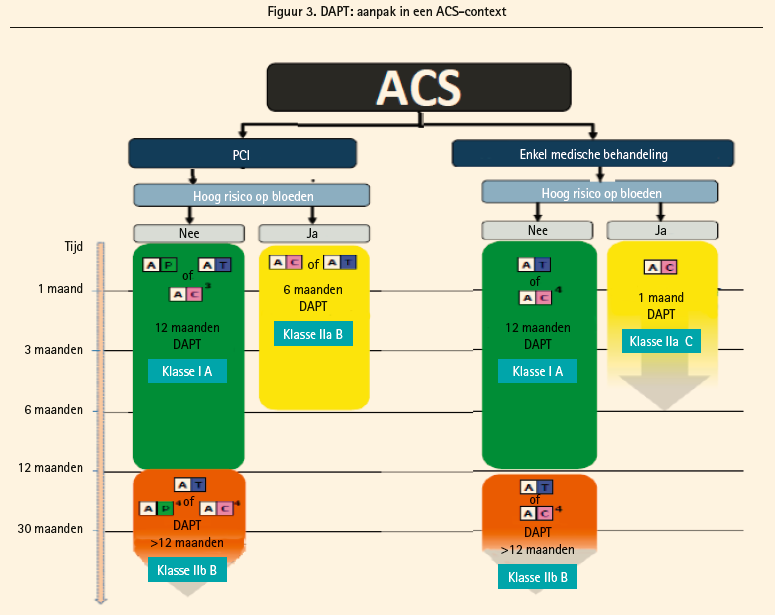
Bij een patiënt met een acuut coronair syndroom (figuur 3) zijn ticagrelor en prasugrel de eerstekeusgeneesmiddelen in vergelijking met clopidogrel, behalve bij patiënten die een orale anticoagulatie nodig hebben. Bij patiënten van wie de coronaire anatomie bekend is en voor STEMI-patiënten die PCI gaan krijgen wordt een voorbehandeling aanbevolen (IA). Bij patiënten met een coronair syndroom zonder verhoging van het STsegment die een invasieve behandeling zullen krijgen, moet worden gedacht aan een voorbehandeling met ticagrelor (IIa, C) maar dat wordt niet aanbevolen met prasugrel (IIIB). Na stenting bedraagt de aanbevolen duur van een DAPT 12 maanden (IA). Dat kan worden verkort tot 6 maanden bij patiënten met een hoog risico op bloedingen. Omgekeerd kan deze duur worden verlengd bij patiënten die geen bloedingen hebben gehad, bij voorkeur met ticagrelor 2 × 60 mg in vergelijking met clopidogrel of prasugrel. Bij een medische behandeling wordt een duur van een jaar ook aanbevolen voor een DAPT als discussiebasis, met een voorkeur voor ticagrelor maar met uitsluiting van prasugrel. Clopidogrel heeft de voorkeur bij patiënten met hoog risico op bloedingen, met een basisduur van minimaal 1 maand.
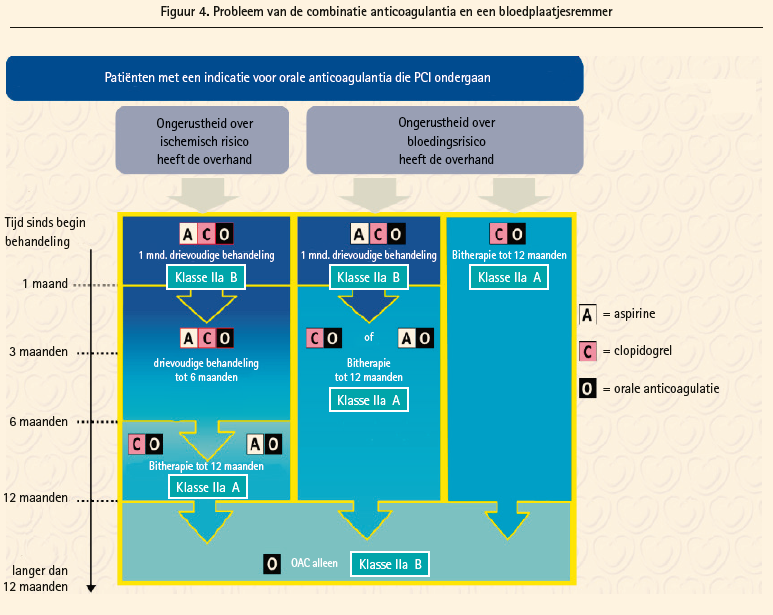
Bij patiënten die orale anticoagulantia moeten innemen (figuur 4) is het probleem ingewikkelder, omdat die patiënten vaak meer comorbiditeiten hebben en we slechts gegevens hebben uit 3 kleine studies. Het bewijsniveau in dit hoofdstuk is trouwens vaak graad C, dat van de experts. De basisaanbeveling is om alleen clopidogrel te gebruiken en een basis van een drievoudige therapie gedurende 1 maand te overwegen, wat ook het type stent is (maar in de praktijk is dat bijna altijd een DES). Naargelang van de klinische context (acuut coronair syndroom) of de anatomische criteria of de criteria die verbonden zijn aan de procedure van de PCI, kan deze duur worden verlengd tot 6 maanden bij patiënten met een laag risico op bloedingen. Na deze periode met een drievoudige therapie wordt een bitherapie met clopidogrel of aspirine + oraal anticoagulans aanbevolen tot een jaar, en nadien wordt alleen nog het anticoagulans gegeven. Wanneer het risico op bloedingen daarentegen zeer hoog is, wordt er meteen begonnen met een bitherapie van clopidogrel + anticoagulans gedurende een jaar, waarna wordt voortgegaan met alleen een anticoagulans.
In een hoofdstuk wordt de problematiek van een chirurgische ingreep voor deze patiënten uitgewerkt. Wat de cardiale chirurgie betreft, wordt het aanbevolen in het Heart Team een beslissing te nemen volgens het ischemische risico en bloedingsrisico. Het basisconcept is aspirine (IC) te blijven geven, de operatie uit te voeren bij de patiënten na een acuut coronair syndroom nadat ticagrelor minstens 3 dagen, clopidogrel minstens 5 dagen en prasugrel minstens 7 dagen is stopgezet (IIa, B). Het wordt aanbevolen om deze laatste geneesmiddelen zo snel mogelijk weer in te nemen, in principe voor een jaar (IC). Die duur kan worden verkort tot 6 maanden bij een hoog risico op bloedingen (IIa, C) en zelfs worden verlengd tot 36 maanden bij patiënten met een hoog ischemisch risico die de DAPT goed hebben verdragen, maar daar is het bewijsniveau lager (IIb, C). Wat niet-cardiale heelkunde betreft, wordt aangeraden aspirine te blijven voorschrijven als het risico op bloedingen dat mogelijk maakt. Daarom is pluridisciplinair overleg ter zake belangrijk. Bij patiënten met een stent wordt aanbevolen een electieve chirurgie uit te voeren na minstens een maand, zonder rekening te houden met het type stent, BMS of DES (IIa, B). De periode waarin de DAPT wordt stopgezet, hangt af van de verbinding, en we vinden dezelfde timing terug als voor cardiochirurgie: minstens 3 dagen voor ticagrelor, 5 voor clopidogrel en 7 voor prasugrel (indicatie van type IIa, eveneens B). Bij patiënten met een recent infarct of een hoog ischemisch risico kan erover gedacht worden om een electieve chirurgie uit te voeren, maar het bewijsniveau is lager (IIb, C), wat bewijst dat er ruimte is voor pluridisciplinaire gesprekken ter zake, in tegenstelling tot de initiële periode van een maand na de plaatsing van de stent, waar de stop van de DAPT niet wordt aanbevolen.
Behandeling van kleplijden
Er wordt heel duidelijk gekozen voor een pluridisciplinaire aanpak, en misschien nog het meest bij coronairlijden. We praten hier niet alleen over een 'Heart Team' met een competentie zowel op chirurgisch vlak (vervanging en herstel van kleppen) als wat de percutane aanpak betreft, zonder de beeldvorming te vergeten, met alle mogelijkheden die er de dag van vandaag zijn. Er wordt ook duidelijk gewezen op de behoefte aan een 'Heart Valve Center', een referentiecentrum (met zowel op het vlak van de interventie als van de beeldvorming criteria naar volume en kwaliteit), met een gespecialiseerd team dat samenwerkt met de andere centra binnen of buiten ziekenhuizen. In vergelijking met de oude guidelines van 2012 is de percutane aanpak duidelijk versterkt, wat waarschijnlijk een invloed heeft gehad op een aantal wijzigingen in de indicaties. Wat de anticoagulatie betreft, is er een andere grote wijziging: de NOAC's zijn nu goedgekeurd bij kleppatiënten met een aortastenose of -insufficiëntie, mitralisinsufficiëntie en ook een chirurgisch of via percutane weg ingeplante valvulaire bioprothese. Ze worden daarentegen niet aanbevolen bij mitralisstenose en een mechanische klep.
De visie op aortastenose is geëvolueerd met de percutane aanpak en de indicaties voor een interventie. De evaluatie van de ernst van een aortastenose is beter gedefinieerd (figuur 5), vooral wat de laaggradige stenoses betreft, een situatie waarover heel wat meer discussie is dan over de hooggradige stenoses. Wanneer de graad laag is (Vmax < 4m/s, gemiddelde gradiënt < 40 mmHg), wordt voorgesteld om het klepoppervlak nauwkeurig te evalueren. Wanneer het meer dan 1 cm2 bedraagt, spreken we over een matige aortastenose. Wanneer het minder is, is de volgende stap de vaststelling van de flux. Indien die normaal is (SVi > 35 ml/m2), is een ernstige stenose weinig waarschijnlijk. Als hij verkleind is, is het onderzoek van de linkerventrikelfunctie de volgende stap. Wanneer de EF ≥ 50 % is, wordt een geïntegreerde aanpak via de calciumscore erg belangrijk. Indien de EF < 50 % is, wordt een dobutaminetest aanbevolen om een onderscheid te maken, als er een reserveflux is, tussen pseudo-ernstige stenosen (oppervlak gegroeid > 1 cm2) en ernstige stenosen (< 1 cm2). Indien er geen reserve is, gaat het algoritme terug naar de calciumscore. Die score is dus belangrijker geworden in de nieuwe guidelines, en ze moet worden geïnterpreteerd afhankelijk van het geslacht. Er zijn hogere waarden nodig bij de man dan bij de vrouw om een oordeel te kunnen vellen over de ernst van de aortastenose (2000-3000 bij mannen en 1200-1600 bij vrouwen).
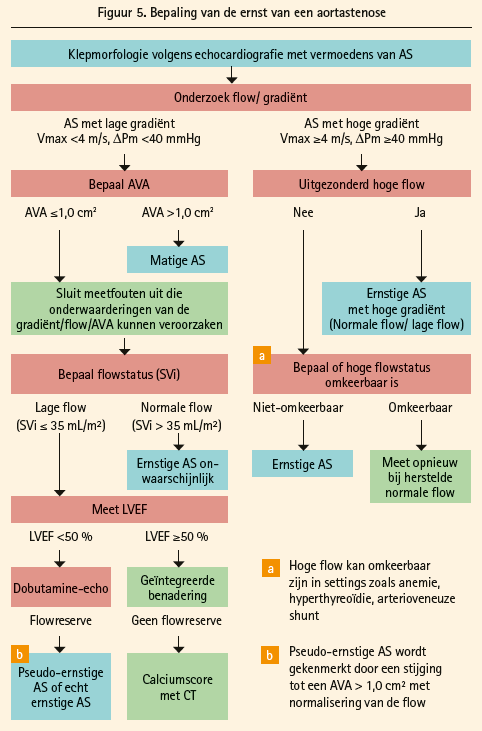
Op het vlak van interventies blijft een symptomatische (ernstige) aortastenose de grote indicatie. Een interventie wordt zelfs al overwogen bij een kleine gradiënt met klein debiet en een verminderde ejectiefractie zonder contractiele reserve, vooral wanneer de calciumscore verhoogd is, nu met een indicatie IIa, C. Het is duidelijk dat de percutane technieken (TAVI) deze guidelines hebben beïnvloed. Merk op dat comorbiditeiten in alle indicaties aan bod komen, en dat erop wordt gewezen dat wanneer ze ernstig zijn en een verbetering van de levenskwaliteit onwaarschijnlijk maken, ze een contra-indicatie zijn voor een interventie. Bij asymptomatische patiënten krijgen de verhoogde BNP-waarden een indicatie IIa, C net zoals de aanwezigheid van een ernstige pulmonale hypertensie (systolische druk van de pulmonale slagader in rust > 60 mmHg, bevestigd met een invasieve meting). Een systolische disfunctie en een slechte respons op een inspanningstest krijgen een indicatie van graad IC, net zoals patiënten met een ernstige stenose die een overbrugging moeten krijgen of moeten worden geopereerd aan de aorta ascendens. Een 'Heart Team' moet beraadslagen over de keuze tussen chirurgie en TAVI, afhankelijk van een reeks anatomische en technische criteria van de klep, de cardiale context en natuurlijk ook klinische eigenschappen van de patiënt en de uitvoering moet gebeuren in een 'Heart Valve Centre', indicatie van graad IC…
Bij aorta-insufficiëntie stuurt het symptomatische karakter ons richting chirurgie. Bij asymptomatische patiënten denken we, naast het probleem van een dilatatie van de aorta ascendens, aan een disfunctie van de LV (EF ≤ 50 % of LVEDD > 70 mm of LVESD > 50 mm).
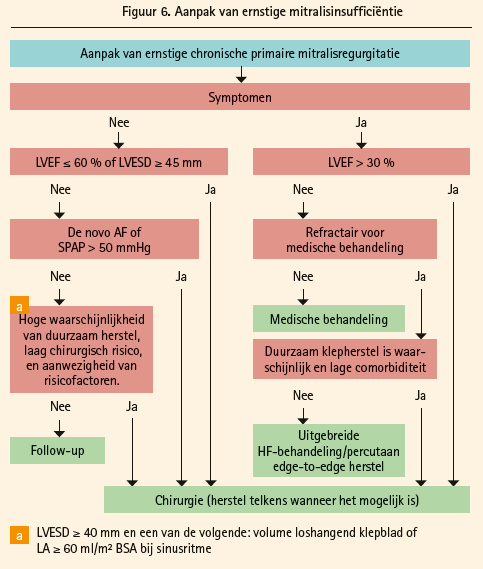
Bij ernstige mitralisinsufficiëntie (figuur 6) blijft het herstel van de klep de voorkeursbehandeling, voor de vervanging (IC). De symptomatische patiënten met een EF > 30 % en de asymptomatische patiënten met een disfunctie van de LV (LVESD ≥ 45 mm en/of EF ≤ 60 %) zijn indicaties van klasse IB terwijl de asymptomatische patiënt met behoud van de LV-functie maar met atriumfibrillatie als gevolg van de mitralisinsufficiëntie of de aanwezigheid van een pulmonale hypertensie (systolische druk van de pulmonale slagader > 50 mmHg invasief vastgesteld) een indicatie is van klasse IIa, B. Genuanceerder (IIa, C) is de indicatie bij asymptomatische patiënten met een EF > 60 % en een LVESD tussen 40 en 44 mm: dat vereist niet alleen een laag chirurgisch risico, een hoge waarschijnlijkheid op duurzaam herstel en de aanwezigheid van een prolaps of een dilatatie van het linkerhartoortje. Hetzelfde geldt voor symptomatische patiënten met een EF < 30 % en/of een LVESD > 55 mm (IIa, C). Symptomatische patiënten met een ernstige LV-disfunctie (EF < 30 % en/of LVESD > 55 mm) die refractair zijn voor medische behandeling krijgen een indicatie van type IIb, vooral als er weinig comorbiditeiten zijn en de klep hersteld kan worden. In de gevallen dat chirurgie onmogelijk of zeer risicovol wordt geacht, is de percutane aanpak nu een optie (IIb, C), vooral met de technieken van het MitraClip-type, bij symptomatische patiënten met een primaire ernstige mitralisinsufficiëntie die beantwoorden aan de echografische criteria om in aanmerking te komen. Bij ernstige secundaire mitralisinsufficiëntie is chirurgie vooral geïndiceerd bij patiënten die een indicatie voor revascularisatie hebben (en een bewezen viabiliteit hebben indien de ejectiefractie &;lt 30 % is). Indien er geen revascularisatie is, is de indicatie minder zeker (IIb, C) en moet de beslissing in het Heart Team worden genomen, waarbij de mogelijkheid van een percutane procedure eveneens moet worden overwogen.
Aanpak van perifeer arterieel vaatlijden
Een belangrijk punt dat in deze aanbevelingen wordt opgeworpen, is dat atherosclerose, wat de voornaamste oorzaak is van deze arteriële aandoening, een algemene ziekte is, die multidisciplinair moet worden aangepakt, in een Vascular Team. De nadruk ligt hier op de aanpak van de risicofactoren, of die nu nietfarmacologisch is (rookstop, gewichtsverlies, dieet, lichaamsbeweging) of medicamenteus (behandeling van de HTA en de diabetes, statines, antitrombotische geneesmiddelen).
Wat de perifere arteriën van de onderste ledematen betreft, wordt opnieuw het belang onderstreept van eenvoudige dingen bij de diagnostiek, zoals een bloeddrukmeting met bepaling van de enkel-armindex.
Wat de nierslagaders betreft, blijft de medicamenteuze behandeling erg belangrijk, met inbegrip van de ACEremmers (of angiotensine II-remmers) die de aanbevolen behandeling zijn bij unilaterale stenose (IB) met calciumantagonisten, bètablokkers en diuretica (IC), waar zelfs ook aan gedacht kan worden bij ernstige bilaterale stenose, wanneer ze goed worden verdragen en gepaard gaan met een strakke monitoring (IIb, B). Een routinematige vascularisatie wordt niet aanbevolen bij een stenose ten gevolge van atherosclerose (III, A), maar er moet wel aan worden gedacht bij fibromusculaire dysplasie (IIa, B).
Wat de carotiden betreft is een stenose < 60 % of een (bijna) afgesloten arteria carotis een indicatie voor een medische behandeling. Revascularisatie wordt tussen deze twee extremen overwogen bij patiënten die een levensverwachting hebben van > 5 jaar, en afhankelijk van de aanwezigheid van klinische of beeldvormingselementen die wijzen op een toegenomen risico op een cerebrovasculair accident. Bij symptomatische patiënten wordt chirurgie aanbevolen voor stenosen tussen 70 en 99 %, indien het procedurele risico (CVA/mortaliteit) < 6 % bedraagt (IA). Tussen 50 en 69 % is het bewijsniveau zwakker (IIa, B). Stenting is een alternatief (IIA, B) wanneer de patiënt een hoger chirurgisch risico loopt, maar wanneer het risico op het niveau van het chirurgische risico ligt (< 6 %), is het bewijsniveau lager (IIb, B). In ieder geval wordt bij een symptomatische patiënt een snelle interventie aangeraden, bij voorkeur binnen twee weken (IA).
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.