Un peu d'histoire ...
Dans les premières années de l'électrophysiologie, la fluoroscopie était la seule technique d'imagerie disponible pour visualiser la position et le mouvement des cathéters de diagnostic et d'ablation dans le coeur. Initialement, on n'utilisait que des cathéters uni- et bipolaires pour l'enregistrement des signaux électriques dans le coeur1. Les cathéters multipolaires (p. ex. 10 ou 20 pôles) s'utilisent pour la première fois au début des années 1990 pour l'enregistrement simultané de l'activité électrique dans le coeur, p. ex. pour visualiser le modèle d'activation de circuits de flutter dépendant de l'isthme dans l'oreillette droite2. Une nouvelle voie s'ouvre en 1997, avec l'introduction des premiers systèmes de cartographie électroanatomique en pratique clinique. Ces systèmes de mapping permettent alors de cartographier et de traiter les arythmies plus complexes, et ce moyennant des temps de fluoroscopie et de procédure réduits3.
Systèmes de cartographie conventionnelle
Les premiers systèmes de cartographie électroanatomique (EAM), commercialisés à la fin des années 1990, sont l'EnSite NavX (St. Jude Medical, Minneapolis, MN, USA) et le CARTO (Biosense Webster, Diamond Bar, CA, USA).
Pour la localisation des cathéters dans le coeur, le système EnSite utilise un champ électrique de haute fréquence (8 kHz), généré par l'envoi de courant alternatif entre des paires d'électrodes appliquées sur la cage thoracique du patient4.
Le système CARTO3 est un système hybride qui utilise non seulement un système via impédance électrique, comme l'EnSite, mais aussi un champ électromagnétique de faible énergie pour déterminer la position exacte des cathéters dans le coeur5.
Toutefois, les deux systèmes ont pour principal inconvénient que les divers EGM et leur position associée dans le coeur doivent être déterminés point par point et que leur annotation temporelle (indication du début de l'EGM correct) doit souvent être corrigée manuellement6, ce qui en fait souvent des procédures fastidieuses et chronophages. Avec cette méthode, il est souvent impossible d'enregistrer assez d'EGM pour créer une cartographie très détaillée de la cavité cardiaque visée (celle-ci nécessitant en général des milliers d'EGM). Au vu du nombre relativement faible d'EGM disponibles, le système va les interpoler pour compléter la cartographie du coeur, avec le risque que de petites cicatrices ou circuits de réentrée ne soient parfois pas suffisamment cartographiés.
Pour remédier à ce problème, plusieurs cathéters de cartographie multi-électrodes (MEM) ont été développés ces dernières années dans le but d'obtenir plus rapidement un mapping plus détaillé des différentes cavités cardiaques ('cartographie haute définition').
Systèmes de cartographie haute définition
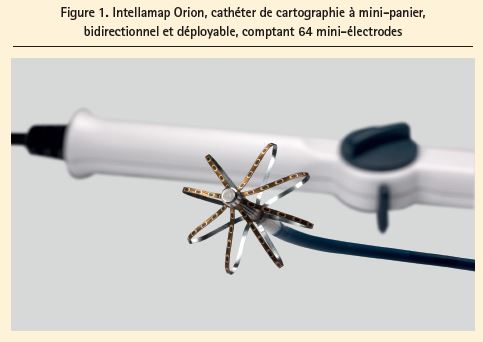
Le système RHYTHMIA HDx (Boston Scientific, Marlborough, MA, USA) est un système de cartographie électromagnétique hybride (comme CARTO3), automatisé et à haute densité, qui utilise un cathéter à mini-panier irrigué bidirectionnel de 8,5 F, couvert de 64 pôles (Intellamap Orion) (figure 1). Le panier de l'Orion se compose de 8 attelles portant chacune 8 mini-électrodes planes (0,4 mm²). Le panier peut se déployer jusqu'à atteindre un diamètre maximum de 22 mm. Le nez du cathéter renferme un capteur magnétique, qui indique la position du cathéter dans le coeur en relation avec un champ magnétique sous la table d'examen. Le système utilise par ailleurs une détection via impédance sur les 64 mini-électrodes, ce qui confère au cathéter Orion une précision navigationnelle de ≤ 1 mm7. Pendant la construction de la géométrie, une carte voltage (bipolaire/unipolaire) et une carte d'activation (en rythme sinusal, stimulation ou tachycardie) sont réalisées simultanément. De par la grande précision anatomique, la fusion avec un CT-scan est souvent inutile.
Le système RHYTHMIA HDx possède un certain nombre d'avantages de poids par rapport aux systèmes de cartographie conventionnelle. Tout d'abord, son grand nombre d'électrodes permet d'enregistrer beaucoup plus d'EGM en une session (quantité), en moyenne env. 1000 points/minute8. Il est donc plus facile de cartographier les arythmies non auto-entretenues, ainsi que les arythmies qui déclenchent une instabilité hémodynamique. Le système RHYTHMIA HDx accepte exclusivement les EGM enregistrés dans les 2-4 mm de la géométrie acquise. La rapidité de la cartographie facilite par ailleurs la réalisation d'un 're-map'.
Comme les électrodes sont de petite superficie et sont montées très proches les unes des autres, la résolution obtenue est bien meilleure (qualité) en comparaison d'autres cathéters de cartographie8. Il en résulte un enregistrement plus précis du signal 'nearfield', avec une moindre interférence des signaux 'farfield' et des bruits9. Il est ainsi possible de dresser une carte plus détaillée de régions à faible voltage, d'une part grâce au contraste accru dans la région concernée, mais d'autre part aussi parce que les signaux très faibles peuvent désormais être bien mieux détectés grâce à la moindre interférence des bruits (le seuil n'est que d'environ 0,01 mV10) et grâce à l'utilisation de filtres spéciaux pour détecter les signaux de faible amplitude. On observe ainsi régulièrement que, à l'intérieur de zones cicatricielles, il reste encore de petits canaux de tissu conducteur à très faibles voltages, lesquels ne seraient jamais détectés avec une EAM classique (jusqu'à 30 % de surface cicatricielle < 0,5 mV en moins lors d'une cartographie auriculaire réalisée avec le système RHYTHMIA HDx11). Pour le reste, il est aussi plus souvent possible, face à une tachycardie de réentrée, de définir une zone au sein de la tachycardie jonctionnelle où un traitement efficace peut être atteint moyennant un nombre limité de points d'ablation. La zone visée pour l'ablation pouvant être visualisée avec précision, les manoeuvres d'entraînement ne sont en outre plus nécessaires pour confirmer que le cathéter d'ablation se trouve bien à l'endroit du circuit de réentrée.
De plus, le système RHYTHMIA HDx peut compter sur un algorithme avancé pour une annotation automatique exacte des EGM tant unipolaires que bipolaires, le timing étant noté au point du dV/ dt maximum de l'EGM unipolaire et au point de l'amplitude maximum de l'EGM bipolaire7. Si plusieurs EGM sont enregistrés à un endroit précis, le système examine automatiquement les EGM à proximité pour décider, sur la base d'un critère de cohérence, l'EGM qui est vraisemblablement le plus correct à annoter.12 Enfin, les artéfacts peuvent également entraîner une annotation erronée. Mais ceux-ci peuvent être distingués facilement sur la carte, puisqu'ils y créent des zones de code couleur incohérent et/ou illogique. Ces points peuvent aisément être contrôlés d'un seul clic de souris, ou supprimés, ou réannotés manuellement.
Résultats
En avril 2016, notre centre a été le premier de Belgique à démarrer les procédures avec le nouveau système de cartographie RHYTHMIA HDx. La 100ème procédure a été réalisée en juin 2017. À l'heure où vous lisez cet article, nous avons dépassé les 150 procédures. Les données des 100 premières procédures ont été rassemblées et analysées rétrospectivement en vue d'évaluer les performances du système.
L'âge moyen des patients était de 61 ± 13 ans, et 58 % étaient de sexe masculin. La majorité des procédures consistaient en ablations 'redo' (n = 77) et étaient réalisées pour fibrillation auriculaire (n = 53; 80 % persistantes) ou circuit de flutter atypique gauche (n = 13). Chez 52 % des patients qui avaient déjà subi auparavant une isolation des veines pulmonaires (PVI), on a constaté la reconnexion d'une ou plusieurs veines pulmonaires (surtout à droite), pour laquelle une ré-isolation a donc été effectuée dans la foulée. Chez les autres patients (sans reconnexion), des lignes complémentaires ont été créées dans l'oreillette gauche et/ou droite. Une PVI index a été réalisée dans six procédures. Dixsept procédures ont été exécutées dans le cadre d'une tachycardie auriculaire ectopique, dont 6 droites. Pour le reste, des procédures ont également été réalisées dans le cadre de la courbe d'apprentissage du système, notamment sur flutter auriculaire typique droit (12 procédures), sur AVNRT (2 procédures), sur ectopies ventriculaires (2 procédures) et sur tachycardie ventriculaire liée à une cicatrice (1 procédure).
Le temps moyen nécessaire à la cartographie était de 9,2 ± 7,2 minutes pour un volume moyen de 93,8 ± 42 ml dans l'oreillette droite et de 13,5 ± 8,5 minutes pour un volume moyen de 122,2 ± 41 ml dans l'oreillette gauche. L'oreillette droite et l'oreillette gauche ont été cartographiées toutes les deux dans 31 procédures. Au total, 6,710 ± 5,758 EGM en moyenne étaient enregistrés et annotés automatiquement dans l'oreillette droite et 11,368 ± 8,397 EGM dans l'oreillette gauche, sur 484 ± 478 et 926 ± 815 battements de coeur, respectivement. Cela correspond à 728,1 EGM par minute et 13,9 EGM par battement dans l'oreillette droite, et à 857,6 EGM par minute et 12,4 EGM par battement dans l'oreillette gauche.
La technique s'est avérée à la fois efficace et sûre. L'ablation a été couronnée de succès dans 92 % des procédures.
Applications
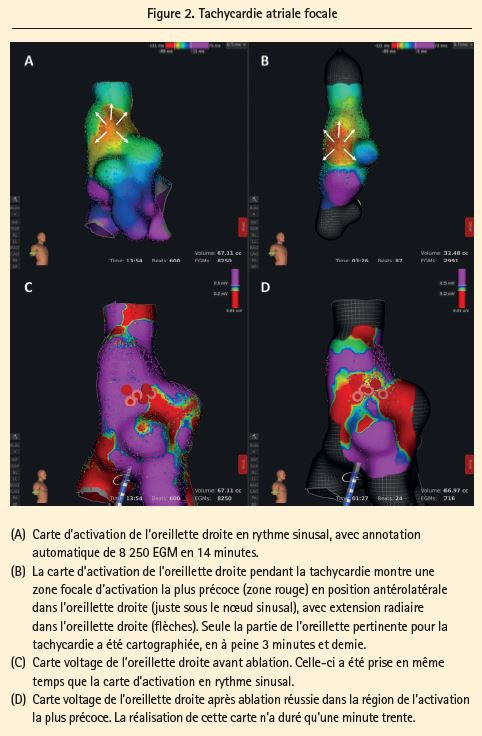
Tachycardie atriale focale (figure 2)
Le système RHYTHMIA HDx est le système de cartographie électroanatomique idéal dans la tachycardie atriale focale, surtout en cas de tachycardies difficiles à induire, non auto-entretenues, multiples et/ou hémodynamiquement instables.
La rapidité du système permet déjà d'obtenir une carte précise de la tachycardie en peu de temps. Si plusieurs tachycardies sont déclenchées (p. ex. 3 ou 4), on peut facilement réaliser une nouvelle carte à chaque fois, sans pour autant devoir prolonger la procédure pendant des heures.
Grâce à la haute résolution du système, il est possible de définir avec une grande exactitude la zone d'activation la plus précoce, ce qui permet un marquage très précis de la cible pour l'ablation. Il est parfois même possible de visualiser les circuits de micro-réentrée sous-jacents. Après induction de la tachycardie, le système utilise les dix premières secondes pour calculer la longueur moyenne du cycle sur la base du schéma d'activation sur le cathéter de référence décapolaire dans le sinus coronaire7. Le système mettra ensuite automatiquement 50 % de la longueur du cycle de la tachycardie avant la référence et 50 % après (ce réglage peut être adapté pendant la procédure). Par la suite, les EGM sont enregistrés et annotés automatiquement s'ils remplissent les critères d'acceptation définis7: stabilité du cycle (p. ex. déviation de 20 ms acceptable), position stable des électrodes de cartographie sur le système Orion, timing relatif stable entre les deux EGM de référence et 'gating' respiratoire.
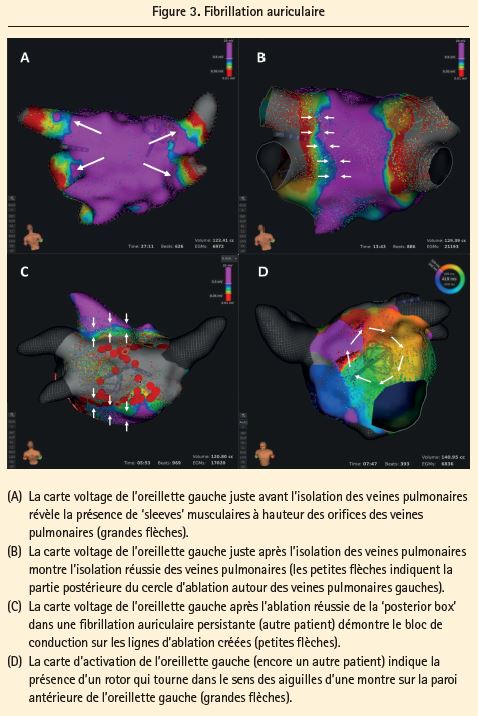
Isolation des veines pulmonaires dans la fibrillation auriculaire (figure 3) Les isolations des veines pulmonaires peuvent être réalisées avec ou sans l'aide d'un système de cartographie électroanatomique (EAM). Si on utilise une technique d'ablation 'single-shot', comme la technologie du cryoballon, une EAM n'est pas à proprement parler absolument nécessaire et on peut opérer sur la base de la fluoroscopie. Dans le cas d'une ablation point par point par radiofréquence (RF), l'EAM est en revanche indispensable. Ces 20 dernières années, les PVI point par point par radiofréquence ont traditionnellement été réalisées à l'aide des systèmes de cartographie CARTO ou EnSite, moyennant l'utilisation d'un cathéter circulaire ('Lasso') multi-électrodes que l'on place séquentiellement dans les différentes veines pulmonaires pour évaluer la survenue d'une isolation pendant l'ablation. Par rapport aux EAM classiques, le nouveau système RHYTHMIA HDx présente toutefois quelques avantages attrayants dans la PVI-index: 1) Précision anatomique. En une dizaine de minutes, il est possible d'obtenir une carte très précise de l'oreillette gauche sans fusion requise avec un CT-scan. La haute résolution anatomique de la carte est nécessaire au vu de la grande variation anatomique d'un patient à l'autre. Le 'ridge' entre les veines pulmonaires gauches et l'appendice auriculaire gauche est notamment un site classique de reconnexion en cas d'ablation inadéquate et la cartographie détaillée de cette région ne peut que contribuer à optimiser le succès de l'ablation. 2) Détection de potentiels PV. Avec son meilleur rapport signal/bruit, le système RHYTHMIA HDx est plus sensible pour détecter (après ablation partielle) les potentiels PV résiduels de faible amplitude13. Qui plus est, le système permet de visualiser les 'sleeves' musculaires (terminaisons musculaires des oreillettes dans les veines pulmonaires), ce qui est une première dans l'histoire des EAM. Ce point est important, car c'est à ces endroits que la fibrillation auriculaire prend naissance.
3) Détection de rotors et de triggers PV supplémentaires. En raison de la haute résolution et de la rapidité de la cartographie, il est plus facile de décortiquer les mécanismes de l'arythmie et d'effectuer des ablations plus spécifiques14.
4) Confirmation de bloc. Grâce à la rapidité de la cartographie, il faut peu de temps pour faire un 'remap' après l'ablation. Quant à la haute résolution, elle facilite la détection des petits 'gaps' dans les lignes d'ablation et la confirmation de la présence d'un bloc/d'une isolation10.
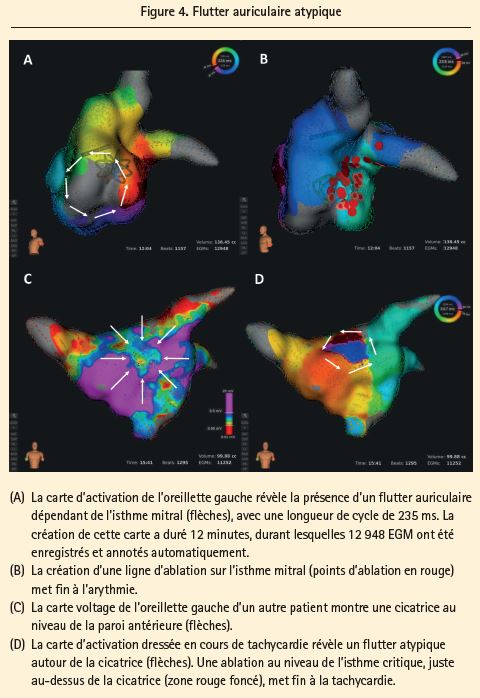
Flutter auriculaire atypique gauche (figure 4)
Lors d'une récidive d'arythmie après une isolation antérieure des veines pulmonaires, on observe régulièrement un flutter auriculaire atypique gauche pendant une procédure 'redo', surtout en présence d'un substrat cicatriciel sous-jacent dans les oreillettes.
En utilisant le système RHYTHMIA HDx, il est possible de visualiser ces zones cicatricielles dans le détail9. Le système peut par ailleurs chercher, dans ces zones cicatricielles, d'éventuels circuits de réentrée avec des EGM multicomposants fractionnés complexes à faible voltage15-16, qui sont soit difficiles à détecter (en raison de leur faible voltage), soit annotés incorrectement (en raison des composants multiples) avec les systèmes d'EAM classique. Le système RHYTHMIA HDx permet désormais d'annoter correctement plus de 90 % de tous les EGM multicomposants (contre environ 70 % avec d'autres cathéters multi-électrodes)9. La stimulation d'entraînement (avec le risque de voir l'arythmie cesser ou dégénérer en une autre fibrillation ou tachycardie auriculaire, et parfois sans la moindre capture dans les zones cicatricielles) n'est dès lors plus nécessaire pour confirmer que le cathéter d'ablation est bien positionné au niveau du circuit de réentrée.
Conclusion
La cartographie haute définition est un développement récent dans le domaine de la cartographie électroanatomique, qui permet d'enregistrer et d'annoter correctement un nombre d'électrogrammes jusqu'alors impossible à atteindre, le tout de manière automatisée et en un temps réduit. Elle fournit une amélioration considérable de la résolution de la cartographie électroanatomique, permettant ainsi une meilleure compréhension des diverses arythmies et de leur substrat sous-jacent. Le tout débouche sur le raccourcissement des procédures et sur l'amélioration des chances d'une ablation réussie. La conduite d'études contrôlées randomisées s'impose néanmoins afin de démontrer la supériorité de la cartographie haute définition sur les techniques actuelles de cartographie conventionnelle.
Références
- Giraud, G., Puech, P., Latour, H. The physiological electrical activity of Tawara's node and of His' bundle in man: Endocavitary electrocardiographic registration. Bull Acad Natl Med, 1960, 144, 363-366.
- Saoudi, N., Atallah, G., Kirkorian, G., Touboul, P. Catheter ablation of the atrial myocardium in human type I atrial flutter. Circulation, 1990, 81, 762-771.
- Earley, M.J., Showkathali, R., Alzetani, M., Kistler, P.M., Gupta, D., Abrams, D.J., et al. Radiofrequency ablation of arrhythmias guided by nonfluoroscopic catheter location: a prospective randomized trial. Eur Heart J, 2006, 27, 1223-1229.
- Jiang, Y., Farina, D., Bar-Tal, M., Dössel, O. An impedance based catheter positioning system for cardiac mapping and navigation. IEEE Trans Biomed Eng, 2009, 56, 1963-1970.
- Gepstein, L., Hayam, G., Ben-Haim, S.A. A novel method for nonfluoroscopic catheter-based electroanatomical mapping of the heart: In vitro and in vivo accuracy results. Circulation, 1997, 95, 1611-1622.
- Jones, D.G., McCready, J.W., Kaba, R.A., Ahsan, S.Y., Lyne, J.C., Wang, J., et al. A multipurpose spiral high-density mapping catheter: initial clinical experience in complex atrial arrhythmias. J Interv Card Electrophysiol, 2011, 31, 225-235.
- Mantziari, L., Butcher, C., Kontogeorgis, A., Panikker, S., Roy, K., Markides, V., et al. Utility of a novel rapid high-resolution mapping system in the catheter ablation of arrhythmias: An initial human experience of mapping the atria and the left ventricle. JACC: Clin Electrophysiol, 2015, 1(5), 411-420.
- Schaeffer, B., Hoffmann, B.A., Meyer, C., Akbulak, R.Ö., Moser, J., Jularic, M., et al. Characterization, mapping, and ablation of complex atrial tachycardia: initial experience with a novel method of ultra high-density 3D mapping. J Cardiovasc Electrophysiol, 2016, 27, 1139-1150.
- Anter, E., McElderry, T.H., Contreras-Valdes, F.M., Li, J., Tung, P., Leshem, E., et al. Evaluation of a novel high-resolution mapping technology for ablation of recurrent scar-related atrial tachycardias. Heart Rhythm, 2016, 13(10), 2048-2055.
- Nakagawa, H., Ikeda, A., Sharma, T., Lazzara, R., Jackman, W.M. Rapid high resolution electroanatomical mapping: Evaluation of a new system in a canine atrial linear lesion model. Circ Arrhythm Electrophysiol, 2012, 5, 417-424.
- Anter, E., Tschabrunn, C.M., Josephson, M.E. High-resolution mapping of scar-related atrial arrhythmias using smaller electrodes with closer interelectrode spacing. Circ Arrhythm Electrophysiol, 2015, 8, 537- 545.
- Bun, S.S., Laţcu, D.G., Delassi, T., Jamili, M.E., Amoura, A.A., Saoudi, N. Ultra-High-Definition Mapping of Atrial Arrhythmias. Circ J, 2016, 80(3), 579-586.
- Anter, E., Tschabrunn, C.M., Contreras-Valdes, F.M., Li, J., Josephson, M.E. Pulmonary vein isolation using the Rhythmia mapping system: Verification of intracardiac signals using the Orion mini-basket catheter. Heart Rhythm, 2015, 12, 1927-1934.
- Haissaguerre, M., Hocini, M., Denis, A., Shah, A.J., Komatsu, Y., Yamashita, S., et al. Driver domains in persistent atrial fibrillation. Circulation, 2014, 130, 530-538.
- Luther, V., Sikkel, M., Bennett, N., Guerrero, F., Leong, K., Qureshi, N., et al. Visualizing Localized Reentry With Ultra-High Density Mapping in Iatrogenic Atrial Tachycardia: Beware Pseudo-Reentry. Circ Arrhythm Electrophysiol, 2017, 10(4), e004724.
- Laţcu, D.G., Bun, S.S., Viera, F., Delassi, T., El Jamili, M., Al Amoura, A., et al. Selection of Critical Isthmus in Scar-Related Atrial Tachycardia Using a New Automated Ultrahigh Resolution Mapping System. Circ Arrhythm Electrophysiol, 2017, 10(1), e004510.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.