à l'heure actuelle, les maladies cardiovasculaires restent une importante cause de morbi-mortalité dans le monde occidental, et ce, malgré les traitements préventifs.1 L'hypercholestérolémie est un des principaux facteurs de risque.2-3 Le traitement hypocholestérolémiant habituel est constitué de statines et/ou d'ézétimibe. Une diminution du cholestérol LDL de 40 mg/dl pendant 5 ans est associée à une réduction de 22 % du risque d'événements cardiovasculaires majeurs, qu'on administre des statines ou non, et quel que soit le taux de cholestérol LDL initial.2 Certains groupes de patients n'atteignent pas le LDL cible, comme les patients en prévention secondaire, les patients souffrant d'hypercholestérolémie familiale, les patients intolérants aux statines et - enfin - les diabétiques. Lorsqu'ils sont traités par statines, les diabétiques obtiennent la même réduction du risque relatif que les non-diabétiques, mais leur risque cardiovasculaire initial est plus élevé.4 Pour cette raison, il peut être indiqué de tendre à une diminution supplémentaire du cholestérol LDL, et une combinaison d'hypocholestérolémiants est parfois nécessaire.3
L'ajout d'ézétimibe au traitement par statine permet d'obtenir une réduction additionnelle du cholestérol LDL de 20-25 %, et on a démontré que ceci réduit davantage le risque cardiovasculaire.5 De ce fait, on recommande actuellement d'ajouter de l'ézétimibe au traitement lorsque le LDL cible n'est pas atteint, en dépit d'un traitement par statine à la dose maximale tolérée.6 Par après, les inhibiteurs de la PCSK9 (proprotéine convertase subtilisine/kexine de type 9) ont fait leur apparition sur le marché, en l'occurrence l'alirocumab (Praluent®, Sanofi) et l'évolocumab (Repatha®, Amgen), des anticorps monoclonaux. Ces deux produits permettent d'obtenir une diminution supplémentaire du cholestérol LDL de 50-60 %.7,8 L'étude FOURIER a démontré que l'ajout d'un inhibiteur de la PCSK9 (évolocumab 140 mg toutes les 2 semaines ou 420 mg par mois) à une statine induit une réduction supplémentaire et significative du risque d'événements cardiovasculaires, et ceci concorde avec le bénéfice prédit au départ d'une analyse de méta-régression.9
Entre-temps, on a mené des études additionnelles sur les effets et la sécurité du traitement par inhibiteurs de la PCSK9 chez les diabétiques. Dans cet article, nous traiterons plus en détail des résultats de la sous-analyse de l'étude FOURIER chez les diabétiques,10 de l'étude ODYSSEY DM-INSULIN et de l'étude ODYSSEY DM-DYSLIPIDEMIA.11, 12
FOURIER in Diabetes
Dans l'étude FOURIER, 11 031 (soit 40 %) des 27 564 participants souffraient de diabète (97 % de diabète de type 2, 3 % de diabète de type 1).10 Les diabétiques étaient plus souvent des femmes, leur IMC et leurs triglycérides étaient quelque peu plus élevés, ils étaient plus souvent hypertendus, avaient une eGFR moindre, et avaient davantage d'antécédents d'AVC et de vasculopathies périphériques. Une première observation frappante fut que les patients souffrant de diabète (mais pas de prédiabète) et ayant un antécédent cardiovasculaire couraient un risque substantiellement plus élevé de morbi-mortalité cardiovasculaire. Deuxièmement, le traitement par évolocumab entraînait une diminution significative du cholestérol LDL, tant chez les diabétiques (-57 %) que chez les non-diabétiques (-60 %), avec l'obtention d'un LDL à 32 mg/dl dans les deux sous-groupes. Le critère d'évaluation primaire - une combinaison de décès cardiovasculaire, d'infarctus myocardique, d'AVC, d'hospitalisation pour angor instable ou de revascularisation coronaire - avait diminué dans les deux groupes au bout d'un suivi médian de 2,2 ans: le hazard ratio atteignait 0,83 (IC à 95 % 0,75-0,93; p = 0,0008) chez les diabétiques et 0,87 (0,79-0,96; p = 0,0052) chez les non-diabétiques. étant donné le risque initial plus élevé d'événements cardiovasculaires, les diabétiques obtenaient une diminution plus importante du risque absolu après un traitement par évolocumab (donnant un NNT (number needed to treat) de 37 chez les diabétiques et de 62 chez les non-diabétiques, et ce, après 3 ans de traitement par évolocumab, pour éviter un événement primaire).
La fréquence d'effets indésirables ne différait pas significativement entre les deux groupes. Les effets indésirables tels qu'événements neurocognitifs ou musculaires n'étaient pas plus fréquents avec l'évolocumab. On n'a pas noté de risque accru de développer un diabète durant 2,2 ans de suivi, ni chez les non-diabétiques (HR 1,05, 0,94-1,17), ni chez les patients souffrant d'un prédiabète (HR 1,00, 0,89-1,13). Les taux d'HbA1c et la glycémie à jeun étaient comparables dans tous les groupes de patients.
ODYSSEY DM-INSULIN
Dans l'étude ODYSSEY DM-INSULIN, la population était exclusivement constituée de diabétiques de type 2 (n = 441) et de type 1 (n = 76), traités par insuline.11 Les patients inclus avaient un risque cardiovasculaire élevé et des taux de LDL supérieurs à 70 mg/dl sous la dose maximale de statine tolérée, ou ils étaient intolérants aux statines, ou encore ils recevaient un autre traitement hypocholestérolémiant. L'IMC de la population atteignait 32 kg/m2. En ce qui concerne le diabète, la durée de la maladie atteignait 15 ans chez les diabétiques de type 2, mais la durée médiane du diabète était beaucoup plus longue chez les diabétiques de type 1 (35 ans). Il en allait de même de la durée de l'insulinothérapie: 35 ans chez les diabétiques de type 1, versus 6 ans chez les diabétiques de type 2. Les patients ont été randomisés selon un rapport 2:1 vers alirocumab ou un placebo, qu'on administrait toutes les 2 semaines par voie sous-cutanée pendant 24 semaines. Dans le groupe alirocumab, on a commencé avec une dose de 75 mg, qui a éventuellement été augmentée (de manière aveugle) à 150 mg à la semaine 12, si le taux de cholestérol LDL était > 70 mg/dl à la semaine 8.
Au bout de 24 semaines de traitement par alirocumab, on a observé une diminution significative du cholestérol LDL de 48,2 % chez les diabétiques de type 2 et de 51,8 % chez les diabétiques de type 1, comparativement à +0,8 % et -3,9 %, respectivement, dans les groupes placebo (tous deux p < 0,0001) (figure 1). Il n'a été nécessaire d'augmenter la dose d'alirocumab de 75 mg à 150 mg que chez 22,6 % des patients. La réduction obtenue du LDL était très comparable et donc cohérente avec les autres études du programme ODYSSEY. 76,4 % des diabétiques de type 2 et 70,2 % des diabétiques de type 1 ont obtenu un LDL < 70 mg/dl (versus respectivement 7,4 % et 5,1 % dans les groupes placebo). La diminution du cholestérol non-HDL (-38,7 %), de l'apolipoprotéine B (-36,7 %), du cholestérol total (-27,6 %) et de la lp(a) (-18,4 %) était également homogène (tous p < 0,0001), de même qu'une élévation significative du cholestérol HDL (+4,4 %, p < 0,01).
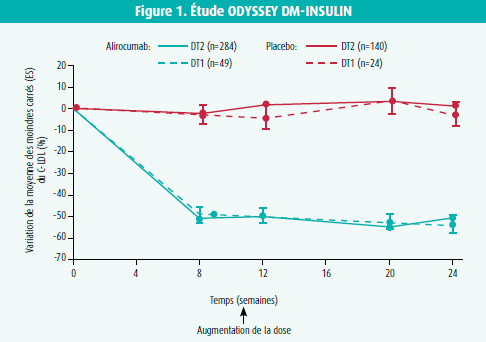
L'étude ODYSSEY DM-INSULIN était également importante pour évaluer la sécurité de l'utilisation concomitante d'un agent biologique (insuline) et d'un anticorps monoclonal (alirocumab). étant donné que l'utilisation d'une dose élevée de statines est associée à un risque accru de diabète, et que des éléments indiquent que la PCSK9 est liée à l'homéostasie glucidique, on a soigneusement analysé les effets potentiels des inhibiteurs de la PCSK9 sur le contrôle glycémique.13-16 Dans l'étude ODYSSEY DM-INSULIN, on n'a pas observé de modifications du taux d'HbA1c ni de la glycémie à jeun, que ce soit chez les diabétiques de type 2 ou de type 1, et la dose quotidienne totale d'insuline et le nombre des autres médicaments hypoglycémiants est également resté identique pendant toute la durée de l'étude. L'absence d'effet néfaste sur le contrôle glycémique a également été constatée avec l'autre inhibiteur de la PCSK9, l'évolocumab.17 Il va de soi qu'il faut rester critique et attendre les résultats des études avec une plus longue durée de traitement (> 2 ans) pour évaluer les effets néfastes potentiels des inhibiteurs de la PCSK9 sur le contrôle glycémique.
D'autres questions prioritaires étaient les réactions allergiques au site d'injection, les effets indésirables neurologiques et neurocognitifs et la présence d'anticorps contre l'inhibiteur de la PCSK9. Ici aussi, les problèmes sont extrêmement limités (et non différents par rapport au placebo) et très cohérents avec les autres études.
ODYSSEY DM-DYSLIPIDEMIA
C'est surtout chez les diabétiques de type 2 souffrant d'une dyslipidémie mixte que le cholestérol non-HDL est considéré comme un meilleur prédicteur du risque cardiovasculaire.18 Le cholestérol non-HDL contient en effet tout le cholestérol athérogène circulant qui est présent dans les particules de lipoprotéines contenant de l'apoB, comme les VLDL, IDL, LDL et la lp(a). Les récentes recommandations de l'ESC préconisent même d'utiliser le cholestérol non-HDL comme cible thérapeutique alternative.6 Le problème est que l'effet du traitement hypocholestérolémiant sur ce paramètre a été étudié moins en détail. La plupart des recommandations suggèrent un cholestérol non-HDL supérieur de 30 mg/dl à la valeur du LDL. Dès lors, chez les diabétiques courant un risque cardiovasculaire élevé à très élevé, ayant un LDL cible < 70 ou < 100 mg/dl, respectivement, le cholestérol non-HDL cible devrait être < 100 ou < 130 mg/dl.6 Le cholestérol non-HDL peut facilement être calculé à partir d'une prise de sang de routine: cholestérol non- HDL = cholestérol total -cholestérol HDL.19
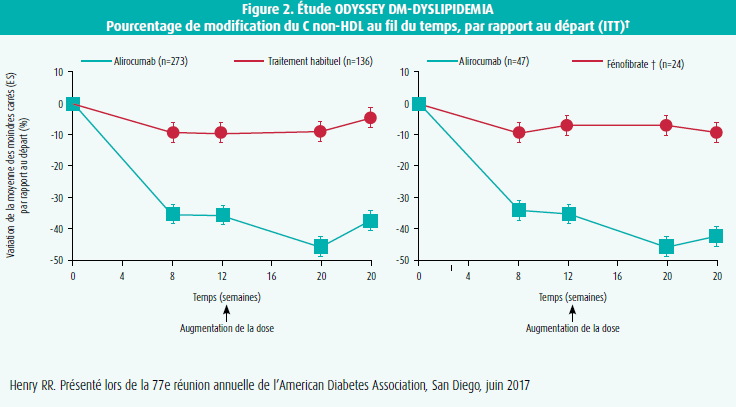
Dans l'étude ODYSSEY DM-DYSLIPIDEMIA, la population d'étude était constituée de 413 diabétiques de type 2 souffrant d'une maladie cardiovasculaire documentée ou ayant ≥ 1 facteur de risque cardiovasculaire supplémentaire et une dyslipidémie mixte, définie comme un non-HDL ≥ 100 mg/dl et des triglycérides ≥ 150 et < 500 mg/dl, traités au moyen d'une statine à la dose maximale tolérée.12 La modification du cholestérol non-HDL au bout de 24 semaines de traitement par alirocumab versus le traitement habituel (randomisation 2:1) constituait le critère d'évaluation primaire de l'étude. En cas de randomisation vers le traitement habituel, on ajoutait à la statine un autre produit hypocholestérolémiant tel qu'ézétimibe, fénofibrate, acides gras oméga 3 ou acide nicotinique. Au bout de 24 semaines de traitement par alirocumab, on a observé une diminution significative du cholestérol non-HDL de 33,3 % comparativement à un traitement par fénofibrate (p < 0,0001) (figure 2). Chez 65,2 % des patients traités par alirocumab, on a pu obtenir un cholestérol non-HDL < 100 mg/dl, versus 10,1 % des patients traités par fénofibrate. Dans cette étude également, l'alirocumab était bien toléré, et il n'y avait pas d'effet néfaste sur l'HbA1c ou la glycémie à jeun.
Conclusion
Dans la sous-analyse de FOURIER, les diabétiques couraient un risque initial d'événements cardiovasculaires plus élevé.10 Sous traitement par évolocumab, les diabétiques obtiennent une réduction du risque absolu plus importante par rapport aux non-diabétiques, ce qui entraîne une diminution du nombre d'événements cardiovasculaires.
Nous retenons de l'étude ODYSSEY DM-INSULIN que l'utilisation concomitante d'alirocumab et d'insuline est efficace, tant chez les diabétiques de type 1 que de type 2 souffrant d'hypercholestérolémie et courant un risque cardiovasculaire élevé, et qu'elle entraîne une réduction significative du LDL, en toute sécurité, et sans influence néfaste sur le contrôle glycémique.11
Dans l'étude ODYSSEY DM-DYSLIPIDEMIA, l'alirocumab se révèle supérieur sur le plan de la réduction du cholestérol non- HDL, comparativement au traitement habituel ou au fénofibrate.12
Les inhibiteurs de la PCSK9 ouvrent donc la voie vers une nouvelle prise en charge de la diminution du cholestérol, surtout dans une population à haut risque et, à l'avenir, potentiellement aussi chez les diabétiques. Pour le moment, il reste important d'optimiser tout d'abord le traitement existant par statines et ézétimibe, conformément aux nombreuses preuves scientifiques et aux recommandations actuelles, avant de débuter un inhibiteur de la PCSK9.
Références
- 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. GUIDELINE SUMMARY NGC:010477 2014 JUL 1. American College of Cardiology Foundation.
- Silverman, M.G., Ference, B.A., Im, K., Wiviott, S.D., Giugliano, R.P., Grundy, S.M., et al. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions: a systematic review and meta-analysis. JAMA, 2016, 316, 1289-1297.
- Ference, B.A., Ginsberg, H.N., Graham, I., Ray, K.K., Packard, C.J., Bruckert, E., et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J, 2017, 38, 2459-2472.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomised placebo- controlled trial. Lancet, 2002, 360, 7-22.
- Cannon, C.P., Blazing, M.A., Giugliano, R.P., McCagg, A., White, J.A., Theroux, P., et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med, 2015, 372, 2387-2397.
- Piepoli, M.F., Hoes, A.W., Agewall, S., Brotons, C., Catapano, A.L., Cooney, M-T., et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J, 2016, 37, 2315-2381.
- Sabatine, M.S., Giugliano, R.P., Wiviott, S.D., Raal, F.J., Blom, D.J., Robinson, J., et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med, 2015, 372, 1500-1509.
- Robinson, J.G., Farnier, M., Krempf, M., Bergeron, J., Luc, G., Averna, M., et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med, 2015, 372, 1489-1499.
- Sabatine, M.S., Giugliano, R.P., Keech, A.C., Honarpour, N., Wiviott, S.D., Murphy, S.A., et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med, 2017, 376, 1713-1722.
- Sabatine, M.S., Leiter, L.A., Wiviott, S.D., Giuglano, R.P., Deedwania, P., De Ferrari, G.M., et al. Cardiovascular safety and efficacy of the PCSK9 inhibitor evolocumab in patients with and without diabetes and the effect of evolocumab on glycaemia and risk of new-onset diabetes: a prespecified analysis of the FOURIER randomised controlled trial. Lancet Diabetes Endocrinol, 2017, 5, 941-950.
- Leiter, L.A., Cariou, B., Müller-Wieland, D., Colhoun, H.M., Del Prato, S., Tinahones, F.J., et al. Efficacy and safety of alirocumab in insulin- treated individuals with type 1 or type 2 diabetes and high cardiovascular risk: The ODYSSEY DM-INSULIN randomized trial. Diabetes Obes Metab, 2017, 19, 1781-1792.
- Müller-Wieland, D., Leiter, L.A., Cariou, B., Letierce, A., Colhoun, H.M., Del Prato, S., et al. Design and rationale of the ODYSSEY DM-DYSLIPIDEMIA trial: lipid-lowering efficacy of alirocumab in individuals with type 2 diabetes and mixed dyslipidemia at high cardiovascular risk. Cardiovasc Diabetol, 2017, 16: 70 (DOI 10.1186/s12933-017-0552-4)
- Ridker, P.M., Pradhan, A., MacFadyen, J.G., Libby, P., Glynn, R.J. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet, 2012, 380, 565-571.
- Sattar, N., Preiss, D., Murray, H.M., Welsh, P., Buckley, B.M., de Craen, A.J.M., et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet, 2010, 375, 735-742.
- Preiss, D., Seshasai, S.R., Welsh, P., Murphy, S.A., Ho, J.E., Waters, D.D., et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA, 2011, 305, 2556-2564.
- Schmidt, A.F., Swerdlow, D.I., Holmes, M.V., Patel, R.S., Fairhurst-Hunter, Z., Lyall, D.M., et al. PCSK9 genetic variants and risk of type 2 diabetes: a mendelian randomisation study. Lancet Diabetes Endocrinol, 2017, 5, 97-105.
- Blom, D.J., Koren, M.J., Roth, E., Monsalvo, M.L., Djedjos, C.S., Nelson, P., et al. Evaluation of the efficacy, safety and glycemic effects of evolocumab (AMG 145) in hypercholesterolaemic patients stratified by glycemic status and metabolic syndrome. Diabetes Obes Metab, 2017, 19, 98-107.
- Verbeek, R., Hovingh, G.K., Boekholdt, S.M. Non-high-density lipoprotein cholesterol: current status as cardiovascular marker. Curr Opin Lipidol, 2015, 26, 502-510.
- de Vries, M., Klop, B., Castro Cabezas, M. The use of the non-fasting lipid profile for lipid-lowering therapy in clinical practice- point of view. Atherosclerosis, 2014, 234, 473-475.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.