Lors du congrès de l'ESC à Munich, j'ai assisté à une intéressante session consacrée à l'évolution sur le plan du traitement de la sténose valvulaire aortique sévère. Le choix entre le remplacement valvulaire aortique chirurgical ou transcathéter est une cible évolutive, et les connaissances relatives à ces deux stratégies s'améliorent encore chaque année. Voici un résumé des exposés de quelques éminents experts en la matière.
La sténose valvulaire aortique est une affection qui touche surtout la population âgée. Le pronostic s'assombrit dès que des symptômes tels que dyspnée, angor ou syncope font leur apparition. La référence a longtemps été le remplacement chirurgical de la valve mais, suite au vieillissement de la population de patients, avec une augmentation importante des comorbidités, il est de plus en plus nécessaire de disposer de solutions moins invasives. Les chirurgiens ont développé de nouvelles valves et des techniques pour des interventions mini-invasives. Depuis 2004, on pratique également des remplacements valvulaires aortiques transcathéter (TAVI). Les premières études randomisées ont prouvé que cette technique est meilleure qu'un traitement médicamenteux chez les patients inopérables.1 Par après, le TAVI est également devenu une option valable pour les patients à haut risque ayant un score STS (Society of Thoracic Surgery) > 8 %.2 Aujourd'hui, les patients courant un risque intermédiaire et faible font également l'objet d'études. Dans l'étude PARTNER 2, plus de 2 000 patients ont été randomisés vers un remplacement chirurgical de la valve ou un TAVI au moyen d'une valve Sapien XR. Le critère d'évaluation primaire de mortalité ou d'AVC était identique dans les deux groupes. En cas d'abord transfémoral, on notait un avantage en faveur du TAVI. Par ailleurs, dans le groupe TAVI, on observait moins d'insuffisance rénale aiguë, d'hémorragies sévères ou de fibrillation auriculaire. En revanche, les patients qui avaient été opérés présentaient moins de complications vasculaires et moins de fuites paravalvulaires.3 Une sous-analyse de cette étude a été présentée lors du congrès de l'ESC à Munich. Ici, on a analysé les 509 patients (25,1 %) de la population totale de l'étude (2 039), qui avaient un antécédent de chirurgie cardiaque. Deux ans après l'intervention, la mortalité et les AVC étaient identiques, tant pour le TAVI que pour la chirurgie. Par contre, ces patients avaient présenté nettement plus d'hémorragies potentiellement mortelles, comparativement aux patients n'ayant pas subi de chirurgie cardiaque préalable.
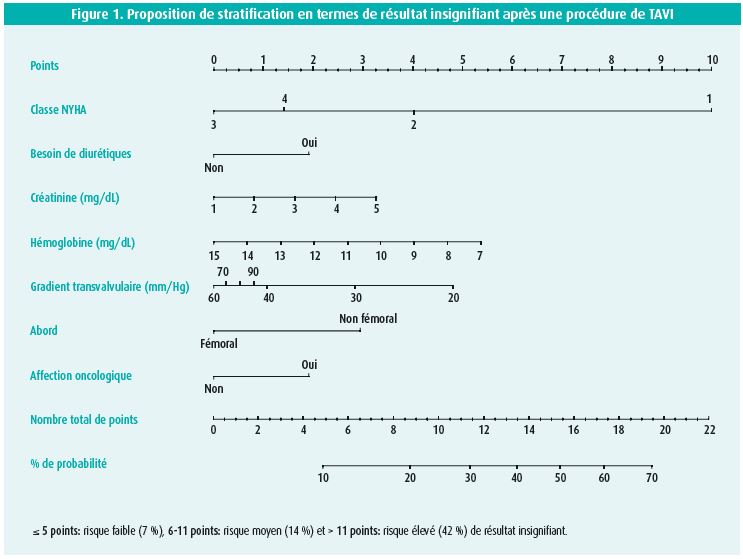
Oran Zusman, d'Israël, a présenté les résultats d'un registre national. Leur étude était motivée par le fait que la plupart des opérateurs se soucient surtout des complications périprocédurales. Toutefois, on oublie souvent qu'une procédure, même réalisée à la perfection, peut apporter un bénéfice insignifiant au patient, en ce qui concerne les symptômes, la morbidité ou la mortalité. Zusman et ses collègues ont analysé les paramètres de 2 188 patients et ont établi un score sur la base du gradient transvalvulaire moyen, de l'utilisation de diurétiques, de la classe fonctionnelle (NYHA) préopératoire, de l'hémoglobine, de la fonction rénale, de la voie d'abord du TAVI et des antécédents de problèmes oncologiques. Sur la base de ces paramètres, ils ont proposé 3 catégories de risque: risque faible (≤ 5 points, 7 % de risque de résultat insignifiant), risque moyen (6-11 points, 14 %) et risque élevé (> 11 points, 42 %). D'après eux, cette stratification peut aider à mieux évaluer le bénéfice de la procédure de TAVI (figure 1).
Chez quels patients le remplacement chirurgical de la valve aortique restet- il la référence?
Michael A. Borger - Leipzig, Allemagne
Bien que les résultats du TAVI ne cessent de s'améliorer, les résultats périopératoires d'un remplacement chirurgical de la valve aortique sont difficiles à battre. Chez les patients à risque faible (STS < 4 %) et intermédiaire, les résultats sont excellents.4 Ensuite, le coût d'un TAVI est élevé, en l'occurrence 20 000 euros par année de vie de qualité à partir de 80 ans.5 En outre, les complications périopératoires ne doivent pas être sous-estimées dans certains groupes de patients, comme les patients jeunes souffrant de bicuspidie aortique. Dans ce groupe, outre davantage d'anomalies coronaires, les calcifications sont plus marquées qu'en cas de valves tricuspides, et ce, en raison de l'exposition à la lésion, des années durant.6 Durant la procédure, ces calcifications massives peuvent entraîner une perforation du septum étant donné leur forme nasicorne. L'orifice non sphérique provoque à son tour davantage de fuites paravalvulaires et de conversion vers la chirurgie, et elle est associée à un taux de réussite moindre en cas de bicuspidie aortique. Enfin, on note également davantage d'anévrismes aortiques.7
Le nombre de complications avec le TAVI a toutefois bien diminué, avec la nouvelle génération de valves. On note moins de nécessité de deuxième implantation (de 24,4 % à 12,7 %), moins d'insuffisance valvulaire aortique (de 18,8 % à 4,2 %) et moins d'absence de fonctionnement fructueux (de 38,7 % à 18,9 %). Le nombre d'implantations de pacemaker reste toutefois un gros souci (17,5 % et 18,6 %).8 L'implantation d'un pacemaker est un élément prédictif indépendant de mortalité et d'hospitalisation.9 Le risque de fuite paravalvulaire en cas de TAVI est de 15,7 % à 1 an, versus 0,9 % avec la chirurgie, même si la nouvelle génération de valves TAVI donne vraisemblablement de meilleurs résultats.10 Enfin, les complications cérébrales dues à des micro-embolies après un TAVI constituent un dernier point important.11 Elles sont visibles sur les clichés d'IRM pondérés en diffusion et ont vraisemblablement davantage de répercussions chez un sujet de 55 ans que de 85 ans.
En ce qui concerne les résultats à long terme, outre les implantations de pacemaker, les complications vasculaires et les fuites paravalvulaires, la durabilité et les micro-thromboses des feuillets valvulaires jouent également un rôle.12 En cas de remplacement valvulaire chirurgical, on sait qu'il ne faudra pas réintervenir avant 17,6 ans, ce qui constitue une donnée valable pour les personnes de 18 à 60 ans, mais ne s'applique pas nécessairement au groupe des sujets de plus de 70 ans. La chirurgie a en effet également des inconvénients, comme une augmentation des cas d'insuffisance rénale aiguë et d'hémorragies majeures.
Les chiffres de mortalité pour la chirurgie versus le TAVI ne sont pas différents à court terme, mais au bout de deux ans de suivi, ils restent toujours en faveur de la chirurgie dans le groupe à faible risque. Ceci doit nous faire réfléchir avant de songer au TAVI chez tous les patients souffrant de sténose valvulaire aortique.13 Dans un certain nombre de cas, il est préférable que cette décision soit prise par une équipe cardiaque.
La décision de l'équipe cardiaque
John Chambers - Londres, Royaume-Uni
Les composantes-clés d'un centre des valves cardiaques consistent en une clinique des maladies valvulaires, l'expertise en imagerie cardiaque et une collaboration étroite avec les hôpitaux référents, la première ligne de soins et les services non cardiaques. Le monde politique et la collectivité demandent en outre que le traitement des données soit de plus en plus transparent. Cette large accessibilité des données en vue d'audits peut sérieusement booster la prise en charge standard.
Quel est le rôle de l'équipe cardiaque pluridisciplinaire en cas de sténose valvulaire aortique?
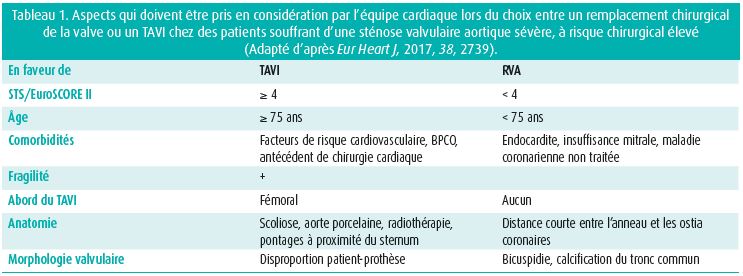
Selon les recommandations européennes, la décision de chirurgie est claire chez les patients symptomatiques ayant un gradient transvalvulaire élevé ou en cas de gradient faible, couplé à une diminution de la fonction ventriculaire gauche avec préservation de la réserve contractile. C'est quand il faut prendre des décisions moins linéaires que l'équipe cardiaque prouve toute sa valeur, comme en cas de de sténose valvulaire aortique à faible gradient et avec bas débit, avec préservation de la fraction d'éjection, et de sténose valvulaire aortique à faible gradient et avec bas débit, avec diminution de la fraction d'éjection, mais sans réserve contractile. Par ailleurs, le risque d'une intervention est parfois tellement élevé que tout type d'intervention devient futile. Chez les patients souffrant d'une sténose valvulaire aortique asymptomatique, il est également souvent utile de discuter du cas en équipe pluridisciplinaire.14 Sur ce plan, l'équipe prend toute une série de caractéristiques en considération (tableau 1). La discussion de l'équipe peut encore concerner le choix d'une valve mécanique ou biologique. étant donné la longévité réduite des valves aortiques biologiques, on opte pour une valve mécanique chez les patients de moins de 60 ans. Mais si les anticoagulants sont contre-indiqués, en cas de réintervention après une thrombose d'une valve mécanique ou à la demande du patient, on peut opter pour une valve biologique.
En résumé, l'équipe cardiaque doit réfléchir à ce qui suit:
- La sévérité de la sténose valvulaire aortique, en intégrant les données de l'échocardiographie, du CT scan, du BNP et de la clinique.
- La faisabilité de l'intervention selon les résultats locaux.
- Scores de risque: EuroSCORE II et facteurs non scorés.
- Possibilité de résultat insignifiant.
- Désirs du patient et éducation à la clinique des maladies valvulaires.
Conclusion
Il existe de très bonnes indications pour un TAVI, mais la chirurgie reste une excellente option pour les patients à risque faible et intermédiaire. Le TAVI est moins rentable que la chirurgie, surtout en termes de durabilité. L'anatomie joue pour le moment encore un rôle important, p. ex. en cas de bicuspidie aortique. Les effets à long terme de l'implantation d'un pacemaker, d'une fuite paravalvulaire, la durabilité et les micro-embolies doivent encore être étudiés plus en détail. Dans de nombreux cas, la décision de pratiquer un TAVI ou une chirurgie devra donc être prise par l'équipe cardiaque.
Références
- Kapadia, S.R., Leon, M.B., Makkar, R.R., Tuzcu, E.M., Svensson, L.G., Kodali, S., et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): a randomised controlled trial. Lancet, 2015, 385 (9986), 2485-2491.
- Smith, C.R., Leon, M.B., Mack, M.J., Miller, D.C., Moses, J.W., Svensson, L.G., et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med, 2011, 364 (23), 2187-2198.
- Leon, M.B., Smith, C.R., Mack, M.J., Makkar, R.R., Svensson, L.G., Kodali, S.K., et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med, 2016, 374 (17), 1609-1620.
- Thourani, V.H., Suri, R.M., Gunter, R.L., Sheng, S., O'Brien, S.M., Ailawadi, G., et al. Contemporary real-world outcomes of surgical aortic valve replacement in 141,905 low-risk, intermediate-risk, and high-risk patients. Ann Thor Surg, 2015, 99 (1), 55-61.
- Wu, Y., Jin, R., Gao, G., Grunkemeier, G.L., Starr, A. Cost-effectiveness of aortic valve replacement in the elderly: an introductory study. J Thor Cardiovasc Surg, 2007, 133 (3), 608-613.
- Lerer, P.K., Edwards, W.D. Coronary arterial anatomy in bicuspid aortic valve. Necropsy study of 100 hearts. Brit Heart J, 1981, 45 (2), 142-147.
- Kanjanahattakij, N., Horn, B., Vutthikraivit, W., Biso, S.M., Ziccardi, M.R., Lu, M.L.R., et al. Comparing outcomes after transcatheter aortic valve replacement in patients with stenotic bicuspid and tricuspid aortic valve: A systematic review and meta-analysis. Clin Cardiol, 2018, 41 (7), 896-902.
- Yoon, S.H., Schmidt, T., Bleiziffer, S., Schofer, N., Fiorina, C., Munoz-Garcia, A.J., et al. Transcatheter Aortic Valve Replacement in Pure Native Aortic Valve Regurgitation. J Am Coll Cardiol, 2017, 70 (22), 2752-2763.
- Aljabbary, T., Qiu, F., Masih, S., et al. Association of clinical and economic outcomes with permanent pacemaker implantation after transcatheter aortic valve replacement. JAMA Network Open, 2018, 1 (1), e180088.
- Thyregod, H.G., Steinbruchel, D.A., Ihlemann, N., Nissen, H., Kjeldsen, B.J., Petursson, P., et al. Transcatheter Versus Surgical Aortic Valve Replacement in Patients With Severe Aortic Valve Stenosis: 1-Year Results From the All-Comers NOTION Randomized Clinical Trial. J Am Coll Cardiol, 2015, 65 (20), 2184-294.
- Kahlert, P., Knipp, S.C., Schlamann, M., Thielmann, M., Al-Rashid, F., Weber, M., et al. Silent and apparent cerebral ischemia after percutaneous transfemoral aortic valve implantation: a diffusion-weighted magnetic resonance imaging study. Circulation, 2010, 121 (7), 870-878.
- Midha, P.A., Raghav, V., Sharma, R., Condado, J.F., Okafor, I.U., Rami, T., et al. The Fluid Mechanics of Transcatheter Heart Valve Leaflet Thrombosis in the Neosinus. Circulation, 2017, 136 (17), 1598-1609.
- Witberg, G., Lador, A., Yahav, D., Kornowski, R. Transcatheter versus surgical aortic valve replacement in patients at low surgical risk: A meta-analysis of randomized trials and propensity score matched observational studies. Catheteriz Cardiovasc Interv, 2018, 92 (2), 408-416.
- Baumgartner, H., Falk, V., Bax, J.J., De Bonis, M., Hamm, C., Holm, P.J., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2017, 38 (36), 2739-2791.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.