Le vendredi 8 février, le BIWAC et le BWGCVN organisaient conjointement un symposium intitulé 'Acute Coronary Syndrome without significant coronary lesions'.
La session a débuté par une présentation en duo du Dr Hannah Schaubroeck, cardiologue-intensiviste à l'UZ Gent, et de Filip Haegdorens, infirmier en soins intensifs à l'UA et l'UZ Antwerpen, sur la détection et la prise en charge précoces de complications au service des soins intensifs en cardiologie (intensive cardiac care unit ou ICCU). Le Pr Alexandre Persu (UCL Saint-Luc Bruxelles) a ensuite embrayé sur la présentation d'un guide pratique pour les dissections spontanées des artères coronaires (SCAD). Clinicien et chercheur de renom, le Pr David Adlam (université de Leicester, Royaume-Uni), a conclu avec un état des lieux de l'infarctus du myocarde sans obstruction d'une artère coronaire (MINOCA).
Early detection and management of complications in the ICCU
Le coup d'envoi de cette session est donné par le duo interdisciplinaire composé du Dr Hannah Schaubroeck et de
Filip Haegdorens, apportant un double éclairage sur la détection précoce d'une détérioration de l'état de santé et des complications au sein des ICCU, du point de vue médical et infirmier. Au départ d'un cas clinique, ils démontrent l'importance d'une évaluation clinique poussée, continue et systématique du patient en soins intensifs. Une évaluation dans laquelle le personnel infirmier a un rôle important à jouer en tant qu'observateur, évaluateur et messager envers l'équipe médicale. La détection précoce d'une dégradation subite exige du personnel infirmier qu'il connaisse bien la pathologie, qu'il soit capable de réaliser une évaluation clinique, qu'il intègre les différents paramètres et qu'il confronte ces constatations à la stratégie thérapeutique préconisée. La formation de base et la formation continue d'infirmiers spécialisés en ICCU revêtent une importance essentielle. La littérature scientifique fait souvent référence à l'emploi de systèmes d'évaluation objective afin de pouvoir détecter toute détérioration de l'état d'un patient, conscient ou inconscient, au sein du service de soins intensifs en cardiologie. Mais la valeur prédictive de tels 'early warning systems' n'est pas encore suffisamment prouvée. De l'avis des deux intervenants, l'élément le plus important dans la détection précoce du déclin du patient ICCU est une bonne communication entre les infirmiers et les médecins. Le plus efficace reste le partage rapide d'informations précises et succinctes.
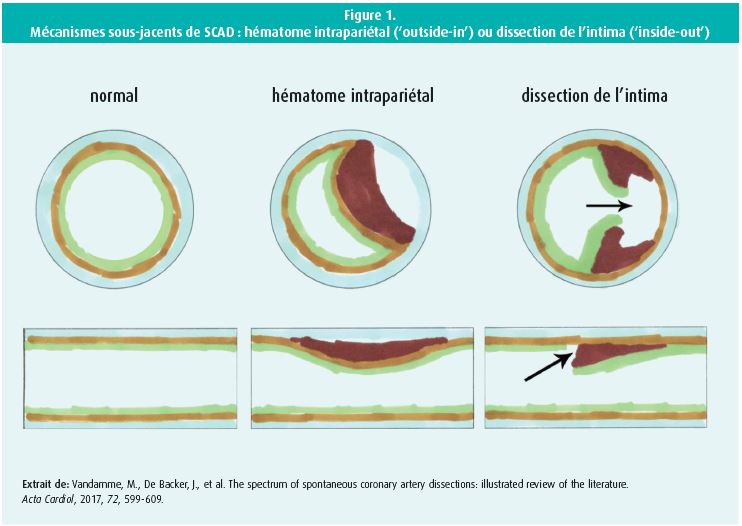
La parole est ensuite donnée au Pr Alexandre Persu (UCL St.-Luc) pour son exposé intitulé 'Spontaneous coronary artery dissections, a practical guide'1. Une dissection spontanée de l'artère coronaire (SCAD) est une rupture soudaine de l'intima, qui n'est liée ni à un traumatisme ni à une athérosclérose, et qui entraîne une compression de la lumière de l'artère coronaire. Deux mécanismes sont décrits : 'inside-out', une dissection de l'intima avec thrombose aiguë de la lumière ; et 'outside-in', la rupture d'un microvaisseau dans la paroi vasculaire avec formation d'un hématome et compression externe de la lumière (figure 1).

L'affection touche le plus souvent les femmes jeunes (moins de 50 ans) présentant un syndrome coronarien aigu. Dans ce groupe, la prévalence de SCAD oscille entre 20 et 30 %.
à l'angiographie, on distingue plusieurs sous-types de SCAD : dissection focale, rétrécissement diffus et sténose tubulaire focale. Une échographie intravasculaire (IVUS) ou une tomographie par cohérence optique (OCT) peut fournir un diagnostic de certitude, mais comporte aussi un risque d'occlusion vasculaire ou de dissection hydraulique.
Les causes de SCAD ne sont que partiellement connues. Dans 30 % des cas, il est question d'une dysplasie fibromusculaire multi-artérielle (FMD), 10 % des cas sont déclenchés par des facteurs hormonaux, pendant la grossesse et le péripartum ('pregnancy associated' SCAD ou P-SCAD) et, dans 5 % des cas, l'origine se trouve dans une affection systémique et/ou une maladie des tissus conjonctifs. Mais il n'y a pas de cause secondaire chez 50 % des patients. Une revascularisation chirurgicale ou percutanée immédiate est déconseillée tant qu'il reste un flux coronaire (TIMI 3 ou 2). La plupart du temps, une SCAD se résout spontanément avec restauration complète du vaisseau et du flux sanguin. Il est également déconseillé d'instaurer une bithérapie antiplaquettaire par acide acétylsalicylique et un inhibiteur de P2Y12 (clopidogrel ou ticagrélor). En revanche, le risque de récidive diminue avec un traitement bêtabloquant et une prise en charge adéquate de la tension artérielle. Chez le patient victime d'une SCAD, il est important de chercher une éventuelle dysplasie fibromusculaire dans d'autres réseaux vasculaires (cérébral, rénal et iliaque). Tous les patients avec SCAD doivent passer une angiographie ou un angioscanner du cerveau jusqu'au pelvis. Des tortuosités des artères coronaires sont aussi souvent observées et constituent un facteur de risque de récidive. Il existe possiblement un facteur héréditaire, étant donné qu'une association a été décrite avec le locus génétique PHACTR1/EDN1, également associé à la migraine, la FMD et la dissection artérielle cervicale. Il existe des registres européens des FMD et des SCAD, comme le Beat SCAD. Et la Belgique a aussi son registre FMD (www.fmd-be.be).
Le dernier intervenant à entrer en piste est le Pr David Adlam, professeur de cardiologie à l'université de Leicester (Royaume-Uni). Son exposé dresse un état des lieux du 'MINOCA of myocardial infarction with non-obstructive coronary arteries'2.
Le MINOCA est un diagnostic de travail chez les patients présentant un tableau clinique d'infarctus aigu du myocarde, incluant une élévation/baisse dynamique de la troponine, mais sans sténoses coronariennes > 50 % à la coronarographie. Les causes du MINOCA sont très diverses. Il convient de distinguer les causes de nature coronaire, myocardique et extracardiaque. Chez la majorité des patients (40 %), il s'agit malgré tout d'un infarctus du myocarde de type 1, avec rupture ou érosion d'une plaque d'athérome dans les coronaires et athérothrombose. D'autres possibilités sont : spasmes coronariens, thrombo-embolie (14 %) due à des troubles de la coagulation ou à une fibrillation auriculaire, dissection spontanée de l'artère coronaire (SCAD), syndrome de Takotsubo, myocardite (33 %) ou infarctus du myocarde de type 2.
Dans la mise au point diagnostique du MINOCA (figure 2), il convient avant tout - en cas de suspicion clinique - d'exclure une embolie pulmonaire aiguë au moyen d'un angioscanner thoracique, puis de réaliser une IRM cardiaque de rehaussement tardif avec injection de gadolinium pour différencier une cause coronaire ischémique avec rehaussement endocardique caractéristique du myocarde et une pathologie myocardique non ischémique. Il est important d'établir un diagnostic étiologique correct du MINOCA, car le traitement et le pronostic varient en fonction de la cause.
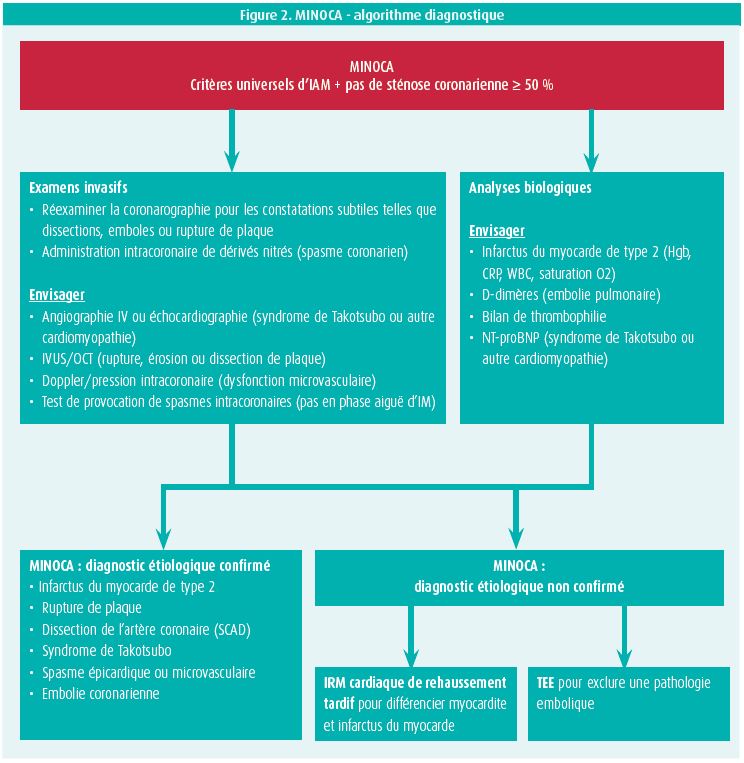
Une pathologie coronarienne ischémique requiert ainsi une bithérapie antiplaquettaire et un traitement par statines, lesquels sont totalement contre-indiqués si nous sommes face à une SCAD. Dans le cas d'une pathologie thrombo-embolique, les anticoagulants oraux seront nécessaires.
En ce qui concerne le syndrome de Takotsubo, la Mayo Clinic a établi des critères diagnostiques spécifiques. Il doit être question de troubles transitoires dans la contractilité ventriculaire gauche régionale, en dehors de la zone d'irrigation d'une coronaire, d'absence de sténoses coronariennes > 50 %, de nouvelles modifications du segment ST à l'ECG et de troubles dynamiques de la troponine et de la NT-proBNP. L'éventualité d'un phéochromocytome ou d'une myocardite doit être exclue.
Le patient-type présentant un syndrome de Takotsubo est une femme âgée de plus de 70 ans et le facteur déclenchant est généralement un grave traumatisme émotionnel, s'accompagnant d'une libération aiguë de catécholamines au niveau des glandes surrénales, mais aussi dans les terminaisons des nerfs sympathiques, ce qui entraîne une dysfonction microvasculaire et une sidération myocardique.
En cas de myocardite, l'IRM cardiaque peut devoir être complétée d'une biopsie de l'endomyocarde. Celle-ci est particulièrement importante chez les patients avec choc cardiogénique afin, par exemple, d'identifier une éventuelle myocardite à cellules géantes, qui doit être traitée par immunosuppresseurs.
Dans le cas d'un infarctus du myocarde de type 2, les causes extracardiaques doivent être prises en charge et un traitement par acide acétylsalicylique et bêtabloquant doit être instauré.
En résumé, le MINOCA est une entité passionnante et très hétérogène de la cardiologie aiguë, qui peut représenter un véritable défi diagnostique. Aucun traitement curatif n'est toutefois possible dans bon nombre de cas.
Références
- Vandamme, M., De Backer, J., et al. The spectrum of spontaneous coronary artery dissections: illustrated review of the literature. Acta Cardiol, 2017, 72, 599-609.
- Agewall, S., Beltrame, J.F., Reynolds, H.R. et al. ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J, 2017, 38, 143-153.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.