Le développement de nouveaux traitements du cancer a permis d'améliorer la survie des patients cancéreux, ce qui explique que le cancer est souvent devenu une maladie chronique. Malheureusement, les patients ont également davantage de problèmes de santé liés au traitement. Les effets secondaires cardiovasculaires sont notamment très fréquents dans ce groupe de patients. Tant la chimiothérapie que l'hormonothérapie, la radiothérapie et les nouvelles thérapies plus ciblées comme l'immunothérapie sont associées à des complications cardiaques et vasculaires multiples, et souvent mal comprises.1 En outre, ces complications se présentent parfois des mois, voire des années après le traitement, ce qui constitue une difficulté supplémentaire.
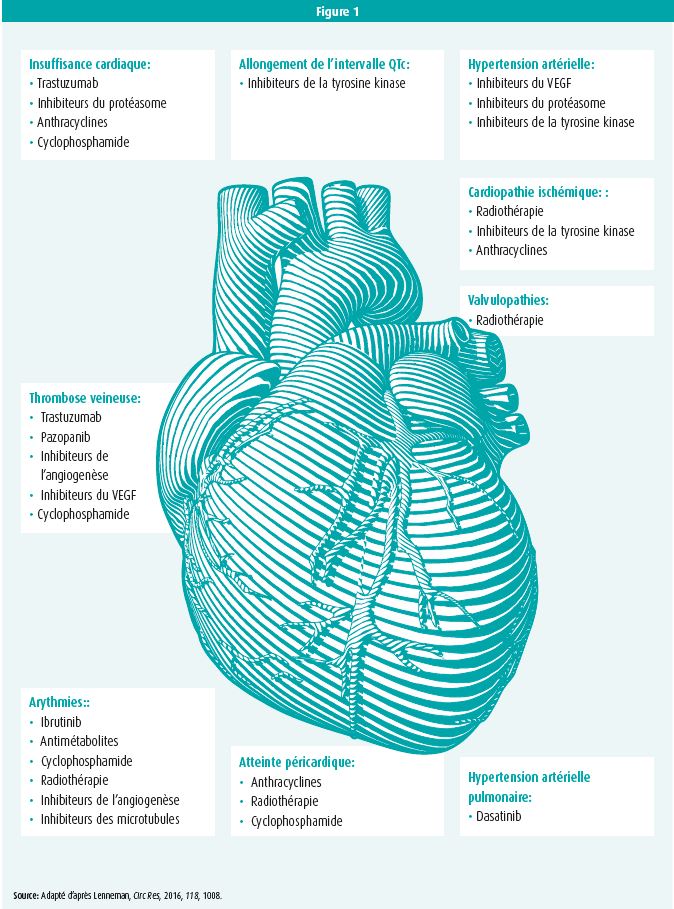
L'effet indésirable le plus connu est une dysfonction ventriculaire gauche due à la chimiothérapie. Ce risque est surtout connu avec les anthracyclines, les inhibiteurs du protéasome et de la tyrosine kinase, les inhibiteurs du checkpoint immunitaire et les thérapies ciblées comme le trastuzumab.2 La cardio-oncologie est toutefois une discipline nettement plus large: n'importe quelle affection cardiaque peut constituer un effet secondaire d'un traitement anticancéreux (figure 1). L'intérêt des organisations professionnelles nationales et internationales vis-à-vis de la cardio-oncologie semble dès lors opportun et justifié.
La mortalité cardiovasculaire du patient cancéreux
La mortalité cardiovasculaire des patients cancéreux est deux à six fois plus élevée, comparativement à la population générale.3 On observe un pic précoce au cours de la première année suivant le traitement du cancer, probablement dû à une cardiopathie préexistante, à la toxicité du traitement et à la cardiotoxicité de la tumeur elle-même.4 Par la suite, on observe une phase chronique, au cours de laquelle la mortalité cardiovasculaire augmente au fil des ans. Le risque de décès cardiovasculaire varie selon les différents types de cancer.3 La valeur ajoutée de la cardio-oncologie consiste en une prise en charge personnalisée, basée sur les caractéristiques spécifiques du patient et de la tumeur.
Cardiotoxicité induite par la chimiothérapie
Classiquement, la cardiotoxicité due à la chimiothérapie est classée de manière binaire: lésion (type 1, irréversible) versus dysfonction (type 2, réversible).2 Toutefois, des données récentes indiquent que la distinction entre ces 2 catégories s'estompe: un traitement adéquat de l'insuffisance cardiaque peut améliorer une dysfonction ventriculaire gauche en cas de cardiotoxicité de type 1, tandis que l'IRM établit clairement qu'une atteinte structurelle sous la forme de cicatrices se produit également en cas de cardiotoxicité de type 2.2, 5
La cardiotoxicité est définie comme une réduction de la FEVG de 5 % avec une clinique d'insuffisance cardiaque ou une réduction de 10 % chez un patient asymptomatique.
La toxicité des anthracyclines est la cardiotoxicité de type 1 la plus connue. à cet égard, on établit une distinction entre une forme aiguë et une forme chronique.2 La forme aiguë se présente comme une cardiomyopathie toxique pendant le traitement; la forme chronique, plus fréquente, se manifeste comme une détérioration de la FEVG après la fin du traitement (parfois même après plusieurs années).
La cardiotoxicité de type 2 correspond à une diminution réversible de la FEVG, moyennant l'arrêt du traitement. Classiquement, le trastuzumab est associé à une cardiotoxicité de type 2.
Cardiotoxicité induite par la radiothérapie
La cardiotoxicité induite par la radiothérapie se produit lorsque le coeur se trouve dans la zone irradiée. Il n'existe d'ailleurs pas de dose de rayons sûre pour le coeur. La cardiotoxicité induite par la radiothérapie est une complication fréquente, surtout lors de l'irradiation médiastinale en cas de lymphomes et de l'irradiation thoracique en cas de cancer du sein, et elle se manifeste sous la forme d'une maladie coronarienne, d'une maladie valvulaire, d'insuffisance cardiaque, de troubles du rythme et de la conduction.2, 6, 7 Les évolutions récentes des techniques de radiothérapie réduisent l'irradiation du coeur. Cependant, comme les effets cliniques de la radiothérapie sur le coeur peuvent se manifester jusqu'à 30 ans après le traitement initial, nous continuerons à être confrontés à cette pathologie dans l'avenir proche.
Cardiotoxicité des thérapies ciblées
Les thérapies ciblées (targeted therapies) agissent sur une voie essentielle dans le métabolisme tumoral. L'imatinib (un inhibiteur de l'ABL) en est l'exemple typique, et par ailleurs découvert en premier lieu: il a transformé la leucémie myéloïde d'une maladie mortelle en maladie chronique. Les inhibiteurs de l'ABL plus récents, comme le ponatinib, provoquent de l'hypertension et des complications vasculaires telles qu'un infarctus myocardique, des vasculopathies périphériques et des accidents vasculaires cérébraux.8 Les inhibiteurs du VEGF sont également associés à de l'hypertension et aux complications vasculaires déjà citées. Les derniers arrivés dans la catégorie des thérapies ciblées sont les inhibiteurs du checkpoint immunitaire, qui peuvent être différenciés en anti-CTLA-4 (comme l'ipilimumab) et en anti-PD1 (comme le nivolumab). Les complications rapportées sont une péricardite, une myocardite et une vasculite (avec des syndromes coronariens aigus). Des complications cardiovasculaires sont également décrites lors de l'utilisation de cellules CAR-T (cellules T modifiées avec un récepteur antigénique chimérique), la technique la plus récente pour inciter le système immunitaire à attaquer les cellules cancéreuses. Ces complications sont l'occurrence d'un allongement de l'intervalle QT, une hyperperméabilité vasculaire et une réduction de la fonction ventriculaire gauche.
Prévention des effets secondaires cardiovasculaires lors du traitement d'un cancer
Dans le domaine de la cardio-oncologie, on prête une grande attention à la prévention de la cardiotoxicité, afin d'éviter les maladies cardiovasculaires et les décès chez les patients atteints d'un cancer. à cet égard, une stratification adéquate du risque et un traitement médicamenteux efficace sont importants. Le modèle de risque de la Mayo Clinic, fréquemment utilisé, comprend des facteurs liés aux médicaments et aux patients (antécédents cardiaques, hypertension, diabète, vasculopathie périphérique, âge, sexe...) pour formuler un avis au sujet de la fréquence de suivi et du traitement.2 Toutefois, il est important d'adapter ce modèle à la situation belge dans un avenir proche. Plusieurs petites études randomisées ont montré une amélioration significative de la fonction ventriculaire gauche si on administre des inhibiteurs de l'enzyme de conversion de l'angiotensine (IECs) ou des bêtabloquants avant une chimiothérapie à base d'anthracyclines. Le gain limité au niveau de la fraction d'éjection ventriculaire gauche - une différence de quelques pourcents semble statistiquement significative, mais non pertinente cliniquement - semble insuffisant pour administrer des IECs ou des bêtabloquants à tous les patients, mais suffisant pour rationaliser les traitements antihypertenseurs existants.
La cardio-oncologie offre une prise en charge intégrée des maladies cardiovasculaires chez les patients cancéreux
La cardio-oncologie vise à préparer adéquatement (prévention), accompagner (détection) et traiter rapidement les patients avant, pendant et après leur traitement anticancéreux. à cet égard, une bonne collaboration entre oncologues/ hématologues et cardiologues est essentielle. Ainsi, la cardio-oncologie répond aux besoins d'une prise en charge intégrée des complications cardiovasculaires lors des traitements anticancéreux.
Références
- Zamorano, J.L., Lancellotti, P., Muñoz, D.R., Aboyans, V., Asteggiano, R., Galderisi, M. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J, 2016, 37 (36), 2768-2801.
- Herrmann, J., Lerman, A., Sandhu, N.P., Villarraga, H.R., Mulvagh, S.L., Kohli, M. Evaluation and Management of Patients With Heart Disease and Cancer: Cardio-Oncology. Mayo Clinic Proceedings [Internet]. 2014, 89 (9), 1287-1306. Available from: http://dx.doi. org/10.1016/j.mayocp.2014.05.013
- Sturgeon, K.M., Deng, L., Bluethmann, S.M., Zhou, S., Trifiletti, D.M., Jiang, C., et al. A population-based study of cardiovascular disease mortality risk in US cancer patients. Eur Heart J, 2019, 1-9.
- Herrmann, J. From trends to transformation : where cardio-oncology is to make a difference. Eur Heart J, 2019, 40 (48), 3898-3900.
- Curigliano, G., Cardinale, D., Suter, T., Plataniotis, G., de Azambuja, E., Sandri, M.T., et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO clinical practice guidelines. Ann Oncol, 2012, 23 (suppl. 7: vii155-66.).
- Darby, S.C., Ewertz, M., McGale, P., Bennet, A.M., Blom-Goldman, U., Brnønum, D., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med, 2013, 368 (11), 987-998.
- van der Pal HJ, van Dalen EC, van Delden E, van Dijk IW, Kok WE, Geskus RB, et al. High risk of symptomatic cardiac events in childhood cancer survivors. J Clin Oncol, 2012, 30 (13), 1429-1437.
- Chang, H., Okwuosa, T.M., Scarabelli, T., Moudgil, R., Yeh, E.T.H. Cardiovascular Complications of Cancer Therapy. J Am Coll Cardiol, 2017, 70 (20), 2536-2551 and 2552-2565.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.