Door de ontwikkeling van nieuwe kankertherapieën is de overleving van kankerpatiënten verbeterd en is kanker vaak een chronische ziekte geworden. Helaas ervaren patiënten ook meer behandelingsgerelateerde gezondheidsproblemen. Met name cardiovasculaire nevenwerkingen zijn zeer frequent in deze patiëntengroep. Zowel chemotherapie, hormoontherapie, radiotherapie alsook nieuwe, meer gerichte therapieën zoals immuuntherapie zijn gelinkt aan multipele en vaak onvolledig begrepen cardiale en vasculaire complicaties.1 Een bijkomende moeilijkheid is dat deze soms maanden tot jaren na de behandeling voor het eerst optreden.
De meest bekende nevenwerking is linkerventrikeldisfunctie door chemotherapie. Het risico daarop is vooral bekend bij anthracyclines, proteasoom en tyrosinekinase-inhibitoren, immuun-checkpointinhibitoren en gerichte therapieën zoals trastuzumab.2 Cardio-oncologie is evenwel een aanzienlijk bredere discipline: elke cardiale aandoening kan zich als neveneffect van een kankerbehandeling voordoen (figuur 1). De recent toegenomen interesse van nationale en internationale professionele organisaties voor cardio-oncologie lijkt daarom tijdig en terecht.
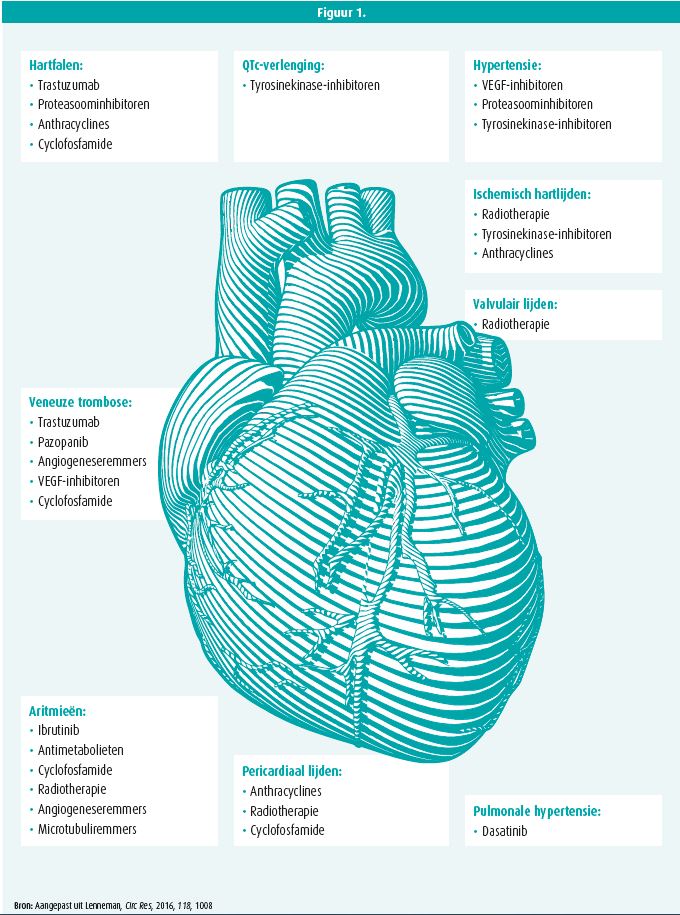
Cardiovasculaire mortaliteit van de kankerpatiënt
De cardiovasculaire mortaliteit bij kankerpatiënten is twee tot zes keer verhoogd ten opzichte van de algemene populatie.3 Er is een vroege piek in het eerste jaar na de kankerbehandeling, vermoedelijk veroorzaakt door voorafbestaand hartlijden, de toxiciteit van de behandeling en de cardiotoxiciteit van de tumor zelf.4 Nadien volgt een chronische fase, waarbij de cardiovasculaire mortaliteit over de jaren heen toeneemt. Het risico op cardiovasculair overlijden verschilt tussen de verschillende kankertypes.3 De meerwaarde van cardio-oncologie bestaat uit een gepersonaliseerde aanpak gebaseerd op patiëntspecifieke en tumorspecifieke kenmerken.
Chemotherapiegeïnduceerde cardiotoxiciteit
Klassiek wordt cardiotoxiciteit door chemotherapie binair verdeeld: schade (type 1, irreversibel) versus disfunctie (type 2, reversibel).2 Recente gegevens tonen echter dat het onderscheid tussen deze twee categorieën vervaagt: adequate hartfalentherapie kan voor een verbetering van de linkerventrikeldisfunctie zorgen bij type 1-cardiotoxiciteit, terwijl kernspintomografie duidelijk maakt dat structurele aantasting onder de vorm van littekenvorming ook optreedt bij type 2-cardiotoxiciteit.2, 5
Cardiotoxiciteit wordt gedefinieerd als een LVEF-reductie van 5 % met een kliniek van hartfalen of een reductie van 10 % bij een asymptomatische patiënt.
Anthracyclinetoxiciteit is het meest bekende type van type 1-cardiotoxiciteit waarbij een onderscheid gemaakt wordt tussen een acute en een chronische vorm.2 De acute vorm presenteert zich als een toxische cardiomyopathie tijdens de behandeling; de chronische vorm is meer frequent en manifesteert zich als een achteruitgang van de LVEF na het beëindigen van de therapie (soms zelfs meerdere jaren nadien).
Type 2-cardiotoxiciteit staat voor een reversibele daling van LVEF mits stopzetten van de therapie. Trastuzumab wordt klassiek geassocieerd met type 2-cardiotoxiciteit.
Radiotherapiegeïnduceerde cardiotoxiciteit
Radiotherapiegeïnduceerde cardiotoxiciteit ontstaat wanneer het hart in het bestralingsveld ligt. Er bestaat overigens geen veilige stralingsdosis voor het hart. Radiotherapiegeïnduceerde cardiotoxiciteit is vooral bij mediastinale bestraling van lymfomen en thoracale bestraling bij borstkanker een frequente complicatie en manifesteert zich onder de vorm van coronairlijden, kleplijden, hartfalen, ritme- en geleidingsstoornissen.2, 6, 7 Recente evoluties in radiotherapeutische technieken verminderen de straling op het hart. Echter, aangezien de klinische effecten van radiotherapie op het hart tot 30 jaar na de initiële behandeling kunnen optreden, zullen we in de nabije toekomst blijvend geconfronteerd worden met deze pathologie.
Cardiotoxiciteit door gerichte therapieën
Gerichte therapieën (targeted therapies) grijpen in op een essentiële pathway in het tumormetabolisme. Imatinib (een ABL-inhibitor) is een typisch (en eerst ontdekt) voorbeeld en transformeerde myeloïde leukemie van een fatale naar een chronische ziekte. Nieuwere ABL-inhibitoren zoals ponatinib veroorzaken hypertensie en vasculaire complicaties zoals myocardinfarct, perifeer vaatlijden en cerebrovasculaire accidenten.8 Ook VEGF-inhibitoren zijn geassocieerd met hypertensie en de reeds genoemde vasculaire complicaties. De nieuwste spelers in de categorie van gerichte therapieën zijn de immuun-checkpointinhibitoren, verder te differentiëren in CTLA4-inhibitoren (zoals ipilimumab) en PD1-inhibitoren (zoals nivolumab). Gerapporteerde complicaties zijn pericarditis, myocarditis en vasculitis (met acute coronaire syndromen). Ook bij gebruik van CAR-T-cellen (chimeric antigen receptor-modified T-cellen), de meest recente techniek om het immuunsysteem in te schakelen om kankercellen aan te vallen, zijn cardiovasculaire complicaties beschreven, met name QT-verlenging, vasculair lek en vermindering van de linkerventrikelfunctie.
Preventie van cardiovasculaire nevenwerkingen tijdens kankerbehandeling
Binnen het domein van cardio-oncologie gaat veel aandacht naar preventie van cardiotoxiciteit om cardiovasculair lijden en sterfte bij kankerpatiënten te voorkomen. Adequate risicostratificatie en efficiënte medicamenteuze therapie zijn daarbij belangrijk. Het frequent gebruikte risicomodel van de Mayo Clinic hanteert medicatiegerelateerde en patiëntgerelateerde factoren (cardiale voorgeschiedenis, hypertensie, diabetes, perifeer vaatlijden, leeftijd, geslacht …) om een advies te formuleren voor opvolgfrequentie en therapie.2 Het is evenwel belangrijk om in de nabije toekomst dat model aan te passen aan de Belgische situatie. Meerdere kleine gerandomiseerde studies toonden een significant betere linkerventrikelfunctie indien behandeling met inhibitoren van angiotensineconversie-enzyme (ACE) of betalyse voorafgaat aan anthracycline-houdende chemotherapie. De beperkte winst in linkerventrikelejectiefractie - enkele percenten verschil lijkt statistisch significant maar niet klinisch relevant - lijkt onvoldoende om elke patiënt te starten op ACE-inhibitoren of betalyse, maar voldoende om bestaande antihypertensieve behandelingen te rationaliseren.
Cardio-oncologie als geïntegreerde aanpak van cardiovasculaire lijden bij kankerpatiënten
Cardio-oncologie streeft ernaar (risico) patiënten vóór, tijdens en na hun kankerbehandeling adequaat voor te bereiden (preventie), te begeleiden (screening) en prompt te behandelen. Een goede samenwerking tussen oncologen/hematologen en cardiologen is daarbij essentieel. Aldus biedt cardio-oncologie een antwoord op de nood aan geïntegreerde zorg voor cardiovasculaire complicaties bij kankerbehandelingen.
Referenties
- Zamorano, J.L., Lancellotti, P., Muñoz, D.R., Aboyans, V., Asteggiano, R., Galderisi, M. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J, 2016, 37 (36), 2768-2801.
- Herrmann, J., Lerman, A., Sandhu, N.P., Villarraga, H.R., Mulvagh, S.L., Kohli, M. Evaluation and Management of Patients With Heart Disease and Cancer: Cardio-Oncology. Mayo Clinic Proceedings [Internet]. 2014, 89 (9), 1287-1306. Available from: http://dx.doi. org/10.1016/j.mayocp.2014.05.013
- Sturgeon, K.M., Deng, L., Bluethmann, S.M., Zhou, S., Trifiletti, D.M., Jiang, C., et al. A population-based study of cardiovascular disease mortality risk in US cancer patients. Eur Heart J, 2019, 1-9.
- Herrmann, J. From trends to transformation : where cardio-oncology is to make a difference. Eur Heart J, 2019, 40 (48), 3898-3900.
- Curigliano, G., Cardinale, D., Suter, T., Plataniotis, G., de Azambuja, E., Sandri, M.T., et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO clinical practice guidelines. Ann Oncol, 2012, 23 (suppl. 7: vii155-66.).
- Darby, S.C., Ewertz, M., McGale, P., Bennet, A.M., Blom-Goldman, U., Brnønum, D., et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med, 2013, 368 (11), 987-998.
- van der Pal HJ, van Dalen EC, van Delden E, van Dijk IW, Kok WE, Geskus RB, et al. High risk of symptomatic cardiac events in childhood cancer survivors. J Clin Oncol, 2012, 30 (13), 1429-1437.
- Chang, H., Okwuosa, T.M., Scarabelli, T., Moudgil, R., Yeh, E.T.H. Cardiovascular Complications of Cancer Therapy. J Am Coll Cardiol, 2017, 70 (20), 2536-2551 and 2552-2565.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.