Cas clinique
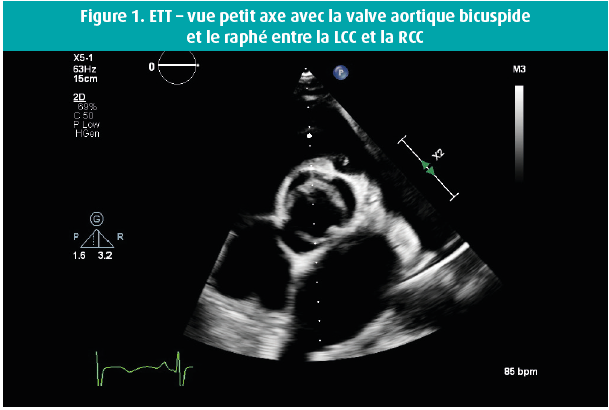
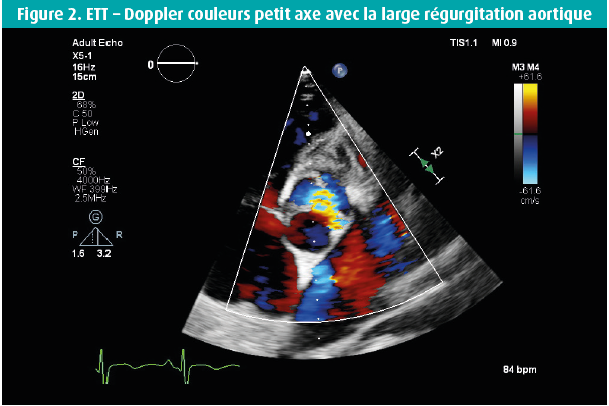
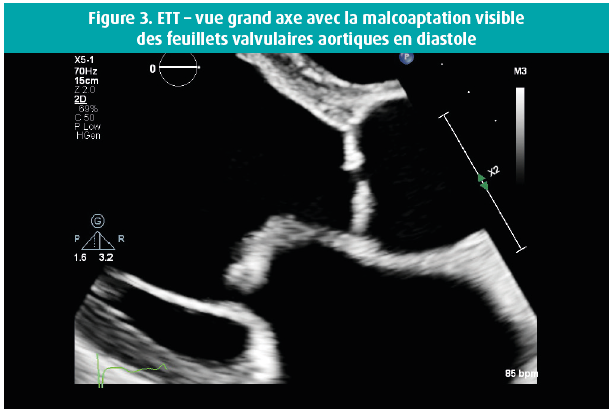
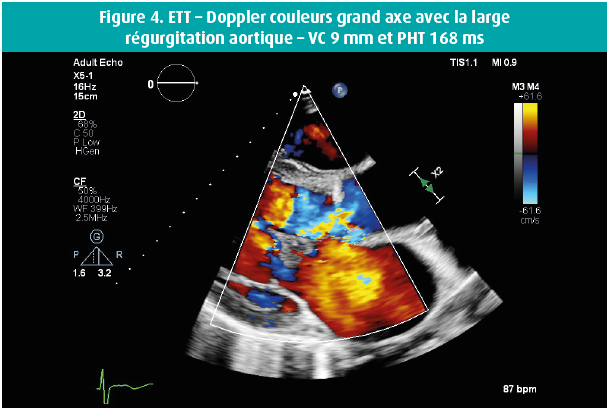
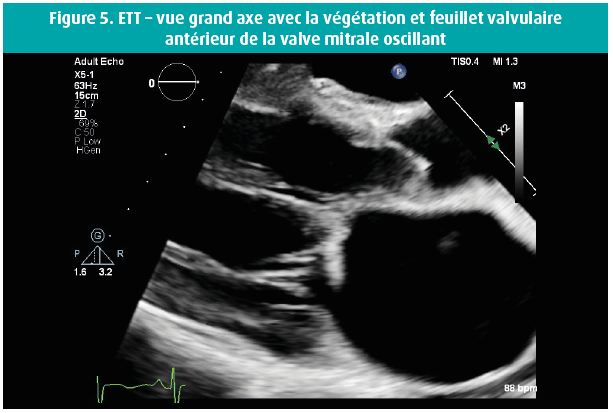
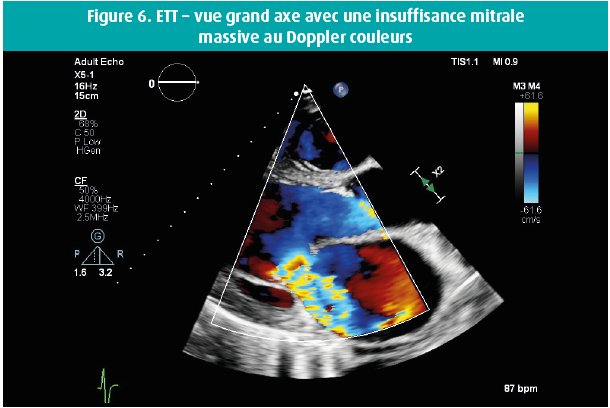
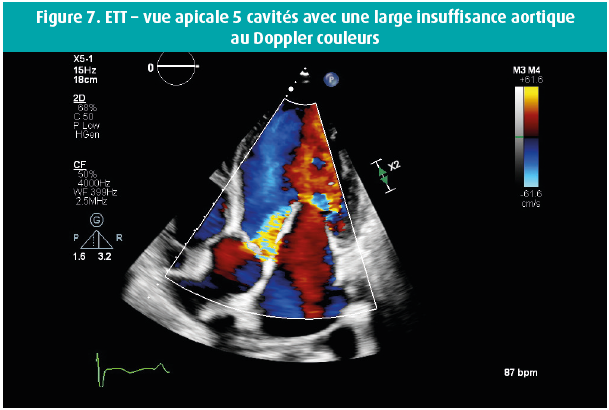
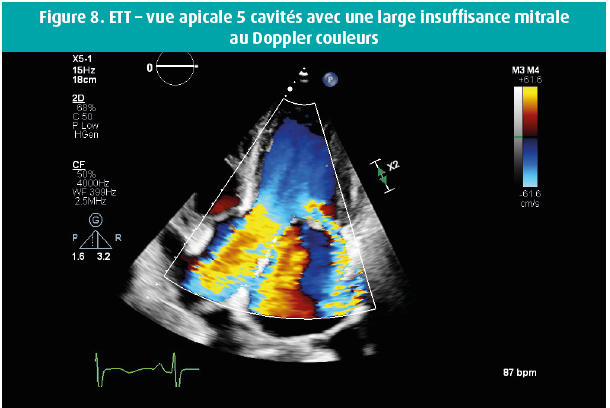
Voici quelques semaines, un homme de 42 ans s'est présenté au service des Urgences en raison d'une dyspnée progressivement croissante au cours des 14 jours précédents, et de l'apparition récente d'un oedème malléolaire. Dans ses antécédents, retenons une bicuspidie aortique et, en 2016, un diagnostic d'adénocarcinome mucineux moyennement différencié de l'oesophage distal, de stade cT3 cN0 cM0, traité par oesophago-gastrectomie partielle et radio-chimiothérapie adjuvante. En raison d'un rétrécissement oesophagien anastomotique, on avait dû pratiquer une dilatation endoscopique à 2 reprises. Un Port-à-Cath (PAC) était resté en place, et rincé toutes les 6 semaines. L'examen physique de ce patient afébrile a révélé une tension artérielle à 120/50 mmHg, des jugulaires turgescentes et un souffle systolo-diastolique au niveau du foyer aortique, ainsi qu'un souffle systolique apical clair, irradiant vers l'aisselle gauche. Les examens de laboratoire ont montré une leucocytose (GB 16 380/μl), une CRP à 59 mg/l et un NTproBNP à 21 391 ng/l. Les hémocultures sont toutes revenues positives dans les 24 h pour un Staphylococcus epidermidis, suite à quoi on a instauré un traitement par flucloxacilline 3 x 4 grammes/24 h. Le PAC a été enlevé, et il montrait une colonisation par un Staphylococcus epidermidis. Le jour suivant le retrait du PAC, les hémocultures étaient toujours positives, mais elles se sont négativées par après. L'échocardiographie transthoracique (figures 1-8) a montré un ventricule gauche dilaté, avec un diamètre télédiastolique à 73 mm, un diamètre télésystolique à 52 mm et une fraction d'éjection normale-basse à 54 %, une valve aortique bicuspide avec un raphé et un épaississement des extrémités des feuillets valvulaires, mais sans végétations, et une insuffisance valvulaire aortique massive, tandis que la valve mitrale présentait un feuillet valvulaire antérieur oscillant (flail), avec vraisemblablement, une grande végétation surajoutée, avec insuffisance mitrale massive. Une insuffisance tricuspide modérément sévère sur une valve morphologiquement normale a permis de mesurer une importante hypertension pulmonaire, avec une PAPs à 72 mmHg. On n'a pas réalisé d'échocardiographie transoesophagienne étant donné la pathologie oesophagienne sous-jacente. Une coronarographie avec cathétérisme cardiaque droit a confirmé l'hypertension pulmonaire secondaire sévère et a montré des coronaires normales. Au bout de 10 jours d'antibiothérapie, on a procédé à un remplacement valvulaire aortique et mitral (prothèses mécaniques) et à une plastie tricuspide. Durant l'intervention, la valve mitrale présentait des signes macroscopiques manifestes d'endocardite avec végétations.
Épidémiologie, physiopathologie et signes cliniques
L'endocardite infectieuse (EI) sur valve native n'est pas fréquente, son incidence atteignant 2 à 10 cas/100 000 personnes-années. L'infection se développe vraisemblablement sur une lésion de l'endothélium valvulaire.1 Ceci peut provoquer des microthrombi (interaction du collagène sous-endothélial et d'autres molécules de la matrice avec les plaquettes et la fibrine), appelés végétations stériles, qui peuvent être colonisés par des bactéries en cas de bactériémie. Si la réponse immunitaire est insuffisante, les bactéries peuvent proliférer et on peut voir apparaître des végétations infectées, qui constituent les lésions typiques d'une EI. La croissance bactérienne progressive (les neutrophiles et les autres molécules de défense peuvent difficilement combattre les bactéries dans une végétation) conduit aux 4 mécanismes typiques responsables des signes cliniques d'une EI: 1) destruction valvulaire, extension paravalvulaire et insuffisance cardiaque, 2) embolisation microvasculaire et embolisation de gros vaisseaux, 3) infection métastatique (cerveau, reins, rate, poumons), 4) phénomènes immunologiques (glomérulonéphrite, tests sérologiques faussement positifs).1
Les facteurs prédisposant à l'EI sont les anomalies congénitales comme une bicuspidie aortique (dans le présent cas), ainsi que les anomalies valvulaires acquises telles que les valves rhumatismales et la sténose valvulaire aortique. Les dispositifs intracardiaques sont de plus en plus souvent la cause d'une EI. Les facteurs de risque non cardiaques sont principalement une mauvaise hygiène dentaire, la toxicomanie IV, l'hémodialyse, le diabète, une hépatopathie chronique, une immunosuppression, un néoplasme sous-jacent et, comme chez notre patient, un dispositif ou un cathéter intravasculaire (PAC).
Les principaux signes cliniques sont la fièvre et un souffle cardiaque (90 et 75 % des patients atteints d'EI). Notre cas montre bien que la fièvre n'est pas une condition sine qua non pour le diagnostic d'EI. Une EI peut se manifester tant de manière aiguë (insuffisance cardiaque congestive, AVC, embolisation périphérique, sepsis ou choc septique) que subaiguë (état subfébrile, fatigue, dyspnée, transpiration, arthralgies, perte de poids). Les micro-emboles et les phénomènes immunologiques entraînent des hémorragies linéaires sous-unguéales, des hémorragies conjonctivales, des nodules d'Osler, Janeway lesion et Roth spots.
Microbiologie
Les germes Gram positifs sont responsables d'environ 80 % des cas d'EI: Staphylococcus aureus (35-40 %), Streptococcus (30-40 %: viridans 20 % et gallolyticus (anciennement bovis) et autres streptocoques 15 %) et entérocoques dans 10 % des cas d'EI. Contrairement aux patients souffrant d'EI sur prothèses valvulaires, les staphylocoques à coagulase négative, comme chez notre patient, sont assez rarement trouvés chez les patients atteints d'EI sur valves natives, à l'exception de Staphylococcus lugdunensis. On isole des bactéries du groupe HACEK, des champignons, des germes multiples et, rarement, des bacilles aérobies Gram négatifs dans 5 % des cas. Il va de soi que l'utilisation précoce d'antibiotiques avant le prélèvement des hémocultures peut conduire à des hémocultures négatives, ce qui peut considérablement compliquer le processus diagnostique et thérapeutique.
Évaluation et diagnostic
Le diagnostic d'une EI est toujours basé sur les critères de Duke modifiés (tableau 1). La sensibilité de ces critères pour le diagnostic de certitude de l'EI (diagnostic certain d'une EI) est de 80 %. La sensibilité est plus faible en cas d'EI sur valves artificielles ('EI sur valves prothétiques') ainsi qu'en cas d'EI sur dispositifs (PM, TRC, DCI), d'endocardite du coeur droit et d'EI avec cultures négatives. La valeur prédictive négative est de 90 % lorsque ni les critères de l'EI 'certaine' ni ceux de l'EI 'possible' ne sont remplis.
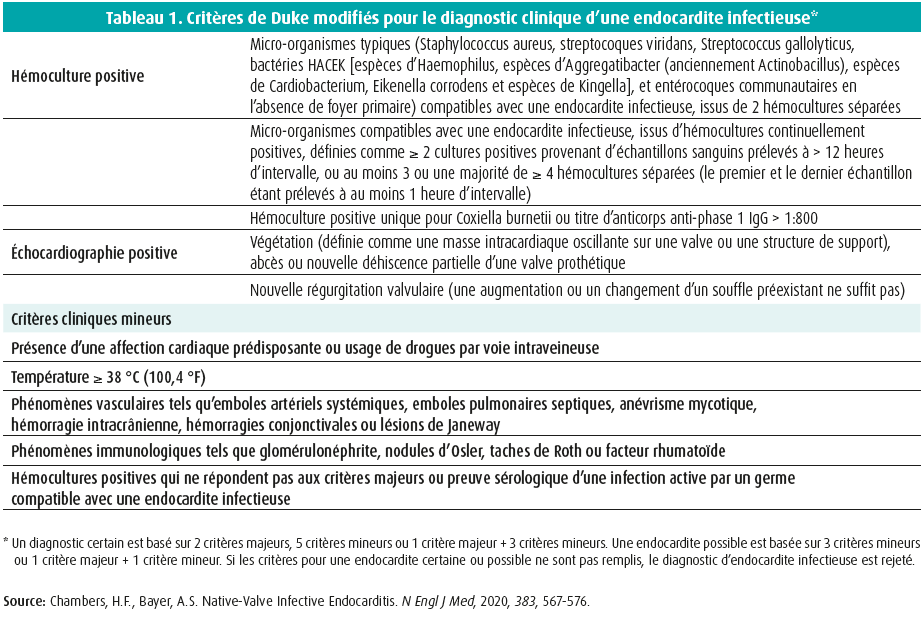
Les pierres angulaires du diagnostic d'une EI sont les hémocultures et l'échocardiographie.
Les hémocultures sont le principal test microbiologique mais, outre l'utilisation d'antibiotiques avant les hémocultures, les cultures peuvent être négatives en présence de bactéries à croissance très lente, voire nulle, dans les milieux d'hémoculture standard: les espèces du genre Bartonella, Coxiella burnetii, Tropheryma whipplei et Legionella. Dans ces cas, des tests sérologiques et moléculaires doivent donner la réponse adéquate.
L'échocardiographie reste le principal examen d'imagerie. En cas d'EI native, la sensibilité de l'échocardiographie transthoracique (ETT) atteint 60 %, contre 90 % ou plus avec une échocardiographie transoesophagienne (ETO). La spécificité des deux types d'écho atteint 95 %. Pour détecter à temps les complications intracardiaques, l'ETO est beaucoup plus sensible que l'ETT et on réalisera donc souvent une ETO complémentaire en cas de suspicion d'EI sur la base de la clinique et de l'ETT. De nouvelles techniques d'imagerie ont été incorporées dans les recommandations par l'ESC en 2015, avec un rôle pour l'IRM pour la détection précoce des emboles cérébraux, pour la scintigraphie aux globules blancs marqués et le PEC-CT pour le diagnostic d'une EI sur prothèse valvulaire ou sur dispositif, pour le MDCT pour l'extension périvalvulaire (abcédation) d'une EI et pour le PEC-CT pour la détection de foyers infectieux métastatiques.2 Alors que le PET-CT a prouvé son rôle complémentaire pour l'évaluation d'une EI sur prothèse valvulaire, son rôle en cas d'EI native n'est toujours pas élucidé.
Traitement antimicrobien
Le traitement antimicrobien des EI repose sur 4 principes de base: l'antibiotique doit être capable de tuer la bactérie (bactéricide et non bactériostatique); il faut administrer un traitement de longue durée (des semaines et non des jours); des doses élevées sont nécessaires pour garantir une exposition suffisante au médicament; et le contrôle de la source de l'infection.1
Un aperçu des différents schémas d'antibiothérapie figure dans les articles de synthèse sur les EI.1, 2
L'antibiothérapie doit souvent être administrée par voie intraveineuse (IV) pendant une longue période. On peut éviter des hospitalisations de longue durée, à condition de mettre en place des programmes de soins ambulatoires bien organisés, en accordant une attention particulière à l'asepsie lors des administrations IV.
Même si l'antibiothérapie est poursuivie per os en ambulatoire, un suivi structuré doit être organisé pour détecter à temps les signes de récidive ou les complications.
Compte tenu de la complexité de la prise en charge des EI, il est impératif que des équipes spécialisées dans la prise en charge des endocardites soient créées dans les centres de référence. Grâce à une approche multidisciplinaire rapide, cela devrait permettre d'offrir des soins optimaux à ces patients.
Traitement chirurgical
Les trois indications principales de la chirurgie sont les suivantes: 1) insuffisance cardiaque due à une dysfonction ou à une destruction valvulaire, 2) infection non contrôlée de l'endocarde (extension paravalvulaire ou bactériémie persistante) et 3) végétations mobiles de grande taille (> 10 mm) pour éviter une embolisation systémique, principalement vers le cerveau. La localisation de la végétation détermine également le risque emboligène (valve mitrale > valve aortique). Ces facteurs sont repris dans les recommandations pour une intervention chirurgicale (tableau 2).1, 2

Certaines publications suggèrent qu'une chirurgie précoce pourrait entraîner une meilleure survie comparativement à un traitement médical ou une chirurgie tardive, mais on ne sait toujours pas quels patients en tireraient le plus de bénéfices.3, 4
En revanche, il est de plus en plus clair que le pronostic des patients souffrant d'EI qui ont une indication chirurgicale théorique, mais qui ne sont pas opérés, pour une raison quelconque (inopérabilité, refus...), est très mauvais.
Pronostic
Malgré l'élargissement des possibilités diagnostiques et la tendance à un traitement plus précoce, tant médical que chirurgical, la mortalité des EI reste très élevée. La mortalité intrahospitalière atteint 15-30 %, la mortalité à 30 jours est de 20-23 % et la mortalité à 1 an de 30-40 %.
Incertitudes1
Les techniques moléculaires sont de plus en plus précises et, à l'avenir, elles gagneront probablement en importance pour le diagnostic précoce.
L'IRM et le PET-CT sont davantage mis en avant pour améliorer le diagnostic de l'EI. On ignore encore si la recherche systématique d'emboles cérébraux silencieux par IRM (critère mineur des critères de Duke) chez les patients présentant une EI sur valve native améliore également le pronostic de ces patients. Il en va de même de la réalisation systématique d'un PET-CT chez ces patients.
Bien que l'étude POET ait pu montrer des résultats encourageants pour le passage précoce de l'antibiothérapie IV à l'antibiothérapie per os, de plus amples études sont nécessaires pour déterminer chez quel type de patients cette stratégie est sûre. Dans cette étude, seuls 20 % des patients sélectionnés ont été inclus et seuls quelques-uns présentaient une infection à Staphylococcus aureus.5
Des incertitudes subsistent quant au timing, aux critères de report et aux facteurs pronostiques pour la chirurgie des EI. En cas d'AVC ischémique ou hémorragique étendu, on recommande généralement un report d'au moins 4 semaines. En cas d'AVC limité, la chirurgie peut probablement être pratiquée en toute sécurité.
Conclusion
Le cas exposé au début de cet article décrit un patient atteint d'une bicuspidie aortique connue, porteur d'un PAC rincé toutes les 6 semaines. Bien que ce patient n'ait pas présenté de fièvre ni de frissons, la présence d'un souffle cardiaque de novo (insuffisance valvulaire aortique - attention à une TA diastolique basse - et insuffisance mitrale) associé à des signes d'insuffisance cardiaque et à la présence d'un syndrome inflammatoire et d'une leucocytose a conduit à suspecter le diagnostic d'EI. Les hémocultures positives avec un germe typique ont étayé ce diagnostic, que l'ETT a confirmé. Étant donné les antécédents de chirurgie oesophagienne avec formation ultérieure de rétrécissements ayant nécessité plusieurs dilatations, on n'a pas effectué d'ETO, en dépit de l'indication manifeste. Vu la très bonne qualité de l'ETT et l'indication chirurgicale claire (destruction importante de la valve, dilatation importante du ventricule gauche, diminution de la fonction systolique du VG et hypertension pulmonaire sévère), on n'a pas non plus pratiqué d'ETO avec une (micro)sonde nasopharyngée, en raison du risque potentiel de perforation de l'oesophage.
Compte tenu du profil de risque cardiovasculaire élevé du patient (tabagisme sévère et hyperlipidémie) et après exclusion de végétations mobiles au niveau de la valve aortique, on a pratiqué un cathétérisme cardiaque gauche-droite. La coronarographie n'a révélé aucune lésion significative et le cathétérisme cardiaque droit a confirmé l'hypertension pulmonaire secondaire. Vu que le germe causal était connu dès le premier jour et qu'il pouvait être combattu de manière adéquate avec des doses élevées d'un antibiotique à spectre étroit, sur la base de l'antibiogramme, qu'on a pu contrôler adéquatement la source (retrait du PAC), et que le patient n'avait pas de problèmes hémodynamiques ni emboligènes sous une dose minimale de diurétiques, il a pu être opéré au jour 10, en bon état général. Les suites opératoires se sont révélées favorables.
Références
- Chambers, H.F., Bayer, A.S. Nativevalve endocarditis. N Engl J Med, 2020, 383, 6, 567576.
- Habib, G., Lancellotti, P., Antunes, M.J., et al. 2015 ESC Guidelines for the management of infective endocarditis: the Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC) — endorsed by: European Association for CardioThoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J, 2015, 36, 30753128.
- Anantha Narayanan, M., Mahfood Haddad, T., Kalil, A.C., et al. Early versus late surgical intervention or medical management for infective endocarditis: a systematic review and metaanalysis. Heart, 2016, 102, 950957.
- Liang, F., Song, B., Liu, R., Yang, L., Tang, H., Li, Y. Optimal timing for early surgery in infective endocarditis: a metaanalysis. Interact Cardiovasc Thorac Surg, 2016, 22, 336345.
- Iversen, K., Ihlemann, N., Gill, S.U., et al. Partial oral versus intravenous antibiotic treatment of endocarditis. N Engl J Med, 2019, 380, 415424.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.