Pour les patients avec fibrillation auriculaire non valvulaire (et donc à risque d'AVC et d'embolisation systémique) et pour les patients avec thrombose veineuse profonde ou embolies pulmonaires (et donc à risque de récidive de thrombo- embolie veineuse), les anticoagulants oraux directs (AOD) sont plus efficaces, provoquent moins souvent une hémorragie intracrânienne et sont plus simples à utiliser que les antagonistes de la vitamine K classiques. Les données initiales recueillies auprès de patients souffrant de cardiopathies congénitales modérées à graves semblaient confirmer ces observations1, ce qui explique aussi pourquoi l'usage des AOD augmente progressivement chez les patients porteurs d'une anomalie cardiaque congénitale. D'autre part, il est important de savoir qu'il n'existe à ce jour aucune étude contrôlée randomisée sur l'utilisation d'AOD chez les patients porteurs d'une anomalie cardiaque congénitale. Une récente étude publiée dans le European Heart Journal suggère que l'usage d'AOD (comparé aux antagonistes de la vitamine K) est associé à une mortalité accrue, à davantage d'événements thrombo-emboliques, à davantage d'événements cardiovasculaires majeurs et à davantage d'hémorragies, y compris après correction pour les éventuels facteurs parasites2. Compte tenu d'une amélioration significative de l'espérance de vie des patients porteurs d'une anomalie cardiaque congénitale,3 nous sommes confrontés à un groupe croissant de patients adultes atteints d'une cardiopathie congénitale sous-jacente (complexe)4 et même à une nouvelle cohorte de patients 'gériatriques' porteurs d'une anomalie cardiaque congénitale5. Le traitement adéquat des troubles du rythme et la prévention des événements thrombo-emboliques sont importants pour continuer à améliorer le pronostic de nos patients, mais restent une véritable gageure. Un groupe croissant de patients vieillissants, présentant davantage de complications, explique également pourquoi le nombre d'hospitalisations (d'urgence) augmente graduellement parmi les patients porteurs d'une anomalie cardiaque congénitale6, ce qui signifie que tous les cardiologues, et pas uniquement ceux spécialisés dans les cardiopathies congénitales, sont confrontés à ce type de patients. Cet article vise dès lors à esquisser un bref résumé en matière d'utilisation de l'anticoagulation pour les patients porteurs d'une anomalie cardiaque congénitale.
De quelles options disposons-nous, comment sont-elles suivies et quels sont les points de vigilance chez les patients atteints de cardiopathies congénitales ?
Antagonistes de la vitamine K
Les antagonistes de la vitamine K tels que la warfarine, l'acénocoumarol et la phenprocoumone ont une fenêtre thérapeutique relativement étroite, accompagnée de diverses interactions possibles avec d'autres médicaments et aliments. L'effet anticoagulant est suivi étroitement au moyen de l'INR (International Normalized Ratio, rapport international normalisé), la cible étant un TTR (Time in Therapeutic Range, temps passé dans la zone thérapeutique) d'au moins 70 % en vue de tendre à un équilibre optimal entre efficacité et sécurité. On dispose d'un antidote efficace, sous la forme de vitamine K. Bien que ces principes de base s'appliquent naturellement aussi aux patients porteurs d'une anomalie cardiaque congénitale, une certaine prudence s'impose chez les patients atteints de cardiopathies cyanogènes. Chez ces patients, une augmentation du taux d'hématocrite (consécutive à une cyanose) entraînera un volume plasmatique trop faible pour la quantité fixe de citrate dans les tubes de coagulation. Ce qui, à son tour, entraînera un allongement erroné du temps de coagulation (et un INR trop élevé) en raison d'une quantité excessive d'anticoagulant dans les tubes. C'est pourquoi il est extrêmement important, chez les patients ayant un taux d'hématocrite > 55 %, d'adapter la quantité de citrate dans les tubes afin de permettre une interprétation correcte de l'INR de ces patients. La quantité d'anticoagulant nécessaire pour ce faire peut se calculer à l'aide de la formule de Toronto ou de Perloff7. Lors de l'utilisation d'un tube citraté (2,7 ml de sang et 0,3 ml de citrate), cela revient plus au moins à ce qui suit :
- Hématocrite 55 % : 0,220 ml de citrate dans le tube
- Hématocrite 60 % : 0,200 ml de citrate dans le tube
- Hématocrite 65 % : 0,175 ml de citrate dans le tube
- Hématocrite 70 % : 0,150 ml de citrate dans le tube
Héparine
Les héparines, soit sous forme non fractionnée (HNF), soit sous la forme d'héparine de bas poids moléculaire (HBPM), sont régulièrement utilisées par les patients porteurs d'une anomalie cardiaque congénitale. L'administration intraveineuse d'HNF a un effet anticoagulant immédiat, qui est suivi au moyen du temps de céphaline activé (TCA). Les HBPM, quant à elles, sont administrées par voie sous-cutanée à raison d'une ou deux fois par jour. Lorsque les HBPM sont utilisées chez des patients porteurs d'une anomalie cardiaque congénitale, par exemple en remplacement d'antagonistes de la vitamine K pendant la grossesse ou dans le traitement d'un événement thrombo-embolique chez un patient présentant une circulation de type Fontan, il est impératif d'opter pour l'administration biquotidienne, si nécessaire avec suivi des taux d'anti-Xa8.
Anticoagulants oraux directs (AOD)
Les AOD inhibent un seul facteur de coagulation, notamment la thrombine dans le cas du dabigatran et le facteur Xa dans le cas du rivaroxaban, de l'édoxaban et de l'apixaban. Outre une efficacité thérapeutique supérieure et un meilleur profil de sécurité (moins d'hémorragies intracrâniennes), la facilité d'utilisation joue certainement aussi un rôle important dans le choix des AOD chez les patients (plutôt jeunes) porteurs d'une anomalie cardiaque congénitale. À ce jour, nous disposons de l'idarucizimab comme antidote du dabigatran et de l'andexanet alfa comme antidote de l'apixaban et du rivaroxaban. L'usage d'AOD chez les patients porteurs d'une anomalie cardiaque congénitale augmente graduellement dans la pratique quotidienne, bien que les données de pharmacocinétique et de pharmacodynamique pour les différents sous-groupes atteints de cardiopathies congénitales soient assez limitées. Le récent article de Freisinger et al.2 indique que l'utilisation d'AOD chez des patients porteurs d'une anomalie cardiaque congénitale ne semble pas toujours équivalente à celle d'antagonistes de la vitamine K et que leur usage doit être évalué sur une base individuelle.
Quelles sont les indications de l'anticoagulation orale chez les patients porteurs d'une anomalie cardiaque congénitale et quels sont les points à surveiller ?
Troubles du rythme auriculaire
Les cicatrices résultant d'anciennes interventions, les lésions résiduelles (sténose et insuffisance valvulaires) et les malformations anatomiques constituent un substrat pour le développement de troubles du rythme auriculaire. Les arythmies auriculaires sont dès lors fréquentes et interviennent souvent à un jeune âge chez les patients porteurs d'une anomalie cardiaque congénitale. Chez les patients plus jeunes, nous rencontrons plus souvent des flutters auriculaires et/ ou des tachycardies par réentrée intra-auriculaire, tandis que les fibrillations auriculaires seront plus fréquentes chez les patients plus âgés. Traditionnellement, le risque d'AVC et d'hémorragie dans le contexte d'une fibrillation auriculaire non valvulaire est évalué au moyen du score CHA2DS2-VASc et du score HAS-BLED. Mais ces scores ne sont pas validés chez les patients porteurs d'une anomalie cardiaque congénitale. Les actuelles recommandations européennes7, en partie étayées par les résultats de l'étude TACTIC9, préconisent l'utilisation du score CHA2DS2-VASc pour les patients porteurs d'une anomalie cardiaque congénitale simple, mais insistent sur l'importance d'une anticoagulation orale à long terme chez les patients porteurs d'une anomalie cardiaque congénitale complexe modérée ou grave, même si le score CHA2DS2-VASc est nul. Une évaluation individuelle reste toutefois importante, en particulier en cas de lésions modérément complexes (tableau 1, figure 1).
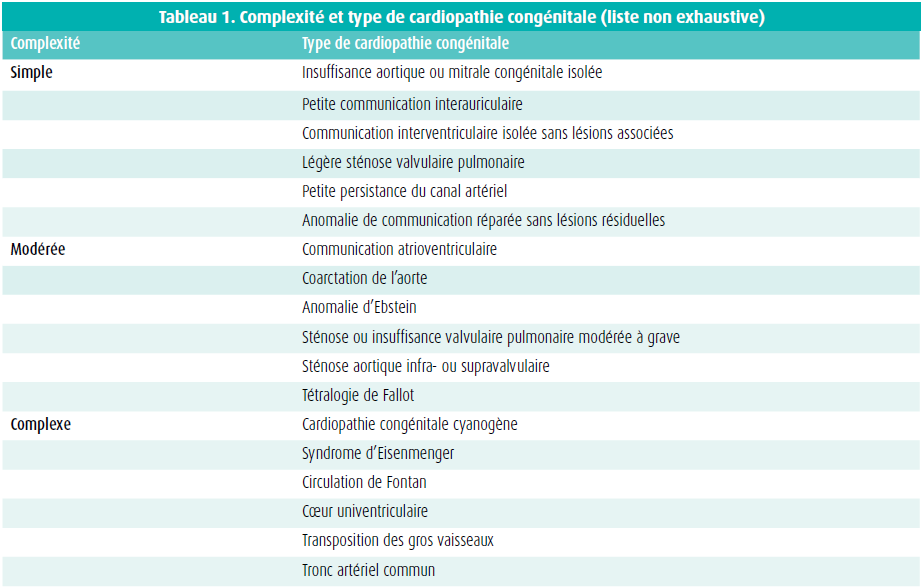
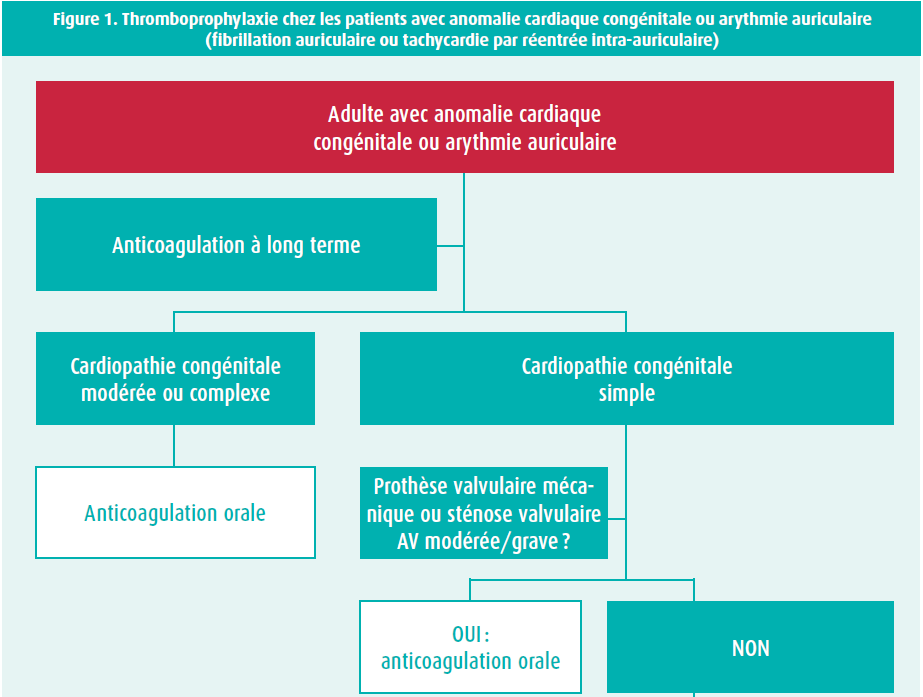
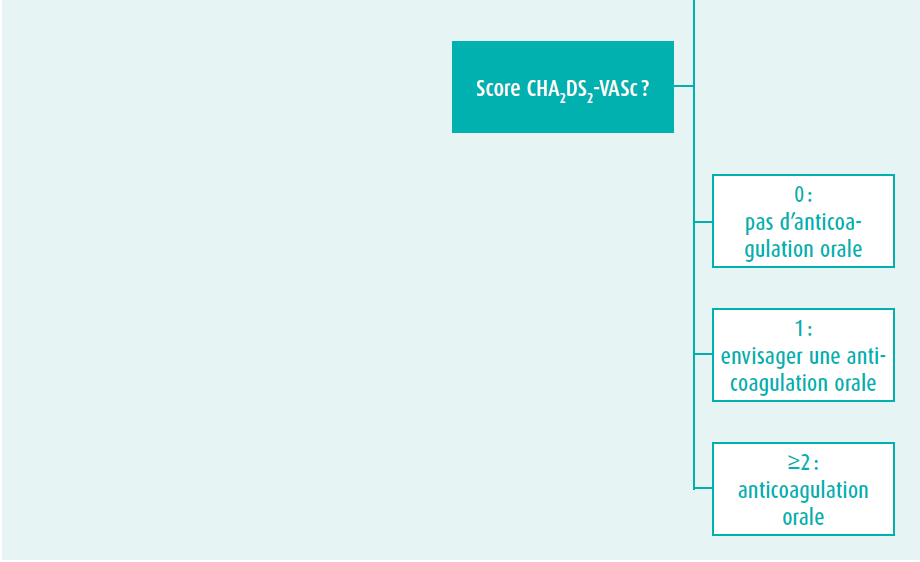
Prothèse valvulaire mécanique
Bon nombre de patients porteurs d'une anomalie cardiaque congénitale, telle qu'une bicuspidie aortique valvulaire, une tétralogie de Fallot, une communication atrioventriculaire, une insuffisance mitrale congénitale ou une anomalie d'Ebstein, devront subir une ou plusieurs interventions valvulaires au cours de leur vie. Bien que - lorsque cela est possible - la préférence soit donnée à la réparation valvulaire, un groupe relativement important devra finalement subir une valvuloplastie. Si le patient a une prothèse valvulaire mécanique, il existe naturellement une indication stricte pour les antagonistes de la vitamine K. Une étude de phase 2 qui comparait le dabigatran avec des antagonistes de la vitamine K a dû être interrompue prématurément du fait qu'un plus grand nombre d'événements thrombo-emboligènes et d'hémorragies était observé dans le groupe dabigatran10. Le type de prothèse et le site de la valve déterminent dans une certaine mesure le risque thrombotique et peuvent s'utiliser pour adapter l'INR cible sur une base individuelle et/ou pour ajouter une faible dose d'acide acétylsalicylique8.
Cardiopathies cyanogènes
Les patients souffrant de cardiopathies congénitales cyanogènes sont exposés à un risque particulièrement élevé d'événements thrombo-emboliques, principalement d'embolies pulmonaires et d'AVC. La prescription en routine d'une anticoagulation orale à ces patients n'est pourtant pas encouragée, car il existe également un risque hémorragique important (et potentiellement mortel)7. Les indications pour l'anticoagulation orale dans ce groupe de patients restent donc limitées à certaines situations bien définies, comme la survenue de troubles du rythme auriculaire ou d'embolies pulmonaires aiguës et la présence de prothèses valvulaires mécaniques. Si un thrombus pariétal (p. ex. chez des patients atteints du syndrome d'Eisenmenger) est incidemment trouvé dans le système vasculaire pulmonaire, le risque thrombotique et hémorragique doit être examiné individuellement avant l'instauration d'une anticoagulation orale. D'après notre expérience, il y a lieu de privilégier un INR cible entre 2,0 et 2,5 chez ces patients.
Circulation de Fontan
Les patients présentant une circulation de type Fontan n'ont qu'un seul ventricule anatomique ou fonctionnel, le sang veineux systémique coulant de manière passive à travers la circulation pulmonaire. Dans cette population de patients aussi, le risque d'événements thrombo-emboliques est particulièrement élevé (en moyenne chez 33 % des patients) et souvent à même de menacer le pronostic vital (cause de décès chez 25 % des patients). Une stase dans les connexions veineuses, la présence de shunts droite-gauche, des structures en cul-de-sac, le matériel prothétique, mais aussi les modifications de l'hémostase sont responsables du risque thrombotique majoré. Étant donné que les quelques études n'ont révélé aucun avantage pour l'usage de l'anticoagulation orale, les indications restent ici aussi limitées à certaines situations spécifiques, comme la survenue d'arythmies auriculaires ou d'embolies pulmonaires aiguës et la présence de prothèses valvulaires mécaniques (même si ces dernières ne seront pas fréquentes)11. Dans le cas d'une circulation de Fontan défaillante, nous démarrons également une anticoagulation orale.
Pourquoi les antagonistes de la vitamine K peuvent-ils être plus efficaces que les AOD chez les patients porteurs d'une anomalie cardiaque congénitale ?
Il se peut que l'indication pour l'instauration d'une anticoagulation orale et la physiopathologie y associée joue un rôle dans la différence d'efficacité et de sécurité entre les antagonistes de la vitamine K et les AOD chez les patients porteurs d'une anomalie cardiaque congénitale. Dans le cas d'une fibrillation auriculaire, c'est surtout la stase dans l'appendice auriculaire gauche qui est la principale raison de la formation de caillots, tandis que la triade de Virchow - hypercoagulabilité, lésion pariétale et stase - est impliquée dans la thrombo-embolie veineuse. Comme nous l'avons déjà mentionné, les AOD ne ciblent qu'un seul facteur de coagulation activé, tandis que les antagonistes de la vitamine K agissent sur plusieurs facteurs de coagulation de la cascade de coagulation extrinsèque, intrinsèque et commune12. Bien que la majorité des patients porteurs d'une anomalie cardiaque congénitale inclus dans l'étude de Freisinger et al. se soient vus administrer une anticoagulation orale pour fibrillation auriculaire (66 %) ou thrombo-embolie veineuse (14 %), certains patients ont également été mis sous anticoagulants en raison de la cardiopathie même (p. ex. circulation de Fontan). L'activation par contact joue potentiellement un rôle plus prépondérant dans ce groupe de patients, ce qui pourrait expliquer l'excès d'événements thrombo-emboliques dans ce groupe. Il va de soi que des études complémentaires, tenant compte du type et de la complexité de la cardiopathie sous-jacente, devront déterminer la stratégie d'anticoagulation la plus optimale pour chaque patient individuel.
Et maintenant ?
Les patients adultes porteurs d'une anomalie cardiaque congénitale représentent un groupe sans cesse grandissant de patients, qui présenteront de plus en plus de complications. Compte tenu de la survenue souvent aiguë de ces complications, la question de l'indication et du type d'anticoagulation orale se posera de plus en plus souvent. Il est important de comprendre que les recommandations ne sont pas toujours validées pour les patients porteurs d'une anomalie cardiaque congénitale, d'autant plus s'il s'agit de patients souffrant d'une cardiopathie congénitale sous-jacente modérée ou complexe. Les patients porteurs d'une anomalie cardiaque congénitale ne présentent ainsi pas toujours les facteurs de risque classiques repris dans le score CHA2DS2-VASc. L'indication pour l'instauration d'une anticoagulation orale dépendra dès lors en partie du type d'anomalie, de la présence de communications intracardiaques et du risque hémorragique. La récente étude de Freisinger et al.2 suggère que les AOD ne constituent peutêtre pas le choix le plus optimal pour tous les patients porteurs d'une anomalie cardiaque congénitale et que les AOD n'offrent peut-être pas la même efficacité et la même sécurité que celles observées chez les patients souffrant d'affections cardiovasculaires acquises. Peut-être estil dès lors prudent de conclure que les antagonistes de la vitamine K restent actuellement le traitement standard, tandis que les AOD peuvent être instaurés au cas par cas après une concertation multidisciplinaire. Enfin, il faut garder en tête que la quantité de citrate doit être adaptée lors du suivi de l'anticoagulation orale (INR) chez les patients avec cardiopathies cyanogènes et hématocrite élevé.
Références
- Yang, H., Bouma, B.J., Dimopoulos, K., Khairy, P., Ladouceur, M., Niwa, K. et al. Non-vitamin K antagonist oral anticoagulants (NOACs) for thromboembolic prevention, are they safe in congenital heart disease? Results of a worldwide study. Int J Cardiol, 2020, 299, 123-130.
- Freisinger, E., Gerß, J., Makowski, L., Marschall, U., Reinecke, H., Baumgartner, H. et al. Current use and safety of novel oral anticoagulants in adults with congenital heart disease: results of a nationwide analysis including more than 44 000 patients. Eur Heart J, 2020, 41 (43), 4168-4177.
- Moons, P., Bovijn, L., Budts, W., Belmans, A., Gewillig, M. Temporal trends in survival to adulthood among patients born with congenital heart disease from 1970 to 1992 in Belgium. Circulation, 2010, 122 (22), 2264-2272.
- Gilboa, S.M., Devine, O.J., Kucik, J.E., Oster, M.E., Riehle-Colarusso, T., Nembhard, W.N. et al. Congenital Heart Defects in the United States: Estimating the Magnitude of the Affected Population in 2010. Circulation, 2016, 134 (2), 101-109.
- Tutarel, O., Kempny, A., Alonso-Gonzalez, R., Jabbour, R., Li, W., Uebing, A. et al. Congenital heart disease beyond the age of 60: Emergence of a new population with high resource utilization, high morbidity, and high mortality. Eur Heart J, 2014, 35 (11), 725-732.
- Burstein, D.S., Rossano, J.W., Griffis, H., Zhang, X., Fowler, R., Frischertz, B. et al. Greater admissions, mortality and cost of heart failure in adults with congenital heart disease. Heart, 2020.
- Baumgartner, H., Backer, J. De., Babu- Narayan, S.V., Budts, W., Chessa, M., Diller, G-P. et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J, 2020.
- Jensen, A.S., Idorn, L., Nørager, B., Vejlstrup, N., Sondergaard, L. Anticoagulation in adults with congenital heart disease: The who, the when and the how? Heart, 2015, 101 (6), 424-429.
- Khairy, P., Aboulhosn, J., Broberg, C.S., Cohen, S., Cook, S., Dore, A. et al. Thromboprophylaxis for atrial arrhythmias in congenital heart disease: A multicenter study. Int J Cardiol, 2016, 223, 729-735.
- Eikelboom, J.W., Connolly, S.J., Brueckmann, M., Granger, C.B., Kappetein, A.P., Mack, M.J. et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med, 2013, 369 (13), 1206-1214.
- Monagle, P., Cochrane, A., Roberts, R., Manlhiot, C., Weintraub, R., Szechtman, B. et al. A multicenter, randomized trial comparing heparin/warfarin and acetylsalicylic acid as primary thromboprophylaxis for 2 years after the Fontan procedure in children. J Am Coll Cardiol, 2011, 58 (6), 645-651.
- Verhamme, P., Budts, W., Van de Werf, F. Non-vitamin K oral anticoagulants in adults with congenital heart disease: quod non? Eur Heart J, 2020, 41 (43), 4178-4180.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.