Voor patiënten met niet-klepgerelateerd voorkamerfibrilleren (en dus risico op beroerte en systeemembolisatie) en voor patiënten met diepe veneuze trombose of longembolen (en dus risico op recidief veneuze trombo-embolie) zijn directe orale anticoagulantia (DOAC) doeltreffender, veroorzaken minder frequent een intracraniële bloeding en zijn eenvoudiger in gebruik dan de klassieke vitamine K-antagonisten. Initiële data bij patiënten met matig tot ernstig congenitaal hartlijden leken deze bevindingen te bevestigen1, hetgeen ook verklaart waarom het gebruik van DOAC's voor patiënten met een aangeboren hartafwijking gradueel toeneemt. Anderzijds is het belangrijk te weten dat er tot op heden geen gerandomiseerd gecontroleerde studies bestaan over het gebruik van DOAC's voor patiënten met een aangeboren hartafwijking. Een recente studie gepubliceerd in European Heart Journal suggereert dat het gebruik van DOAC (in vergelijking met vitamine K-antagonisten) geassocieerd is met toegenomen mortaliteit, meer tromboembolische events, meer majeur cardiovasculaire events en meer bloedingen zelfs na correctie voor mogelijke confounder1. Door een significante verbetering in levensverwachting van patiënten met een aangeboren hartafwijking3 worden we geconfronteerd met een groeiende groep van volwassen patiënten met (complex) onderliggend congenitaal hartlijden4 en zelfs een nieuwe cohorte van 'geriatrische' patiënten met een aangeboren hartafwijking5. Het adequaat behandelen van ritmestoornissen en het voorkomen van tromboembolische events is belangrijk om de prognose van onze patiënten verder te verbeteren, maar het blijft uitdagend. Een groeiende groep ouder wordende patiënten met meer complicaties verklaart ook waarom het aantal (spoed)opnames bij patiënten met een aangeboren hartafwijking gradueel toeneemt6, wat betekent dat iedere cardioloog, en zeker niet enkel de congenitale cardioloog, met dit type patiënt wordt geconfronteerd. Het doel van dit artikel is dan ook om een korte samenvatting te schetsen over het gebruik van anticoagulatie voor patiënten met een aangeboren hartafwijking.
Welke opties hebben we, hoe worden deze opgevolgd en wat zijn aandachtspunten bij patiënten met congenitaal hartlijden?
Vitamine K-antagonisten
Vitamine K-antagonisten zoals warfarine, acenocoumarol en fenprocoumon hebben een vrij nauw therapeutisch venster met verschillende mogelijke interacties met andere medicatie en voedingsmiddelen. Het anticoagulerende effect wordt nauwgezet opgevolgd door middel van de INR (internationale genormaliseerde ratio), waarbij een 'tijd binnen het therapeutische venster (TTR)' van minstens 70 % wordt nagestreefd om een optimale balans tussen effectiviteit en veiligheid na te streven. Er is een effectief antidotum beschikbaar onder de vorm van vitamine K. Hoewel deze basisprincipes uiteraard ook gelden bij patiënten met een aangeboren hartafwijking, is een zekere voorzichtigheid geboden bij patiënten met cyanogeen hartlijden. Bij deze patiënten zal een toename van het hematocrietgehalte (ten gevolge van cyanose) ervoor zorgen dat het plasmavolume te laag is voor de vaste hoeveelheid citraat in de stollingstubes. Dit zal op zijn beurt aanleiding geven tot een foutieve verlenging van de stollingstijd (en te hoge INR) door een excessieve hoeveelheid anticoagulans in de tubes. Daarom is het uiterst belangrijk om bij patiënten met een hematocrietgehalte > 55 % de hoeveelheid citraat in de buisjes aan te passen om een juiste interpretatie te maken van de INR bij deze patiënten. Hierbij kan de hoeveelheid anticoagulans die nodig is, berekend worden door de Toronto- of Perloff-formule7. Bij het gebruik van een citraattube (2,7 ml bloed met 0,3 ml citraat) komt dit ongeveer neer op het volgende:
- Hematocriet 55 %; 0,220 ml citraat in de tube
- Hematocriet 60 %: 0,200 ml citraat in de tube
- Hematocriet 65 %: 0,175 ml citraat in de tube
- Hematocriet 70 %: 0,150 ml citraat in de tube
Heparine
Heparines, hetzij in de niet-gefractioneerde vorm (UFH), hetzij als laagmoleculairgewichtheparine (LMWH), worden regelmatig gebruikt voor patiënten met een aangeboren hartafwijking. Intraveneuze toediening van UFH heeft een onmiddellijke anticoagulerende werking en wordt opgevolgd door middel van de geactiveerde tromboplastinetijd (aPTT). LMWH wordt subcutaan eenmaal of tweemaal daags toegediend. Als LMWH's worden gebruikt bij patiënten met een aangeboren hartafwijking, bijvoorbeeld ter vervanging van vitamine K-antagonisten tijdens de zwangerschap of in de behandeling van een trombo-embolisch event bij een patiënt met een Fontancirculatie, is het imperatief een tweemaal daagse dosering te gebruiken, zo nodig met opvolgen met anti-Xa levels8.
Directe orale anticoagulantia (DOAC's)
DOAC's inhiberen één enkele coagulatie factor, met name trombine in het geval van dabigatran, en factor Xa in het geval van rivaroxaban, edoxaban en apixaban. Naast een superieure therapeutische doeltreffendheid, een beter veiligheidsprofiel (minder intracraniële bloedingen), speelt zeker ook het gebruiksgemak een belangrijke rol in de keuze voor DOAC's bij (eerder jonge) patiënten met een aangeboren hartafwijking. Tot op heden beschikken we over idarucizimab als antidotum voor dabigatran en andexanet alfa als antidotum tegen apixaban en rivaroxaban. Het gebruik van DOAC's bij patiënten met een aangeboren hartafwijking neemt gradueel toe in de dagdagelijkse praktijk, hoewel data over farmacokinetiek en -dynamiek voor de verschillende subgroepen met congenitaal hartlijden eerder beperkt is. Het recente artikel van Freisinger et al.2 geeft een indicatie dat het gebruik van DOAC's bij patiënten met een aangeboren hartafwijking niet altijd equivalent lijkt te zijn aan vitamine K-antagonisten en dat het gebruik op individuele basis moet geëvalueerd worden.
Wat zijn de indicaties voor orale anticoagulatie bij patiënten met een aangeboren hartafwijking en wat zijn de aandachtspunten?
Voorkamerritmestoornissen
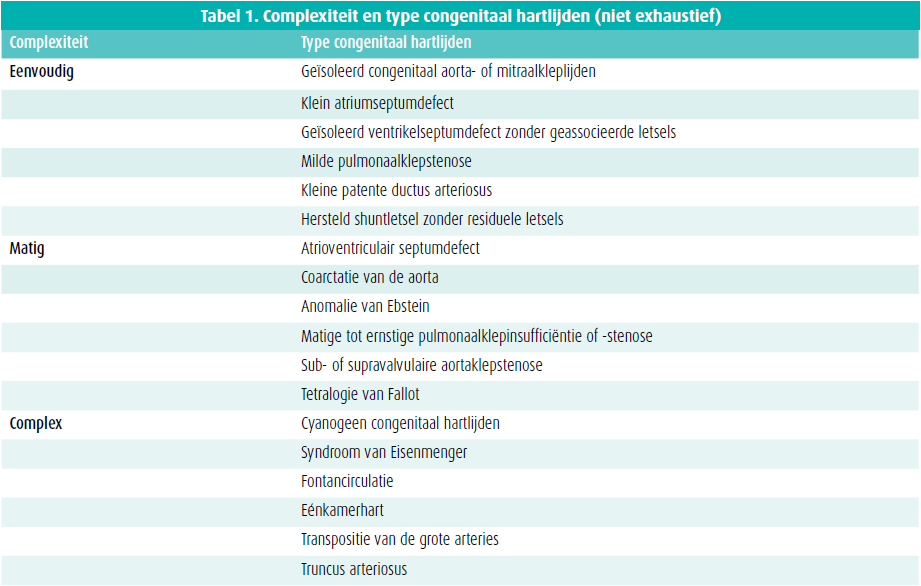
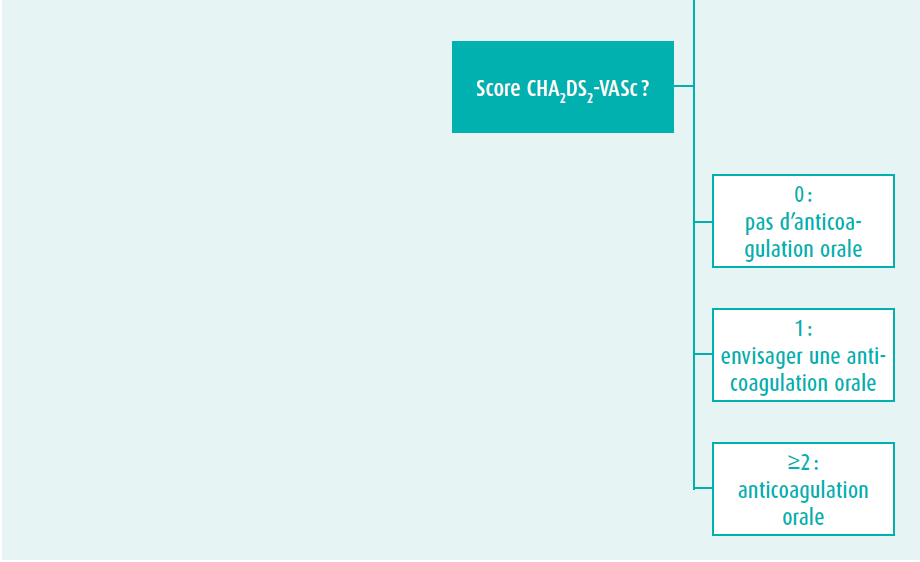
Littekens door eerdere interventies, residuele letsels (klepstenose en -insufficiëntie) en anatomische malformaties vormen een substraat voor het ontstaan van voorkamerritmestoornissen. Voorkamerritmestoornissen zijn dan ook frequent en treden vaak al op jongere leeftijd bij patiënten met een aangeboren hartafwijking. Bij jongere patiënten treffen we vaker voorkamerflutter en/of intra-atriale re-entrytachycardieën aan, terwijl bij oudere patiënten voorkamerfibrilleren frequenter zal zijn. Traditioneel wordt het risico op beroerte en bloeding in de setting van niet-klepgerelateerd voorkamerfibrilleren geëvalueerd door middel van de CHA2DS2-VASc-score en de HAS-BLED-score. Deze scores zijn echter niet gevalideerd bij patiënten met een aangeboren hartafwijking. De huidige Europese richtlijnen7, mede gesteund door de resultaten van de TACTICstudie9, ondersteunen het gebruik van de CHA2DS2VASc-score voor patiënten met een eenvoudige congenitale hartafwijking, maar benadrukken het belang van lange termijn orale anticoagulatie bij patiënten met matige of ernstig complexe congenitale hartafwijkingen, ook al zou de CHA2DS2VASc-score 0 zijn. Een individuele afweging, zeker bij matig complexe letsels, blijft echter belangrijk (tabel 1, figuur 1).
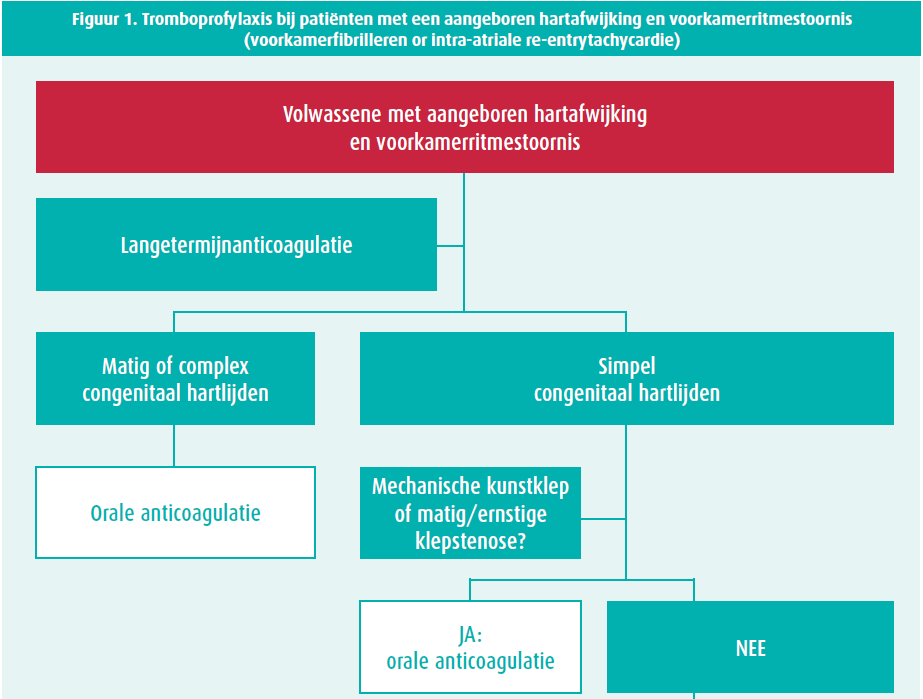
Mechanische kunstklep
Heel wat patiënten met een aangeboren hartafwijking, zoals bicuspide aortaklep, tetralogie van Fallot, atrioventriculair septumdefect, congenitaal mitraalkleplijden of Ebstein's anomalie zullen in de loop van hun leven één of meerdere klepinterventies moeten ondergaan. Hoewel - zo mogelijk - een klepherstel de voorkeur geniet, zal een relatief grote groep uiteindelijk een klepvervanging moeten ondergaan. Indien de patiënt een mechanische kunstklep heeft, bestaat er uiteraard een strikte indicatie voor vitamine K-antagonisten. Een fase 2-studie die dabigatran met vitamine K-antagonisten vergeleek, moest vroegtijdig stopgezet worden doordat meer trombo-emboligene events en meer bloedingen werden geobserveerd in de dabigatrangroep10. Het type prothese en de locatie van de klep bepaalt in zekere zin het trombotische risico en kan gebruikt worden om de INR-streefwaarde individueel aan te passen en/of een lage dosis acetylsalicylzuur toe te voegen8.
Cyanogene corvitia
Patiënten met cyanogeen congenitaal hartlijden hebben een bijzonder hoog risico op trombo-emboligene events, voornamelijk longembolen en beroerte. Nochtans wordt het routinematig voorschrijven van orale anticoagulatie bij deze patiënten niet ondersteund, omdat er tevens een belangrijk (en potentieel levensbedreigend) bloedingsrisico bestaat7. Indicaties voor orale anticoagulatie in deze groep van patiënten blijven dus beperkt tot welomschreven situaties zoals het optreden van voorkamerritmestoornissen, acute longembolen, en aanwezigheid van mechanische kunstkleppen. Indien bij toeval een wandstandige trombus (bv. bij patiënten met het syndroom van Eisenmenger) in de longvasculatuur wordt aangetroffen, dient het trombotisch en bloedingsrisico individueel bekeken te worden alvorens orale anticoagulatie te starten. In onze ervaring is een streefwaarde voor INR tussen 2,0 en 2,5 bij deze patiënten te verkiezen.
Fontancirculatie
Patiënten met een Fontancirculatie hebben slechts één anatomisch of functioneel ventrikel, waarbij het systeem veneus bloed passief doorheen de longcirculatie stroomt. Ook in deze patiëntenpopulatie is het risico op trombo-embolische events bijzonder hoog (gemiddeld bij 33 % van de patiënten) en vaak levensbedreigend (oorzaak van sterfte in 25 % van de patiënten). Stase in de veneuze connecties, aanwezigheid van rechts-links shunts, blind eindigende structuren, prothetisch materiaal, maar ook veranderingen in hemostase zijn verantwoordelijk voor het verhoogde trombotisch risico. Aangezien de weinige studies geen voordeel toonden voor het gebruik van orale anticoagulatie, blijven de indicaties ook hier beperkt tot specifieke situaties zoals het optreden van voorkamerritmestoornissen, acute longembolen, en aanwezigheid van mechanische kunstkleppen (hoewel deze laatste niet frequent zullen zijn)11. In het geval van een falende Fontancirculatie starten wij ook orale anticoagulatie op.
Waarom zijn vitamine K-antagonisten mogelijk doeltreffender dan DOAC's bij patiënten met een aangeboren hartafwijking?
Mogelijk speelt de indicatie voor het opstarten van orale anticoagulatie en de daarmee gepaard gaande pathofysiologie een rol in het verschil in doeltreffendheid en veiligheid tussen vitamine K-antagonisten en DOAC's bij patiënten met een aangeboren hartafwijking. In het geval van voorkamerfibrilleren is vooral stase in het linkerhartoortje de voornaamste reden tot klontervorming, terwijl bij veneuze trombo-embolie triade van Virchow van toegenomen klonterneiging, vaatwandbeschadiging en stase betrokken is. Zoals reeds vermeld hebben DOAC's één enkele geactiveerde stollingsfactor als target, terwijl vitamine K-antagonisten inwerken op verschillende stollingsfactoren van de extrinsieke, intrinsieke en gemeenschappelijke stollingscascade12. Hoewel de meerderheid van de patiënten met een aangeboren hartafwijking in de studie van Freisinger et al. orale anticoagulatie kreeg toegediend vanwege voorkamerfibrilleren (66 %) of veneuze trombo-embolie (14 %), werden sommige patiënten ook geanticoaguleerd vanwege de hartaandoening zelf (bv. Fontancirculatie). Mogelijk speelt contactactivatie in deze groep patiënten een meer prominente rol, wat het exces aan trombo-embolische events in deze groep zou kunnen verklaren. Het spreekt voor zich dat verder onderzoek, waarbij het type en de complexiteit van de onderliggende cardiopathie in rekening wordt gebracht, zal moeten uitwijzen wat de meest optimale anticoagulatiestrategie is voor de individuele patiënt.
Wat nu?
Volwassen patiënten met een aangeboren hartafwijkingen vertegenwoordigen een steeds groter wordende groep van patiënten, die in toenemende mate complicaties zullen stellen. Omdat deze complicaties zich vaak acuut presenteren, betekent dit dat de vraag naar indicatie en type orale anticoagulatie steeds vaker zal gesteld worden. Het is belangrijk te beseffen dat de richtlijnen niet altijd gevalideerd zijn bij patiënten met een aangeboren hartafwijking, zeker niet als het gaat om patiënten met een matig of complex onderliggend congenitaal corvitium. Zo hebben patiënten met een aangeboren hartafwijking niet altijd de klassieke risicofactoren zoals opgenomen in de CHA2DS2VASc-score. De indicatie voor het opstarten van orale anticoagulatie zal dan ook mede afhangen van het type hartdefect, aanwezigheid van intracardiale shunts, en bloedingsrisico. De recente studie van Freisinger et al.2 suggereert dat DOAC's misschien niet de meest optimale keuze zijn voor alle patiënten met een aangeboren hartafwijking en dat DOAC's mogelijk niet dezelfde doeltreffendheid en veiligheid bieden als geobserveerd bij patiënten met verworven hart- en vaatziektes. Misschien is het dan ook veilig te stellen dat vitamine K-antagonisten voorlopig de standaardtherapie blijven, terwijl DOAC's kunnen verkozen worden na multidisciplinair overleg voor de individuele patiënt. Tot slot is het belangrijk te realiseren dat bij monitoring van orale anticoagulatie (INR) bij patiënten met cyanogene corvitia en hoog hematocriet een aanpassing van de hoeveelheid citraat vereist is.
Referenties
- Yang, H., Bouma, B.J., Dimopoulos, K., Khairy, P., Ladouceur, M., Niwa, K. et al. Non-vitamin K antagonist oral anticoagulants (NOACs) for thromboembolic prevention, are they safe in congenital heart disease? Results of a worldwide study. Int J Cardiol, 2020, 299, 123-130.
- Freisinger, E., Gerß, J., Makowski, L., Marschall, U., Reinecke, H., Baumgartner, H. et al. Current use and safety of novel oral anticoagulants in adults with congenital heart disease: results of a nationwide analysis including more than 44 000 patients. Eur Heart J, 2020, 41 (43), 4168-4177.
- Moons, P., Bovijn, L., Budts, W., Belmans, A., Gewillig, M. Temporal trends in survival to adulthood among patients born with congenital heart disease from 1970 to 1992 in Belgium. Circulation, 2010, 122 (22), 2264-2272.
- Gilboa, S.M., Devine, O.J., Kucik, J.E., Oster, M.E., Riehle-Colarusso, T., Nembhard, W.N. et al. Congenital Heart Defects in the United States: Estimating the Magnitude of the Affected Population in 2010. Circulation, 2016, 134 (2), 101-109.
- Tutarel, O., Kempny, A., Alonso-Gonzalez, R., Jabbour, R., Li, W., Uebing, A. et al. Congenital heart disease beyond the age of 60: Emergence of a new population with high resource utilization, high morbidity, and high mortality. Eur Heart J, 2014, 35 (11), 725-732.
- Burstein, D.S., Rossano, J.W., Griffis, H., Zhang, X., Fowler, R., Frischertz, B. et al. Greater admissions, mortality and cost of heart failure in adults with congenital heart disease. Heart, 2020.
- Baumgartner, H., Backer, J. De., Babu- Narayan, S.V., Budts, W., Chessa, M., Diller, G-P. et al. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J, 2020.
- Jensen, A.S., Idorn, L., Nørager, B., Vejlstrup, N., Sondergaard, L. Anticoagulation in adults with congenital heart disease: The who, the when and the how? Heart, 2015, 101 (6), 424-429.
- Khairy, P., Aboulhosn, J., Broberg, C.S., Cohen, S., Cook, S., Dore, A. et al. Thromboprophylaxis for atrial arrhythmias in congenital heart disease: A multicenter study. Int J Cardiol, 2016, 223, 729-735.
- Eikelboom, J.W., Connolly, S.J., Brueckmann, M., Granger, C.B., Kappetein, A.P., Mack, M.J. et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med, 2013, 369 (13), 1206-1214.
- Monagle, P., Cochrane, A., Roberts, R., Manlhiot, C., Weintraub, R., Szechtman, B. et al. A multicenter, randomized trial comparing heparin/warfarin and acetylsalicylic acid as primary thromboprophylaxis for 2 years after the Fontan procedure in children. J Am Coll Cardiol, 2011, 58 (6), 645-651.
- Verhamme, P., Budts, W., Van de Werf, F. Non-vitamin K oral anticoagulants in adults with congenital heart disease: quod non? Eur Heart J, 2020, 41 (43), 4178-4180.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.