Compte rendu d'une session de la BSC - session 15 - BIWAC/YCC
L'an dernier, les soins de santé ont été mondialement saturés par la pandémie de COVID-19 causé par le virus SARS-COV-2, détecté pour la première fois en décembre 2019 à Wuhan (Chine). Rapidement, le monde entier a été touché et, actuellement, on recense plus de 100 millions d'infections documentées et plus de 2 millions de décès dus au COVID-19, à l'échelle mondiale. Lors du 40e congrès annuel de la Société Belge de Cardiologie (SBC), le Groupe de travail Interdisciplinaire Belge de Cardiologie Aiguë (BIWAC) et le Young Cardiologists' Club (YCC) ont organisé une session consacrée aux soins cardiaques aigus durant la pandémie de COVID-19.
Cas clinique
Comme introduction, Philippe Morimont (intensiviste-cardiologue, CHU de Liège) a présenté le cas clinique d'un patient de 59 ans ayant un antécédent de maladie coronarienne, un profil de risque cardiovasculaire élevé et des plaintes respiratoires légères dues à une infection au COVID-19 depuis une semaine. À son arrivée, le patient présentait un infarctus myocardique inférolatéral avec sus-décalage du segment ST (STEMI) et un état général précaire, ce qui a nécessité une ventilation mécanique et des vasopresseurs. Ceci a retardé son transfert en salle de cathétérisme, où il est arrivé 126 minutes après le premier contact. La coronarographie a montré une occlusion de la circonflexe (LCx) qui a fait l'objet d'une revascularisation. Le patient a été admis aux soins intensifs où il a séjourné 25 jours sous ventilation prolongée, avec un soutien nécessaire par vasopresseurs et une dialyse transitoire.
Syndrome coronarien aigu et COVID-19
Giuseppe De Luca (cardiologue interventionnel, Eastern Piedmont University, Italie) a parlé de l'impact de la pandémie de COVID-19 sur la prise en charge et l'évolution des patients présentant un syndrome coronarien aigu (SCA). Au début de la pandémie, certains problèmes étaient prévisibles: incidence accrue de SCA en raison de la thromboembolie induite par le SARS-COV-2, temps d'ischémie plus long en raison des retards logistiques, interaction des inhibiteurs de l'ECA (ce qui a été rapidement réfuté) et risque d'infections concomitantes, tout ceci contribuant à une mortalité plus élevée chez les patients souffrant d'un SCA.
Afin de limiter les dommages collatéraux de la pandémie chez les patients atteints de pathologies aiguës, le réseau des soins de santé a été réorganisé en Lombardie, une région qui a été fortement touchée. Les soins aigus ont été concentrés dans quelques centres, appelés 'Macro-hubs', où un trajet de soins spécifique a été défini pour les patients présentant une pathologie aiguë et une suspicion d'infection par le COVID-19, afin de limiter le risque d'infection ou de contamination du personnel soignant.
Dans le grand registre européen ISACS-STEMI COVID-19, on a analysé l'impact de la pandémie de COVID-19 sur le traitement et l'évolution des patients souffrant d'un STEMI1. 6 609 patients provenant de 77 centres européens ont été inclus. En mars et avril 2020, pendant la pandémie, on a observé une diminution significative de 19 % du nombre de patients souffrant d'un STEMI, comparativement à la même période en 2019 (figure 1A). Des analyses de sous-groupes ont montrés une diminution significative des admissions pour STEMI chez les patients souffrant d'hypertension artérielle, mais aucune corrélation avec l'âge, le sexe ou le diabète. La même constatation a été faite dans une vaste étude observationnelle multicentrique conduite en Chine2. Dans cette étude, 28 198 patients ont été inclus, avec une diminution significative de 26 % du nombre de patients souffrant d'un STEMI pendant l'épidémie par rapport à avant (figure 1B). Cette diminution paradoxale du nombre de SCA, malgré l'association entre le SARS-COV-2 et les thromboembolies, est vraisemblablement multifactorielle ; citons la crainte de contracter l'infection à l'hôpital (en partie alimentée par les médias), la crainte du risque de saturation des soins de santé, la réduction du stress lié au travail, l'amélioration de la qualité de l'air et un mode de vie plus sédentaire1.

Une autre observation importante du registre ISACS-STEMI est une augmentation significative du temps d'ischémie, du temps 'de la porte au ballon' et de la mortalité (figure 1A)1. Le risque de mortalité augmenté, qui a persisté après l'exclusion des patients COVID-19 et la correction pour les facteurs susceptibles d'induire une confusion, est probablement le reflet de la plus longue durée de l'ischémie. La mortalité était significativement plus élevée chez les patients souffrant d'un STEMI, infectés par le COVID-19, que chez les patients souffrant d'un STEMI, indemnes du COVID-19 (29 % vs 5,5 %). Par analogie avec les résultats européens, la Chine a également enregistré une diminution du nombre de reperfusions 'à temps' et une augmentation de la mortalité, pendant la pandémie2.
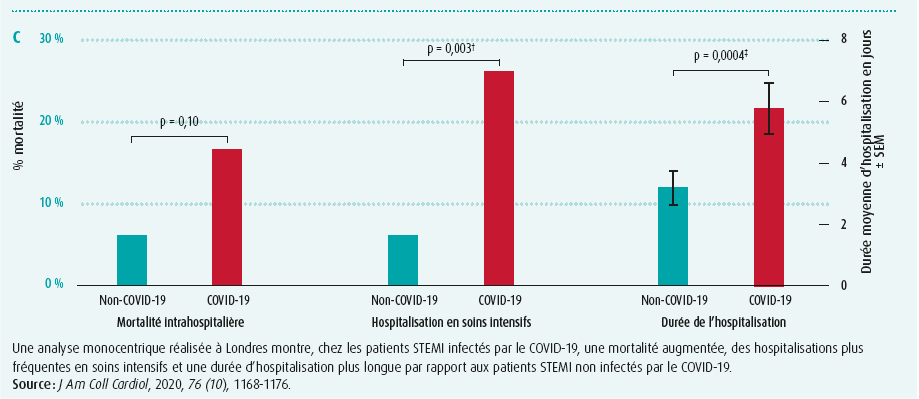
En outre, un changement de stratégie a été observé en Chine, avec une diminution du nombre d'angioplasties primaires et une augmentation des thrombolyses, mais sans répercussions sur une reperfusion effective ou sur les hémorragies (figure 1B)2. Cette observation est étayée par une étude monocentrique conduite à Londres, lors de laquelle on a comparé 39 patients atteints d'un STEMI, infectés par le COVID-19, à 76 patients atteints d'un STEMI, indemnes du COVID-193. L'analyse a montré une tendance à une mortalité plus élevée, à une hospitalisation aux soins intensifs significativement plus fréquente et à une durée d'hospitalisation plus longue (figure 1C). Par ailleurs, les patients infectés par le COVID-19 présentaient une charge thrombotique plus élevée avec un besoin plus important de thrombectomie et une utilisation plus fréquente d'inhibiteurs GP IIB/IIIA.
Coagulopathies et COVID-19
Christophe Vandenbriele (cardiologue-intensiviste, UZ Leuven, Belgique) a présenté un exposé sur les coagulopathies chez les patients atteints du COVID-19 et l'importance du traitement prophylactique. La prévalence d'événements thromboemboliques veineux (TEV) chez les patients COVID-19 admis aux soins intensifs a atteint 79 % avec - fait remarquable - l'apparition également fréquente d'une thrombose veineuse profonde (TVP) sous anticoagulants prophylactiques4. Chez environ 37,2 % des patients COVID-19, on a observé des D-dimères élevés5, et une association entre des taux de D-dimères > 1 μg/ml et le risque de décès6.
La physiopathologie sous-jacente est une conjonction complexe entre différents mécanismes. D'une part, le virus SARSCOV- 2 entraîne une régulation négative du récepteur ACE2, avec une augmentation de l'angiotensine II prothrombotique et une influence sur le fonctionnement du système kallikréine-bradykinine, un système impliqué à la fois dans la réponse inflammatoire - avec libération de cytokines - et dans la cascade de coagulation intrinsèque via les facteurs XII et XI. D'autres mécanismes qui contribuent à la coagulopathie sont d'une part l'activation de la cascade de coagulation extrinsèque suite à une expression accrue du 'facteur tissulaire' due à l'inflammation marquée associée au COVID-19 et d'autre part l'importante dysfonction endothéliale, avec e. a. libération de facteur von Willebrand7.
Les observations montrent une incidence accrue de TEV chez les patients COVID-19 séjournant aux soins intensifs, avec en outre une augmentation du nombre de TEV pendant l'hospitalisation, ce qui suggère que la prophylaxie standard est insuffisante chez ces patients gravement malades8. L'administration d'héparine à bas poids moléculaire (HBPM) aux patients atteints d'une infection sévère par le COVID-19 ou présentant des D-dimères élevés semble associée à un meilleur pronostic. Par conséquent, dès le début de l'épidémie, on a recommandé que chaque patient COVID-19 hospitalisé reçoive une HBPM à titre prophylactique. Pour évaluer la nécessité d'une prophylaxie thromboembolique après la sortie de l'hôpital, une population d'étude de 163 patients a été observée à l'UZ Leuven pendant 6 semaines. Bien qu'une minorité seulement ait reçu un traitement ultérieur par HBPM, on n'a constaté aucun événement thromboembolique symptomatique et une seule TVP asymptomatique. Par conséquent, il n'y a probablement aucun rôle pour une HBPM prophylactique après la sortie de l'hôpital.
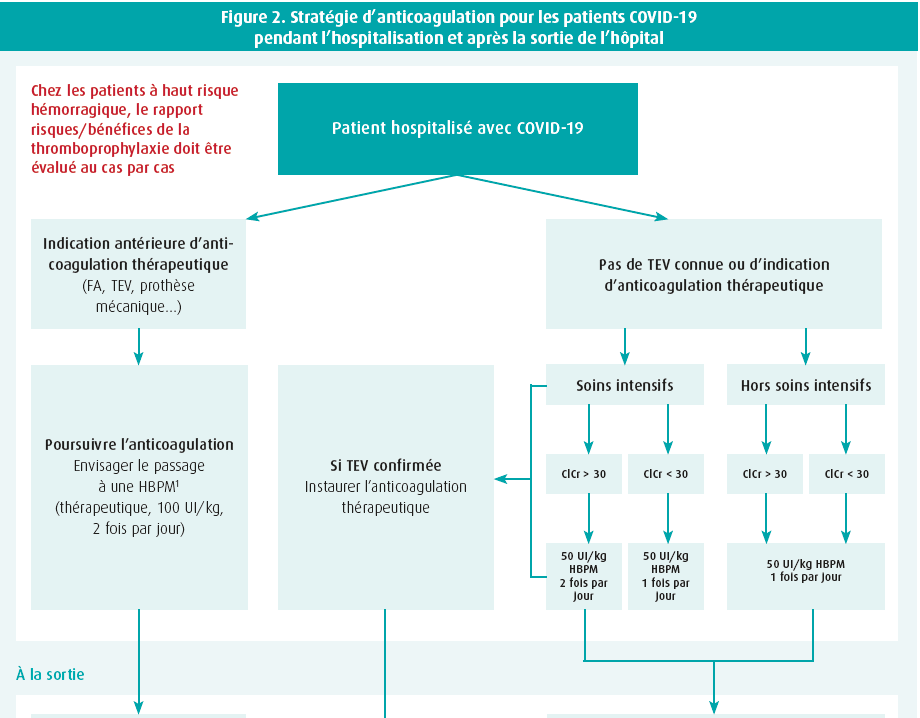
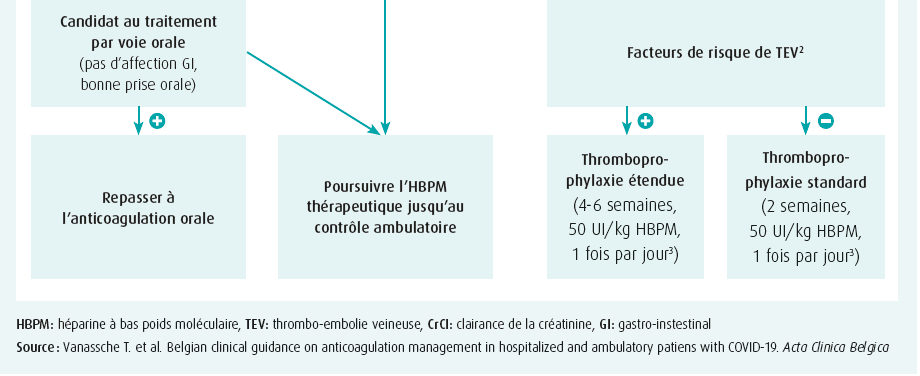
Les recommandations belges sur l'anticoagulation chez les patients COVID-19 ont été publiées en octobre 2020 (figure 2)9. Ces recommandations préconisent un traitement prophylactique ou thérapeutique par HBPM pour tous les patients COVID-19 hospitalisés. La dose prophylactique d'HBPM est déterminée par la sévérité de la maladie (reflétée par un séjour aux soins intensifs) et la fonction rénale, tout en tenant compte des risques hémorragiques éventuels. S'il existe une indication d'anticoagulants à titre thérapeutique, il va de soi que le traitement doit être poursuivi après la sortie de l'hôpital. Bien que l'observation ci-dessus montre que ce n'est probablement pas nécessaire, les recommandations actuelles préconisent également de poursuivre temporairement le traitement prophylactique après la sortie de l'hôpital pendant 2 à 6 semaines, en fonction d'un risque accru tel que l'immobilité, un cancer ou un antécédent de thromboembolie. Bien que ce ne soit pas explicitement mentionné dans le schéma, le passage aux anticoagulants oraux peut certainement être envisagé au moment de la sortie. L'utilité des médicaments antiplaquettaires fait toujours l'objet de discussions, mais Christophe Vandenbriele déconseille leur utilisation en cas d'événements veineux. Ce n'est qu'en cas de thromboembolies artérielles associées que l'ajout d'un traitement antiplaquettaire doit être envisagé, en tenant compte du risque hémorragique.
Éthique : triage et redistribution des moyens lors d'épidémies
Marco Vergano (intensiviste à l'hôpital San Giovanni Bosco, Italie) a combattu en première ligne lors de la pandémie de COVID-19, et il a été étroitement impliqué dans la logistique et la gestion éthique pendant l'épidémie.
Nombre de comportements observés lors de l'épidémie actuelle, comme les mesures obligatoires (p. ex. la quarantaine et les masques) et la résistance à celles-ci, sont similaires à ceux observés lors de la pandémie de grippe espagnole au siècle dernier. L'évolution épidémiologique, avec des éclosions en plusieurs vagues, est également similaire. La grande différence est que, grâce à la croissance technologique du siècle dernier, nous avons davantage d'options thérapeutiques. Ceci influence le traitement et le pronostic, mais aussi l'éthique dans le domaine des soins de santé. Les progrès technologiques que nous avons réalisés dépassent de loin notre capacité à réfléchir de manière critique à leur utilisation. Pour reprendre les termes du scientifique Bjorn Morten Hoffman, nous sommes 'des titans technologiques et des lilliputiens éthiques'10.
L'éclosion de la pandémie de COVID-19 a représenté une (sur)charge importante pour le système des soins de santé et, dans certains pays, une pénurie de fournitures médicales, y compris un manque de capacité de lits, de respirateurs, etc. Par conséquent, le triage fut un malnécessaire. Il a fallu passer d'une perspective (classique) ciblée sur le patient individuel à une perspective de groupe, dans le but de sauver autant de vies que possible avec les moyens disponibles. Le triage doit tenir compte de valeurs morales et de principes tels que la valeur de la vie, la sévérité de la maladie, l'utilisation efficiente des moyens et l'honnêteté11. Le triage à l'ère du COVID-19 consiste à chercher un équilibre entre un bénéfice maximal au niveau de la population et l'honnêteté individuelle, un équilibre influencé par la quantité de moyens disponibles12. Ce changement de perspective ne va pas de soi, et il est également difficile d'établir qui est responsable des décisions nécessaires.
Lorsque le nombre de patients COVID-19 a augmenté de manière exponentielle, des recommandations et des directives éthiques ont été publiées dans plusieurs pays au sujet du triage et de la priorisation, afin de soutenir les cliniciens dans leurs soins aux patients gravement malades et dans les décisions en cas de manque de moyens13. Ces recommandations ont donné lieu à de nombreux débats. Un critère important pour le triage est la probabilité de survie; d'autres critères reflètent les normes et les valeurs au sein d'une communauté. Ces accords éthiques doivent faire l'objet de concertations, afin que les décisions ne soient pas guidées par des valeurs personnelles, la conscience, l'intuition ou la religion14. Une des questions les plus débattues est l'utilisation de l'âge comme critère de triage15. Marco Vergano estime que chez les patients atteints du COVID-19, il n'est pas erroné de prioriser en fonction de l'âge. Il affirme que l'âge en soi n'est pas un élément prédictif de mortalité, mais que l'âge avancé (indépendamment d'éventuelles comorbidités) est associé à la fragilité (frailty). Les patients ne meurent pas de vieillesse, mais d'affections liées à l'âge cumulatives, avec une fragilité croissante. Il a étayé son point de vue avec des résultats préliminaires montrant une forte corrélation entre l'âge avancé et la mortalité causé par COVID-19.
Bien que les recommandations relatives au triage et à la mise par ordre de priorité des capacités disponibles aient fait l'objet de nombreuses critiques, nous constatons aujourd'hui qu'une admission aux soins intensifs n'est pas la panacée pour les infections sévères par le COVID-19. Les données observationnelles de la première vague de la pandémie montrent que la majorité des patients admis aux soins intensifs sont malgré tout décédés16. Ceux qui ont survécu sont souvent confrontés à une morbidité importante et à un long rétablissement. Cette réalité a été occultée dans les débats éthiques sur le triage, par l'accent mis sur le manque de moyens et la valeur ajoutée perçue d'une admission aux soins intensifs. Il reste difficile de répondre à la question 'Qui a une chance raisonnable de survie avec une qualité de vie suffisante après une admission aux soins intensifs?'. Les recommandations actuelles préconisent l'utilisation d'une combinaison de systèmes de scores (tels que la Clinical Frailty Scale, l'index de comorbidité de Charlson) qui fournissent un appui factuel à cette décision éthique.
Références
- De Luca, G., Verdoia, M., Cercek, M., Jensen, L.O., Vavlukis, M., Calmac, L. et al. Impact of COVID-19 Pandemic on Mechanical Reperfusion for Patients With STEMI. J Am Coll Cardiol, 2020, 76 (20), 2321-2330.
- Xiang, D., Xiang, X., Zhang, W., Yi, S., Zhang, J., Gu, X. et al. Management and Outcomes of Patients With STEMI During the COVID-19 Pandemic in China. J Am Coll Cardiol, 2020, 76 (11), 1318-24.
- Choudry, F.A., Hamshere, S.M., Rathod, K.S., Akhtar, M.M., Archbold, R.A., Guttmann, O.P. et al. High Thrombus Burden in Patients With COVID-19 Presenting With ST-Segment Elevation Myocardial Infarction. J Am Coll Cardiol, 2020, 76 (10), 1168-1176.
- Nahum, J., Morichau-Beauchant, T., Daviaud, F., Echegut, P., Fichet, J., Maillet, J.M. et al. Venous Thrombosis Among Critically Ill Patients With Coronavirus Disease 2019 (COVID-19). JAMA network open, 2020, 3 (5), e2010478.
- He, X., Yao, F., Chen, J., Wang, Y., Fang, X., Lin, X. et al. The poor prognosis and influencing factors of high D-dimer levels for COVID-19 patients. Scientific reports, 2021, 11 (1), 1830.
- Zhou, F., Yu, T., Du, R., Fan, G., Liu, Y., Liu, Z. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet, 2020, 395 (10229), 1054-1062.
- O'Sullivan, J.M., Gonagle, D.M., Ward, S.E., Preston, R.J.S., O'Donnell, J.S. Endothelial cells orchestrate COVID-19 coagulopathy. The Lancet Haematology, 2020, 7 (8), e553-e5.
- Moll, M., Zon, R.L., Sylvester, K.W., Chen, E.C., Cheng, V., Connell, N.T. et al. VTE in ICU Patients With COVID-19. Chest, 2020, 158 (5), 2130-2135.
- Vanassche, T., Orlando, C., Vandenbosch, K., Gadisseur, A., Hermans, C., Jochmans, K. et al. Belgian clinical guidance on anticoagulation management in hospitalised and ambulatory patients with COVID-19. Acta Clin Belg, 2020, 1-6.
- Hofmann, B.M. Too much technology. BMJ, 2015, 350:h705.
- Moskop, J.C., Iserson, K.V. Triage in medicine, part II: Underlying values and principles. Ann Emerg Med, 2007, 49 (3), 282-287.
- Wilkinson, D. ICU triage in an impending crisis: uncertainty, pre-emption and preparation. J Med Ethics, 2020, 46 (5), 287-288.
- Vergano, M., Bertolini, G., Giannini, A., Gristina, G.R., Livigni, S., Mistraletti, G. et al. Clinical ethics recommendations for the allocation of intensive care treatments in exceptional, resource-limited circumstances: the Italian perspective during the COVID-19 epidemic. Crit Care, 2020, 24 (1), 165.
- Savulescu, J., Vergano, M., Craxì, L., Wilkinson, D. An ethical algorithm for rationing life-sustaining treatment during the COVID-19 pandemic. Br J Anaesth, 2020, 125 (3), 253-258.
- Archard, D., Caplan, A. Is it wrong to prioritise younger patients with covid-19? BMJ, 2020, 369, m1509.
- Richards-Belle, A., Orzechowska, I., Gould, D.W., Thomas, K., Doidge, J.C., Mouncey, P.R. et al. COVID-19 in critical care: epidemiology of the first epidemic wave across England, Wales and Northern Ireland. Intensive Care Med, 2020, 46 (11), 2035-2047.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.