Compte rendu du congrès de l'EAS
Les nouvelles options pour un traitement hypolipémiant intensif sont résumées dans cette intéressante session du congrès annuel de la European Atherosclerosis Society.
L'acide bempedoïque
Ulrich Laufs (Leipzig, Allemagne)
Le traitement médicamenteux hypocholestérolémiant actuel est constitué des statines, de l'ézétimibe et des inhibiteurs de la PCSK9. Pour faire le point sur l'utilisation en pratique quotidienne, il a présenté une récente étude rétrospective qui a examiné le traitement hypocholestérolémiant prescrit chez 311 242 patients à haut risque cardiovasculaire en Allemagne sur une période allant de 2013 à 2018.1 Sur ce plan, on a constaté un changement: l'utilisation de la simvastatine en 2013 a été remplacée par une utilisation plus importante de statines puissantes en 2018, et ce, tant par les médecins généralistes que par les spécialistes. Il est frappant de constater que le traitement combiné avec l'ézétimibe était encore rarement utilisé en 2018 (4,7 % de médecins généralistes et 16,3 % de cardiologues). Sur le plan de l'efficacité, on peut déduire de ces mêmes données qu'une pilule combinée avec une dose fixe de statine et d'ézétimibe entraîne une réduction plus importante du LDL-c que l'utilisation des deux produits administrés séparément (réduction moyenne du LDL-c de 28,4 % [40 mg/dl] vs 19,4 % [27,5 mg/dl], respectivement), vraisemblablement en raison d'une meilleure compliance au traitement. Cependant, malgré l'utilisation de cette pilule combinée, l'objectif actuel en matière de LDL-c (< 55 mg/dl) chez les patients à haut risque n'est atteint que dans 11 % des cas. Deux explications possibles sont suggérées: le traitement hypocholestérolémiant actuel n'est pas assez puissant, ou la dose puissante visée n'est pas atteinte en raison d'effets indésirables associés aux statines.
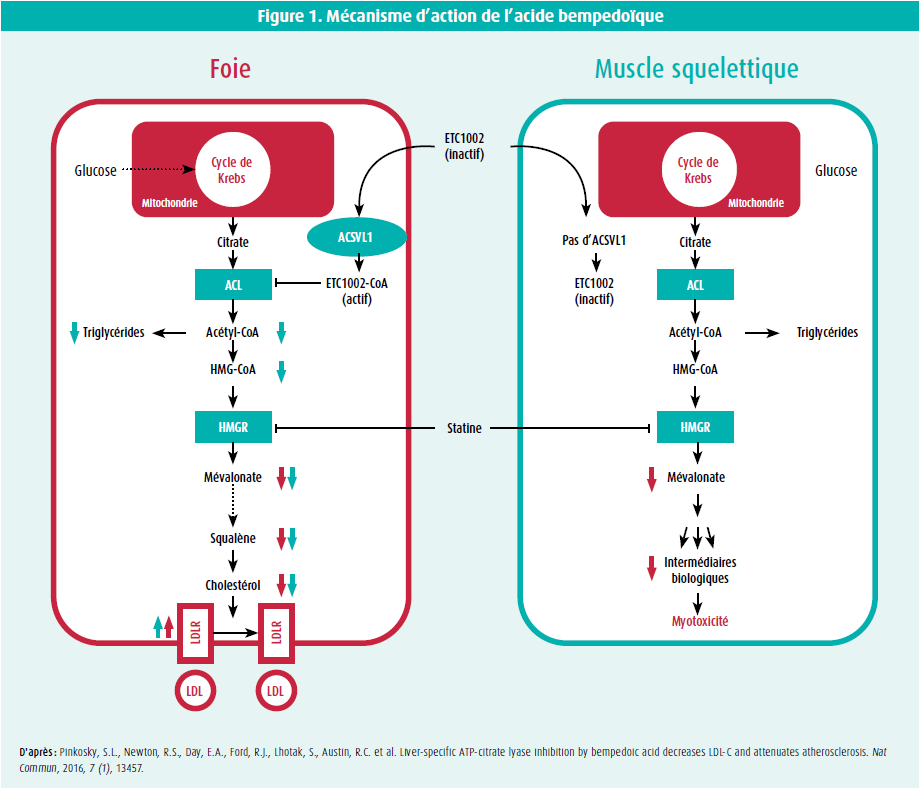
C'est pour résoudre ces problèmes qu'on a développé l'acide bempedoïque, qui inhibe l'ATP citrate lyase (ACLY), une enzyme qui se trouve dans la voie de la biosynthèse du cholestérol, en amont de l'HMG-CoA réductase. Comme les statines, l'acide bempedoïque augmente le nombre de récepteurs du LDL, ce qui permet d'éliminer davantage de LDL-c du sang. Un avantage intéressant par rapport aux statines est que l'acide bempedoïque est une prodrogue qui doit être activée par l'enzyme ACSVL1, qui est absente du tissu musculaire squelettique. Une importante étude de randomisation mendélienne a déjà permis de faire quelques prédictions intéressantes sur l'efficacité et la sécurité de l'acide bempedoïque.2 En étudiant les variants génétiques qui simulent respectivement l'inhibition de l'ACLY et de l'HMG-CoA réductase, on a constaté que l'effet de réduction du LDL-c était presque identique. En outre, les variants de l'ACLY ont un effet similaire à celui d'autres variants génétiques connus sur le plan de la réduction des critères d'évaluation cardiovasculaires, ce qui souligne à nouveau le rôle pathologique du LDL-c dans les maladies cardiovasculaires athéroscléreuses. Enfin, rien n'indique que les variants de l'ACLY soient associés à de quelconques effets néfastes à long terme, ce qui peut servir de critère de substitution pour une exposition à vie à l'acide bempedoïque.
Plusieurs études de phase 3 sont actuellement en cours avec l'acide bempedoïque. Les données groupées de ces études montrent une réduction supplémentaire de 17,8 % du LDL-c lorsqu'il est administré en plus des statines à la dose maximale tolérée, et une réduction de 24,5 % chez les patients intolérants aux statines, recevant de l'acide bempedoïque en monothérapie. 3 Étant donné que l'optimisation de la dose de statine n'est souvent pas faisable en pratique quotidienne, l'association d'une préparation combinée avec de l'acide bempedoïque et de l'ézétimibe pourrait être une option thérapeutique intéressante. En combinaison avec une statine à la dose maximale tolérée, on observe une réduction supplémentaire moyenne de 36,2 % du LDL-c.4,5
Sur le plan de la sécurité, il peut y avoir une élévation limitée réversible de la créatinine et de l'acide urique (vraisemblablement due à une faible inhibition du transporteur OAT2 dans le tubule rénal) et un effet bénéfique potentiel sur le métabolisme du glucose (vraisemblablement dû à une modulation favorable des acides gras).3 Un antécédent de goutte peut être un motif de non-prescription de ce traitement. On ne sait pas encore si ce traitement peut être administré aux patients soignés par hypo-uricémiants.
Les résultats de l'étude CLEAR Outcomes (critères d'évaluation cardiovasculaires concrets) qui a inclus 14 000 patients sont attendus en 2023.6
Double ou triple traitement hypocholestérolémiant combiné
Stephen Nicholls (Monash University, Australie)
Stephen Nicholls souligne le lien de causalité entre le LDL-c et les maladies cardiovasculaires athéroscléreuses. En outre, l'atteinte des objectifs stricts en matière de LDL-c entraînera une certaine régression des plaques chez un grand nombre de patients. Toutefois, environ 30 % des patients qui remplissent l'objectif en matière de LDL-c présentent toujours une progression de la maladie. Ces patients ont plus souvent un diabète, de l'hypertension, un taux de HDL-c plus faible et des valeurs d'ApoB plus élevées (une mesure du nombre de particules de LDL circulantes). En d'autres termes, malgré l'atteinte de l'objectif en matière de LDL-c, la teneur en lipides athérogènes peut rester élevée. Chez ces patients, un traitement hypocholestérolémiant additionnel pourrait avoir un effet bénéfique supplémentaire.

Il existe un certain nombre d'études portant sur un traitement combiné. L'étude PRECISE IVUS a montré un plus grand degré de régression des plaques avec l'ézétimibe en plus de l'atorvastatine, comparativement à l'atorvastatine en monothérapie (LDL-c cible 70 mg/dl).7 L'étude IMPROVE-IT a montré une réduction modeste mais statistiquement significative des critères d'évaluation cardiovasculaires (HR 0,936, IC 0,887 - 0,988, NNT 50) grâce à l'association d'ézétimibe à la simvastatine chez des patients ayant présenté un syndrome coronarien aigu (suivi médian de 6 ans).8 Parmi les inhibiteurs de la PCSK9, tant l'évolocumab que l'alirocumab permettent d'obtenir une réduction supplémentaire du LDL-c d'environ 60 %, en plus du traitement par statine à la dose maximale tolérée. Dans l'étude GLAGOV, on a observé un plus grand degré de régression des plaques avec l'évolocumab en plus de la statine, comparativement à la statine en monothérapie.9 Sur le plan des critères d'évaluation cardiovasculaires, on a observé une réduction de 15 % dans les études FOURIER et ODYSSEY Outcomes, respectivement avec l'évolocumab chez les patients atteints d'une maladie athéroscléreuse prouvée et avec l'alirocumab après un syndrome coronarien aigu.10, 11 Une nouvelle façon d'inhiber la PCSK9 est l'inclisiran, un petit ARN interférent (ARNi) qui réduit le LDL-c de quelque 50 % moyennant une administration intermittente tous les 6 mois. De vastes études portant sur des critères d'évaluation cliniques sont actuellement attendues. Enfin, entre-temps, l'acide bempedoïque a fait son apparition, ce qui a déjà été largement discuté par Ulrich Laufs. Une récente (petite) étude de phase 2 s'est penchée sur l'efficacité du traitement combinant acide bempedoïque 180 mg, ézétimibe 10 mg et atorvastatine 20 mg par jour. Après 6 semaines, on observait une réduction moyenne du LDL-c de 60 %, 90 % des patients atteignant un LDL-c cible < 70 mg/dl et 58 % atteignant un LDL-c < 55 mg/dl.12 Une telle 'trithérapie' constituera une stratégie intéressante pour de nombreux patients, d'autant plus que les données de la récente étude Da Vinci montrent qu'actuellement, nous n'atteignons tout simplement pas les objectifs thérapeutiques pour le LDL-c.13
Symptômes musculaires associés aux statines (SMAS)
Erik Stroes (UMC Amsterdam)
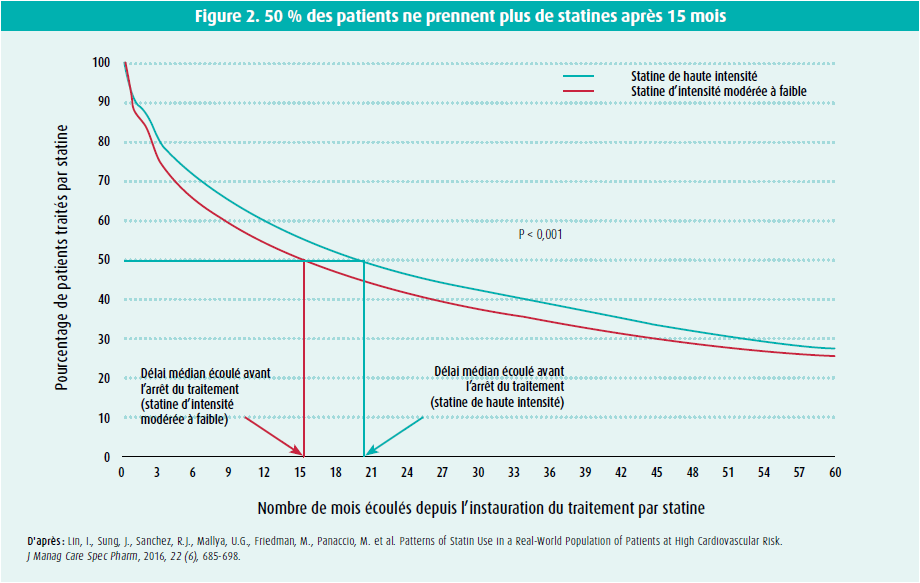
Erik Stroes a parlé des symptômes musculaires associés aux statines (SMAS). S'agitil d'un effet nocebo ou de symptômes réels? Les chiffres américains montrent que près de la moitié des patients arrêtent leur statine après environ 15 mois.14 Le principal motif de l'arrêt de la statine est l'expérience d'effets indésirables ou la crainte de survenue d'effets indésirables.15 Il est frappant de constater que l'arrêt prématuré d'une statine est clairement lié au nombre de messages négatifs véhiculés par les médias.16 On peut donc se demander si les effets indésirables liés aux statines ne sont pas purement et simplement déterminés par les préjugés négatifs des patients (effet nocebo). Les grandes études en aveugle sur les statines, randomisées et contrôlées par placebo, étayent cette hypothèse, étant donné qu'il n'y a pas de différence significative sur le plan des myalgies signalées par les patients entre les groupes statine et placebo.17 L'étude ODYSSEY ALTERNATIVE a sélectionné les patients sur la base d'une intolérance précédente à au moins 2 statines différentes et les a randomisés en aveugle vers de l'alirocumab 75 mg toutes les 2 semaines, de l'ézétimibe 10 mg par jour ou de l'atorvastatine 20 mg par jour. Dans cette étude, on n'a pas observé de différences entre l'ézétimibe et l'atorvastatine en ce qui concerne les effets indésirables musculaires (41 % et 46 %, respectivement), et on a encore observé des effets indésirables musculaires avec l'alirocumab chez 32 % des patients.18 L'étude SAMSON, une étude en aveugle n = 1 dans laquelle les patients ont été randomisés vers la prise séquentielle d'aucun comprimé, d'un placebo ou d'une statine, a également montré que 90 % des plaintes liées aux statines peuvent s'expliquer par l'effet nocebo.19
Tous les SMAS sont-ils donc un effet nocebo? Il existe quelques études randomisées en aveugle qui semblent défendre l'existence des SMAS. L'étude STOMP, à petite échelle, a rapporté davantage de myalgies après l'administration de 80 mg d'atorvastatine par rapport à un placebo pendant 6 mois à 420 volontaires en bonne santé (19 vs 10 patients, p = 0,052).20 L'étude GAUSS-3 a inclus 511 patients intolérants aux statines (au moins 3 préparations différentes) et les a randomisés selon une conception croisée vers de l'atorvastatine 20 mg ou un placebo, chaque fois pendant 10 semaines. Ici aussi, on a observé davantage de symptômes musculaires dans le groupe statine, dans les 2 groupes 'crossover' (respectivement 52 % vs 36 %).21
Dès lors, quelle doit être l'attitude des médecins face aux SMAS? Dans un monde idéal, la meilleure approche serait probablement de mener une étude n = 1 chez tous les patients présentant une intolérance aux statines afin de leur proposer une thérapie cognitive. Il va de soi que la faisabilité pratique de cette approche est un grand point d'interrogation. L'étude TaSINI cherchera à savoir si une étude n = 1 non aveugle réalisée par le médecin généraliste peut augmenter la prise de statines par rapport aux soins standard.22 Dans cette étude, 90 patients suivis en 1re ligne seront randomisés en vue d'une étude n = 1 non aveugle (groupe intervention), une étude n = 1 aveugle (contrôle positif) ou des soins standard (contrôle négatif). Le groupe intervention ne recevra aucun médicament ou recevra de l'atorvastatine à raison de 20 mg par jour, à 3 reprises pendant 4 semaines. Le groupe d'étude en aveugle n = 1 recevra un placebo ou de l'atorvastatine 20 mg par jour. Si l'approche s'avère réalisable, une ECR de plus grande envergure sera planifiée dans un second temps.
Discussion
Quelques questions intéressantes ont encore été posées lors de la discussion, en voici un résumé:
- Il n'existe pas de bons scores validés de myalgies pour différencier les SMAS 'réels' des SMAS correspondant à un effet nocebo. À l'heure actuelle, il n'y a pas de variants génétiques ou de scores permettant d'identifier les 'vrais' SMAS.
- Les inhibiteurs de la PCSK9 peuvent constituer une bonne alternative en cas d'intolérance aux statines, mais ils doivent être réservés aux patients qui ont reçu au moins 3 statines différentes, dont 1 à la dose la plus faible.
- Comme les statines, l'acide bempedoïque ne diminue pas la Lp(a).
- Comme pour d'autres facteurs de risque tels que l'hypertension ou le diabète, le cholestérol doit être contrôlé fréquemment, l'objectif étant d'augmenter rapidement la dose. Il faut éviter la stratégie dite fire and forget, qui consiste à instaurer une statine sans que personne n'assure le suivi.
- L'exposition à vie à un taux élevé de LDL-c est un facteur causal de l'athérosclérose. Un traitement précoce et agressif du cholestérol doit être l'objectif.
- Un traitement combiné est nécessaire. Un traitement hypolipémiant personnalisé sera possible dans un avenir proche.
Références
- Katzmann, J.L., Sorio-Vilela, F., Dornstauder, E., Fraas, U., Smieszek, T., Zappacosta, S. et al. Non-statin lipid-lowering therapy over time in very-high-risk patients: effectiveness of fixeddose statin/ezetimibe compared to separate pill combination on LDL-C. Clin Res Cardiol, 2020.
- Ference, B.A., Ray, K.K., Catapano, A.L., Ference, T.B., Burgess, S., Neff, D.R. et al. Mendelian Randomization Study of ACLY and Cardiovascular Disease. N Engl J Med, 2019, 380 (11), 1033-1042.
- Bays, H.E., Banach, M., Catapano, A.L., Duell, P.B., Gotto, A.M., Laufs, U. et al. Bempedoic acid safety analysis: Pooled data from four phase 3 clinical trials. J Clin Lipidol, 2020, 14 (5), 649-59.e6.
- Ballantyne, C.M., Laufs, U., Ray, K.K., Leiter, L.A., Bays, H.E., Goldberg, A.C. et al. Bempedoic acid plus ezetimibe fixed-dose combination in patients with hypercholesterolemia and high CVD risk treated with maximally tolerated statin therapy. Eur J Prev Cardiol, 2020, 27 (6), 593-603.
- Ballantyne, C.M., Banach, M., Mancini, G.B.J., Lepor, N.E., Hanselman, J.C., Zhao, X. et al. Efficacy and safety of bempedoic acid added to ezetimibe in statin-intolerant patients with hypercholesterolemia: A randomized, placebocontrolled study. Atherosclerosis, 2018, 277, 195-203.
- Nicholls, S., Lincoff, A.M., Bays, H.E., Cho, L., Grobbee, D.E., Kastelein, J.J. et al. Rationale and design of the CLEAR-outcomes trial: Evaluating the effect of bempedoic acid on cardiovascular events in patients with statin intolerance. Am Heart J, 2021, 235, 104-112.
- Tsujita, K., Sugiyama, S., Sumida, H., Shimomura, H., Yamashita, T., Yamanaga, K. et al. Impact of Dual Lipid-Lowering Strategy With Ezetimibe and Atorvastatin on Coronary Plaque Regression in Patients With Percutaneous Coronary Intervention: The Multicenter Randomized Controlled PRECISE-IVUS Trial. J Am Coll Cardiol, 2015, 66 (5), 495-507.
- Cannon, C.P., Blazing, M.A., Giugliano, R.P., McCagg, A., White, J.A., Theroux, P. et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med, 2015, 372 (25), 2387-2397.
- Nicholls, S.J., Puri, R., Anderson, T., Ballantyne, C.M., Cho, L., Kastelein, J.J.P. et al. Effect of Evolocumab on Progression of Coronary Disease in Statin-Treated Patients. JAMA, 2016, 316 (22), 2373.
- Sabatine, M.S., Giugliano, R.P., Keech, A.C., Honarpour, N., Wiviott, S.D., Murphy, S.A. et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med, 2017, 376 (18), 1713-1722.
- Schwartz, G.G., Steg, P.G., Szarek, M., Bhatt, D.L., Bittner, V.A., Diaz, R. et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med, 2018, 379 (22), 2097-2107.
- Rubino, J., Macdougall, D.E., Sterling, L.R., Hanselman, J.C., Nicholls, S.J. Combination of bempedoic acid, ezetimibe, and atorvastatin in patients with hypercholesterolemia: A randomized clinical trial. Atherosclerosis, 2021, 320, 122-128.
- Ray, K.K., Molemans, B., Schoonen, W.M., Giovas, P., Bray, S., Kiru, G. et al. EU-Wide Cross-Sectional Observational Study of Lipid- Modifying Therapy Use in Secondary and Primary Care: the DA VINCI study. Eur J Prev Cardiol, 2020.
- Lin, I., Sung, J., Sanchez, R.J., Mallya, U.G., Friedman, M., Panaccio, M. et al. Patterns of Statin Use in a Real-World Population of Patients at High Cardiovascular Risk. J Manag Care Spec Pharm, 2016, 22 (6), 685-698.
- Bradley, C.K., Wang, T.Y., Li, S., Robinson, J.G., Roger, V.L., Goldberg, A.C. et al. Patient-Reported Reasons for Declining or Discontinuing Statin Therapy: Insights From the PALM Registry. J Am Heart Assoc, 2019, 8 (7).
- Nielsen, S.F., Nordestgaard, B.G. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur Heart J, 2016, 37 (11), 908-916.
- Newman, C.B., Tobert, J.A. Statin intolerance: reconciling clinical trials and clinical experience. JAMA, 2015, 313 (10), 1011-1012.
- Moriarty, P.M., Thompson, P.D., Cannon, C.P., Guyton, J.R., Bergeron, J., Zieve, F.J. et al. Efficacy and safety of alirocumab vs ezetimibe in statin-intolerant patients, with a statin rechallenge arm: The ODYSSEY ALTERNATIVE randomized trial. J Clin Lipidol, 2015, 9 (6), 758-769.
- Wood, F.A., Howard, J.P., Finegold, J.A., Nowbar, A.N., Thompson, D.M., Arnold, A.D. et al. N-of-1 Trial of a Statin, Placebo, or No Treatment to Assess Side Effects. N Engl J Med, 2020, 383 (22), 2182-2184.
- Parker, B.A., Capizzi, J.A., Grimaldi, A.S., Clarkson, P.M., Cole, S.M., Keadle, J. et al. Effect of Statins on Skeletal Muscle Function. Circulation, 2013, 127 (1), 96-103.
- Nissen, S.E., Stroes, E., Dent-Acosta, R.E., Rosenson, R.S., Lehman, S.J., Sattar, N. et al. Efficacy and Tolerability of Evolocumab vs Ezetimibe in Patients With Muscle-Related Statin Intolerance. JAMA, 2016, 315 (15), 1580.
- Tudor, K., Brooks, J., Howick, J., Fox, R., Aveyard, P. Tackling statin intolerance with n-of-1 trials (TaSINI) in primary care: protocol for a feasibility randomised trial to increase statin adherence. BMJ Open, 2020, 10 (2), e033070.
- Pinkosky, S.L., Newton, R.S., Day, E.A., Ford, R.J., Lhotak, S., Austin, R.C. et al. Liver-specific ATP-citrate lyase inhibition by bempedoic acid decreases LDL-C and attenuates atherosclerosis. Nat Commun, 2016, 7 (1), 13457.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.