Présentation de cas
Une dame âgée de 69 ans se présente aux urgences avec des plaintes progressives de dyspnée d'effort et d'oedème des jambes. Elle a des antécédents connus d'atteinte coronarienne, de troubles de la conduction AV de haut grade ayant nécessité l'implantation d'un stimulateur cardiaque et de fibrillation auriculaire (FA) paroxystique ayant justifié l'isolation des veines pulmonaires. À deux reprises, elle a développé une thrombose veineuse profonde dans la jambe gauche, dont un épisode a été compliqué d'embolies pulmonaires bilatérales. Environ 1 an avant sa venue, elle a subi une chirurgie de remplacement valvulaire aortique par une bioprothèse (Carpentier- Edwards Perimount Magna Ease) en raison d'une sténose dégénérative. Lors du dernier contrôle ambulatoire, l'échocardiographie transthoracique (ETT) montrait une fonction systolique normale du ventricule gauche et le gradient moyen à travers la prothèse valvulaire aortique était de 16 mmHg. La patiente est traitée par 20 mg de rivaroxaban, 2,5 mg de bisoprolol, 25 mg de spironolactone, 20 mg de simvastatine et 40 mg de pantoprazole par jour.
L'ETT met en évidence un épaississement échodense de la prothèse valvulaire aortique avec mouvement restrictif des feuillets valvulaires. Le gradient transvalvulaire moyen s'élève à 54 mmHg, ce qui correspond à une surface valvulaire calculée de 0,35 cm2. L'examen transoesophagien confirme la présence d'une masse échodense au niveau de la prothèse, qui entraîne une grave sténose (figures 1 et 2). Le dépistage de l'endocardite infectieuse se révèle négatif. Au vu de la rapidité de l'évolution, la formation d'un pannus et la dégénérescence de la prothèse sont peu probables. Une TDM ciblée de la valve aortique documente des masses hypodenses au niveau des feuillets valvulaires (figure 3), compatibles avec un thrombus. Les contrôles approfondis à la recherche de thrombophilie, maladie inflammatoire chronique et tumeur maladie ne révèlent aucune anomalie.
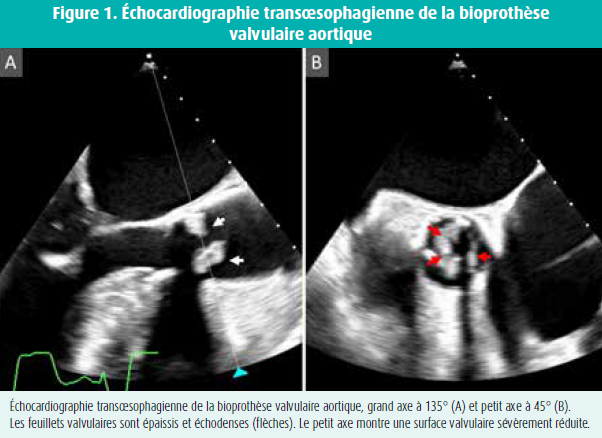
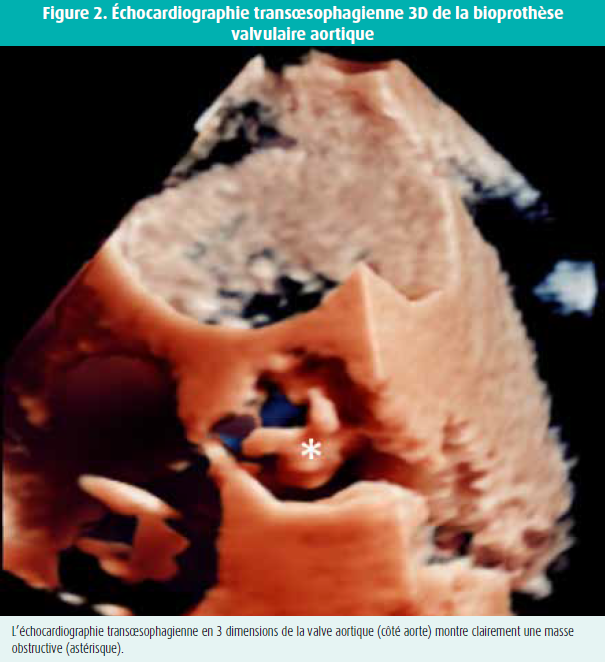

Un traitement par héparine de bas poids moléculaire et warfarine est instauré (INR cible : 2-3). L'évolution est favorable, marquée par une nette diminution du thrombus et une réduction du gradient transvalvulaire aux contrôles échocardiographiques répétés.
Discussion
À l'échelle mondiale, plus de 100 millions de personnes souffrent d'une forme de valvulopathie. La chirurgie de remplacement (ou de réparation) valvulaire est, à ce jour, le standard of care pour le traitement de l'atteinte valvulaire chez les patients exposés à un risque peropératoire faible à modéré. Mais les techniques percutanées, et en particulier le remplacement valvulaire aortique par voie percutanée (transcatheter aortic valve replacement, TAVR), progressent rapidement. Alors qu'elles ont initialement été conçues pour le traitement de patients à haut risque, elles sont de plus en plus appliquées chez des patients à risque modéré et les données en faveur de leur application aux patients à faible risque sont, elles aussi, positives1.
Le nombre d'implantations chirurgicales de prothèses valvulaires mécaniques a fortement régressé au cours des dernières décennies. Aujourd'hui, environ 80 % des valves implantées par chirurgie sont des bioprothèses. L'une des principales explications tient à la population de patients toujours plus vieillissante, présentant de plus en plus de comorbidités et de risque hémorragique, chez qui l'anticoagulation à vie est donc à éviter. En effet, le risque thrombotique associé aux valves biologiques est nettement inférieur à celui des prothèses mécaniques1,2. Les dernières recommandations européennes en date, ainsi que les recommandations américaines récemment adaptées, ne conseillent dès lors pas d'anticoagulation ad vitam après une période initiale de 3 (à 6) mois après l'implantation d'une bioprothèse valvulaire mitrale, tricuspide ou pulmonaire. Après l'implantation d'une bioprothèse valvulaire aortique, les Européens donnent même la préférence (contrairement aux Américains) à l'instauration d'acide acétylsalicylique immédiatement après la chirurgie3,4.
L'incidence exacte de thrombose de bioprothèse (TBP) n'est pas claire, mais elle a été estimée « historiquement », sur la base de données rétrospectives, à < 1 %. Il s'agit vraisemblablement d'une sous-estimation, en raison du manque de suivi échocardiographique de routine des patients, de la visualisation sous-optimale de la valve, du faible niveau de suspicion et de la notification défaillante1.
Dernièrement, Egbe et al. ont publié l'une des plus grandes séries de TBP, en utilisant la base de données de la Mayo Clinic. Les investigateurs ont étudié 397 patients ayant subi une explantation de bioprothèse entre 1997 et 2013. Dans 46 cas (11,6 %), la dysfonction valvulaire a été attribuée à une thrombose. On ne s'attendait pas à un nombre aussi élevé, étant donné que ce diagnostic n'avait été posé que chez 5 % et 13 % des patients avant l'opération, sur la base de l'échocardiographie transthoracique et transoesophagienne, respectivement. Deuxième observation importante, la durée médiane avant explantation était de 24 mois et, dans 15 % des cas, la réintervention n'a été pratiquée qu'après 5 ans5. En effet, cette découverte implique qu'une anticoagulation est bel et bien nécessaire pour certains groupes de patients - qu'il reste à définir - porteurs de bioprothèses valvulaires.
La pathogenèse de la TBP est complexe et n'est, à ce jour, pas totalement élucidée. Il est dès lors très difficile d'identifier les patients à risque qui réclament un suivi plus étroit et, éventuellement, un traitement anticoagulant plus intensif. L'établissement précoce d'un diagnostic correct est néanmoins crucial, d'une part parce que le traitement anticoagulant est souvent efficace et peut éviter la réintervention (cf. supra), et d'autre part pour ne pas exposer inutilement aux risques hémorragiques les patients dont la dysfonction valvulaire n'est pas due à une thrombose.
L'examen clinique n'a qu'une plus-value limitée dans la recherche du diagnostic, étant donné que les symptômes (souvent liés à l'insuffisance cardiaque) surviennent à un stade tardif de l'évolution et que l'auscultation d'un souffle n'est pas inhabituelle après une chirurgie valvulaire. Dans une minorité des cas, la première manifestation est un évènement embolique. Le diagnostic est le plus souvent posé sur la base de l'échocardiographie. La présence de feuillets valvulaires restrictifs épaissis et d'un gradient transvalvulaire en hausse constitue souvent la première piste. Une échocardiographie transoesophagienne (ETO) s'impose généralement pour détecter la cause exacte de la dysfonction valvulaire. Mais il n'est pas toujours simple de faire la distinction, sur la base d'une échocardiographie, entre matériel thrombotique, pannus et végétation1,2. L'étude susmentionnée de la Mayo Clinic a servi de base à la proposition d'un modèle diagnostique qui repose sur 3 paramètres échographiques et 2 paramètres cliniques : 1) augmentation de > 50 % du gradient transvalvulaire par rapport aux valeurs postopératoires dans les 5 ans, 2) épaississement et 3) mouvement anormal des cuspides, 4) FA paroxystique et 5) INR infrathérapeutique. La présence simultanée des 5 facteurs de risque a été associée à une sensibilité, une spécificité, une valeur prédictive positive et une valeur prédictive négative de 76 %, 93 %, 85 % et 89 %, respectivement5.
Grâce au développement de la tomodensitométrie en 4 dimensions (TDM-4D), il est aujourd'hui possible d'étudier la structure et la fonction de bioprothèses valvulaires avec une grande précision. Une masse hypodense et une mobilité réduite des feuillets valvulaires (souvent citées dans la littérature sous les appellations hypo-attenuating leaflet thickening [HALT] et hypo-attenuation affecting motion [HAM]) sont les signes cardinaux d'une thrombose. La TBP infraclinique est bien plus fréquente qu'on le présumait initialement. Dans l'étude SAVORY, par exemple, qui incluait des patients traités tant par chirurgie que par TAVR, les chercheurs ont constaté une HALT et une HAM dans 38 % et 20 % des cas, respectivement. Le processus s'est en outre révélé dynamique. Une TDM de contrôle, réalisée quelques mois plus tard, a montré une progression chez 15 % des patients et une régression chez 11 %6. Les données actuelles ne permettent pas de déterminer clairement l'implication clinique d'une TBP infraclinique, ni les conséquences thérapeutiques qui doivent éventuellement y être associées. À l'avenir, des études prospectives devront élucider si le traitement par anticoagulants peut prévenir la progression d'une TBP infraclinique en TBP clinique et si la TDM- 4D est capable d'identifier les patients à haut risque pour lesquels une anticoagulation à vie serait bénéfique.
Le traitement d'une TBP dépend de l'état hémodynamique du patient, du degré d'obstruction de la prothèse et de la localisation de la valve (à gauche ou à droite). Les patients instables avec obstruction valvulaire dans le coeur gauche (choc cardiogénique, NYHA 4) requièrent une chirurgie urgente. La mortalité est importante (20 %). Une fibrinolyse peut être envisagée, mais la mortalité ne doit pas être sous-estimée (10-15 %). Qui plus est, le risque d'embolisation (12 %) doit être pris en compte, en particulier en présence de thrombi mobiles de grande taille (> 5 mm ou > 0,8 cm2). Contrairement aux TBP dans le coeur droit, où la fibrinolyse est le traitement de premier choix lors de thrombose grave, elle est réservée au traitement des patients inopérables lors de TBP dans le coeur gauche1,2,3,4.
Les antagonistes de la vitamine K (AVK), en association avec l'héparine jusqu'à atteinte de l'INR thérapeutique, forment la pierre angulaire du traitement chez les patients stables. Une récente étude a rapporté une évolution favorable (définie par une diminution de moitié du gradient transvalvulaire) dans 83 % des cas dans les 3 mois suivant l'instauration du traitement. Les non-répondeurs étaient orientés vers une chirurgie. Un résultat notable, observé dans ce groupe, était que l'intervalle de temps entre l'implantation de la valve et la dysfonction était considérablement plus long que chez les répondeurs (médiane de 96 vs 31 mois). Après l'explantation, une formation de pannus - et non une thrombose - s'est en outre avérée être la première cause de dysfonction, ce qui souligne encore une fois qu'il n'est pas simple de distinguer ces deux processus à l'échocardiographie7.
La durée de l'anticoagulation après un épisode de TBP n'est pas clairement établie. Dans une étude récente, une récidive de thrombose a été constatée après 23 mois en moyenne chez 23 % des patients traités avec succès pour une TBP. Au moment du diagnostic, la moitié environ des patients était encore sous AVK, mais des valeurs d'INR infrathérapeutique avaient été notifiées chez une proportion significative d'entre eux dans les mois qui précédaient. Autre résultat, encore plus inquiétant : les patients qui avaient connu un épisode de TBP présentaient un risque beaucoup plus élevé de grave dysfonction valvulaire, nécessitant une réintervention, après 10 années de suivi (68 % vs 24 %)8. Une TBP n'est donc pas bénigne !
Il règne également un certain flou sur le type d'anticoagulants (AVK vs NACO) à utiliser. Selon les recommandations, une anticoagulation « prophylactique » par AVK est nécessaire durant les 3 (à 6) mois qui suivent l'implantation. La poursuite du traitement par anticoagulants n'est ensuite indiquée qu'en présence d'une autre indication, mais les recommandations ne se prononcent pas sur leur type3,4.
Étant donné que la raison est souvent une FA (et que la combinaison avec une bioprothèse n'est pas définie comme une « FA valvulaire »), on opte le plus souvent pour un NACO, dont il est clairement établi que le profil de sécurité est meilleur dans ce groupe de patients. La littérature n'est toutefois pas unanime à ce sujet. L'étude RIVER, qui vient de s'achever, a par exemple établi la non-infériorité du rivaroxaban par rapport à la warfarine chez des patients avec FA et une bioprothèse valvulaire mitrale pour la prévention des thromboses de valves, des AVC et des hémorragies majeures, entre autres9. Une sous-analyse de l'étude ARISTOTLE est parvenue à la même conclusion avec l'apixaban10. D'autre part, des case reports de patients ayant développé une grave TBP sous traitement par NACO ont été publiés11,12. Notre patiente a, elle aussi, développé une thrombose obstructive de prothèse valvulaire en dépit du traitement par rivaroxaban.
Références
- Dangas, G.D., Weitz, J.I., Giustino, G., Makkar, R., Mehran, R. Prosthetic heart valve thrombosis. J Am Coll Cardiol, 2016, 68 (24), 2670-2689.
- Puri, R., Auffret, V., Rodés-Cabau, J. Bioprosthetic valve thrombosis. J Am Coll Cardiol, 2017, 69 (17), 2193-2211.
- Baumgartner, H., Falk, V., Bax, J., De Bonis, M., Hamm, C., Holm, P.J. et al. 2017 ESC/ EACTS guidelines for the management of valvular heart disease. Eur Heart J, 2017, 38 (36), 2739-2791.
- Otto, C.M., Nishimura, R.A., Bonow, R.O., Carabello, B.A., Erwin, J.P., Gentile, F. et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease. J Am Coll Cardiol, 2021, 77 (4), 450- 500.
- Egbe, A.C., Pislaru, S.V., Pellikka P.A., Poterucha, J.T., Schaff, H.V., Maleszewski, J.J. et al. Bioprosthesis valve thrombosis versus structural failure. J Am Coll Cardiol, 2015, 66 (21), 2285-2294.
- Sondegaard, L., De Backer, O., Kofoed, K.F., Jilaihawi, H., Fuchs, H. et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur Heart J, 2017, 38, 2201-2207.
- Egbe, A.C., Connolly, H.M., Pellikka, P.A., Schaff, H.V., Hanna, R., Maleszewski, J.J. et al. Outcomes of warfarin therapy for bioprostethic valve thrombosis of surgically implanted valves. JACC Cardiovasc Interv, 2017, 10 (4), 379-387.
- Petrescu, I., Egbe, A.C., Ionescu, F., Nkomo, V.T., Greason K.L., Pislaru, C. et al. Longterm outcomes of anticoagulation for bioprosthetic valve thrombosis. J Am Coll Cardiol, 2020, 75 (8), 857-866.
- Guimarães, H.P., Lopes, R.D., de Barros E Silva, P.G.M., Liporace, I.L., Sampaio, R.O. et al. Rivaroxaban in patients with atrial fibrillation and a bioprosthetic mitral valve, N Engl J Med, 2020, 383 (22), 2117-2126.
- Guimarães, P.O., Pokorney, S.D., Lopes, R.D., Wojdyla, D.M., Gersh, B.J., Giczewska, A. et al. Efficacy and safety of apixaban vs warfarin in patients with atrial fibrillation and prior bioprosthetic valve replacement or valve repair. Clin Cardiol, 2019, 42 (5), 568- 571.
- O'Callaghan, M., Chester, R., Schenckel, C., Lee, J.Z., Fernandes, R., Shamoun, F. Bioprosthetic valve thrombosis while on novel oral anticoagulant for atrial fibrillation. CASE, 2017, 2 (2), 54-58.
- Bamford, P., Rogers, J., Bassin, L., Kull, A. Large bioprosthetic aortic valve thrombi on DOACs. Heart Lung Circ, 2019, 28 (10), e139-e142.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.