Casus
Een 69-jarige dame presenteerde zich op de spoedgevallendienst met progressieve klachten van inspanningsdyspnoe en pitting oedeem ter hoogte van de benen. Ze was gekend met coronair lijden, hooggradige AV-geleidingsstoornissen waarvoor pacemakerimplantatie en een paroxysmale voorkamerfibrillatie (VKF) waarvoor een pulmonale veneisolatie werd verricht. Tweemaal ontwikkelde ze een diepveneuze trombose in het linkerbeen, waarvan één episode gecompliceerd met bilaterale longembolen. Ongeveer 1 jaar vóór presentatie onderging ze een chirurgische aortaklepvervanging met een bioprothese (Carpentier-Edwards Perimount Magna Ease) wegens degeneratieve stenose. Bij de laatste ambulante controle toonde de transthoracale echocardiografie (TTE) een normale linkerventrikel systolische functie en bedroeg de gemiddelde gradiënt over de aortaklepprothese 16 mmHg. Ze werd behandeld met rivaroxaban 20 mg, bisoprolol 2,5 mg, spironolactone 25 mg, simvastatine 20 mg en pantoprazol 40 mg per dag.
De TTE stelde een echodense verdikking van de aortaklepprothese met restrictieve beweging van de klepblaadjes in het licht. De gemiddelde transvalvulaire gradiënt bedroeg 54 mmHg, overeenkomend met een berekend klepoppervlak van 0,35 cm2. Transoesofageaal onderzoek bevestigde de aanwezigheid van een echodense massa ter hoogte van de prothese met ernstige stenose tot gevolg (figuur 1 en 2). Screening voor infectieuze endocarditis bleek negatief. Pannusvorming, alsook prothesedegeneratie was gelet op de snelheid van de evolutie onwaarschijnlijk. Gerichte CT-scan van de aortaklep documenteerde hypodense massa's ter hoogte van de klepblaadjes (figuur 3), compatibel met trombus. Uitgebreid nazicht voor trombofilie, chronische inflammatoire ziekte en maligniteit stelde geen afwijkingen in het licht.
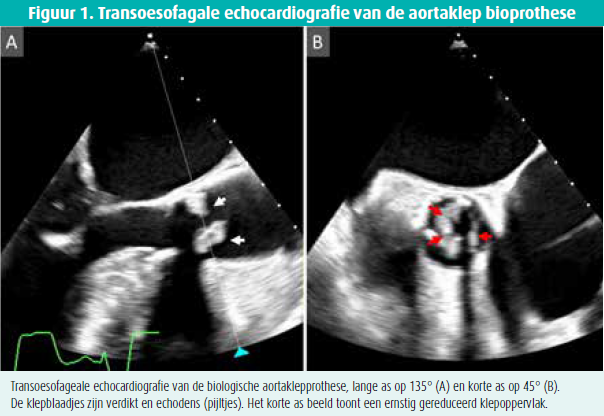
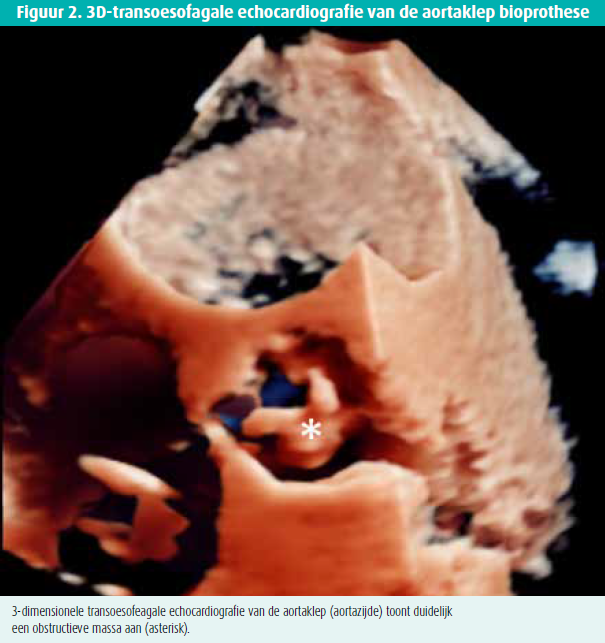
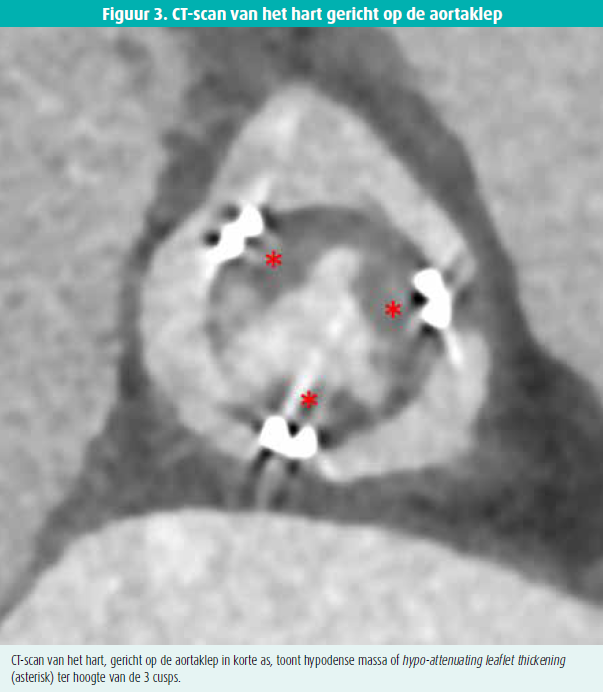
Behandeling met laagmoleculairgewichtheparine en warfarine (met doel INR 2-3) werd gestart. De evolutie was gunstig met duidelijke afname van de trombus en reductie van de transvalvulaire gradiënt bij repetitieve echocardiografische controle.
Bespreking
Meer dan 100 miljoen mensen wereldwijd lijden aan een vorm van valvulaire hartziekte. Heelkundige klepvervanging (of herstel) is tot op heden de standard of care voor de behandeling van kleplijden bij patiënten met laag tot matig peroperatief risico. De percutane technieken, met in het bijzonder de transkatheter aortaklepimplantatie (TAVI) zijn echter in snelle opmars. Daar waar deze initieel ontwikkeld werden voor de behandeling van hoogrisicopatiënten, worden ze steeds meer bij matigrisicopatiënten toegepast en zien ook de data voor toepassing bij laagrisicopatiënten er goed uit1.
De voorbije decennia is het aantal heelkundige implantaties van mechanische klepprothesen sterk gedaald. Tegenwoordig zijn ongeveer 80 % van de chirurgisch geïmplanteerde kleppen biologische prothesen. Een van de voornaamste verklaringen hiervoor is de steeds ouder wordende patiëntenpopulatie met toenemende comorbiditeit en bloedingsrisico, waardoor levenslange behandeling met anticoagulatie ongewenst is. Het trombotische risico van biologische kleppen is immers veel lager dan dat van mechanische1,2. In de laatste Europese en de recent aangepaste Amerikaanse richtlijnen wordt bijgevolg geen ad vitam anticoagulatie aangeraden na een initiële periode van 3 (tot 6) maanden post-implantatie van een biologische mitralis-, tricuspidalis- of pulmonaliskunstklep. Na implantatie van een aortaklepbioprothese, geven de Europeanen (in tegenstelling tot de Amerikanen) zelfs de voorkeur voor acetylsalicylzuur onmiddellijk postoperatief3,4.
De precieze incidentie van trombose van een biologische prothese (BPT) is onduidelijk, maar werd 'historisch', op basis van retrospectieve data, geraamd op < 1 %. Vermoedelijk is dit een onderschatting door de niet altijd routinematige echocardiografische follow-up van patiënten, suboptimale visualisatie van de klep, de lage verdenkingsgraad en de gebrekkige rapportering1.
Recent publiceerde Egbe et al. een van de grootste reeksen van BPT, gebruik makend van de database van de Mayo Clinic. In deze studie werden 397 patiënten bestudeerd die tussen 1997 en 2013 explantatie van een biologische klep ondergingen. In 46 (11,6 %) van de gevallen bleek trombose de oorzaak van de klepdisfunctie. Dit aantal was onverwacht hoog, aangezien deze diagnose preoperatief slechts bij 5 % en 13 % van de patiënten op basis van respectievelijk transthoracale en transoesofeagale echocardiografie werd gesteld. Een tweede belangrijke observatie was dat de mediane duur tot explantatie 24 maanden bedroeg en in 15 % van de gevallen de redo-heelkunde pas na 5 jaar gebeurde5. Deze bevinding impliceert immers dat voor sommige, tot op heden niet gedefinieerde, patiëntengroepen met biologische klepprothesen langdurige (levenslange?) anticoagulatie wél noodzakelijk is.
De pathogenese van BPT is complex en tot op heden niet volledig opgehelderd. Hierdoor is het zeer moeilijk patiënten at risk te identificeren die een meer nauwgezette opvolging en eventueel intensievere anticoagulatietherapie vereisen. Het tijdig stellen van een correcte diagnose is echter cruciaal omdat enerzijds de behandeling met anticoagulantia vaak effectief is en redo-heelkunde kan vermijden (zie verder), anderzijds om patiënten met klepdisfunctie die niet te wijten is aan trombose niet onnodig bloot te stellen aan bloedingsrisico's.
Klinisch onderzoek heeft slechts een beperkte meerwaarde in de diagnostiek aangezien symptomen (vaak gerelateerd aan hartfalen) laattijdig in het verloop optreden en auscultatie van een geruis niet ongewoon is na klepheelkunde. In een minderheid van de gevallen is een embolisch event de eerste presentatie. Doorgaans wordt de diagnose op basis van echocardiografie gesteld. Verdikte restrictieve klepblaadjes en een oplopende transvalvulaire gradiënt bij TTE is vaak het eerste aanknopingspunt. Transoesofeagale echocardiografie (TEE) is meestal noodzakelijk om de precieze oorzaak van de klepdisfunctie te achterhalen. Het is echter niet steeds eenvoudig om op basis van echocardiografie onderscheid te maken tussen trombusmateriaal, pannus en vegetatie1,2. Op basis van de eerder vermelde studie van de Mayo Clinic, werd een diagnostisch model voorgesteld op basis van 3 echografische en 2 klinische parameters: 1) > 50 % toename van de klepgradiënt ten opzichte van de postoperatieve binnen de 5 jaar, 2) verdikking en 3) abnormale beweging van de cusps, 4) paroxysmale VKF en 5) subtherapeutische INR. De aanwezigheid van de 5 risicofactoren samen was geassocieerd met een sensitiviteit, specificiteit, positief en negatief predictieve waarde van respectievelijk 76 %, 93 %, 85 % en 89 %5.
Dankzij de ontwikkeling van de 4-dimensionele CT-scan (4DCT) is het tegenwoordig mogelijk de structuur en functie van biologische klepprothesen zeer nauwkeurig te bestuderen. Hypodense massa en verminderde beweging van de klepblaadjes (in de literatuur vaak aangeduid als hypo-attenuating leaflet thickening [HALT] en hypo-attenuation affecting motion [HAM]) zijn de hallmarks van trombose. Subklinische BPT komt veel frequenter voor dan initieel gedacht. In de SAVORY-studie bijvoorbeeld, waarin zowel patiënten behandeld met chirurgie als TAVI geïncludeerd werden, werd HALT en HAM in respectievelijk 38 % en 20 % van de gevallen vastgesteld. Bovendien bleek het een dynamisch proces. Een controle CT-scan enkele maanden later toonde progressie bij 15 % en regressie 11 % van de patiënten6. Op basis van de huidige data is het onduidelijk wat de klinische implicatie is van subklinische BPT en welk therapeutisch gevolg er eventueel aan gekoppeld moet worden. Prospectieve studies moeten in de toekomst duidelijkheid scheppen of behandeling met anticoagulantia de progressie van subklinische naar klinisch overte BPT kan voorkomen en of 4DCT in staat is om hoogrisicopatiënten te identificeren die baat hebben bij levenslange ontstollingstherapie.
De behandeling van BPT hangt af van de hemodynamische toestand van de patiënt, de obstructiegraad van de prothese en de kleplocatie (links- of rechtszijdig). Voor instabiele patiënten met linkszijdige klepobstructie (cardiogene shock, NYHA 4) is urgente chirurgie noodzakelijk. De mortaliteit is hoog (20 %). Fibrinolyse kan overwogen worden, maar de mortaliteit is niet te onderschatten (10-15 %). Bovendien moet het risico op embolisatie, zeker bij grote (> 5 mm of > 0,8 cm2) mobiele trombi, in acht genomen worden (12 %). In tegenstelling tot rechtszijdige BPT, waar fibrinolyse bij ernstige trombose de eerste keuze behandeling is, is dit voor linkszijdige BPT voorbehouden voor de behandeling van inoperabele patiënten1,2,3,4.
Vitamine K-antagonisten (VKA), in combinatie met heparine tot de therapeutische INR bereikt is, zijn de hoeksteen van de behandeling van stabiele patiënten. In een recente studie werd een gunstige evolutie (gedefinieerd als een halvering van de klepgradiënt) in 83 % van de gevallen gerapporteerd binnen de 3 maanden na opstarten van behandeling. De non-responders werden verwezen voor chirurgie. Een opvallende bevinding in deze groep was dat het tijdsinterval tussen de implantatie van de klep en de disfunctie ervan beduidend langer was in vergelijking met de responders (mediaan 96 versus 31 maanden). Bovendien bleek na explantatie pannusvorming - en niet trombose - de voornaamste oorzaak van disfunctie, wat nogmaals benadrukt dat het echocardiografisch niet eenvoudig is deze twee processen van elkaar te onderscheiden7.
Hoe lang de anticoagulatie moet worden verdergezet na een episode van BPT is onduidelijk. In een recente studie werd bij 23 % van de patiënten die succesvol behandeld werd voor een BPT, een recidief trombose vastgesteld na gemiddeld 23 maanden. Ongeveer de helft van de patiënten werd op het ogenblik van de diagnose nog behandeld met VKA, maar bij een significant deel werden subtherapeutische INR-waarden opgetekend in de maanden voordien. Een nog onrustwekkendere bevinding was dat de patiënten met een doorgemaakte episode van BPT een veel hoger risico hadden op ernstige klepdisfunctie met nood aan redo-heelkunde na 10 jaar follow-up (68 % versus 24 %)8. BPT is bijgevolg niet benigne!
Ook over het type anticoagulans (VKA versus NOAC) dat gebruikt moet worden, heerst heel wat onduidelijkheid. De richtlijnen stellen dat de eerste 3 (tot 6) maanden postimplantatie 'profylactische' anticoagulatie met VKA is noodzakelijk is. Verderzetting van de ontstollingstherapie nadien is enkel aangewezen als er een andere indicatie is, maar er worden geen uitspraken gedaan over het type3,4. Aangezien de reden vaak VKF is (en de combinatie met een bioprothese niet als een 'valvulaire VKF' wordt gedefinieerd), wordt doorgaans - gezien het duidelijk aangetoond beter veiligheidsprofiel in deze patiëntengroep - geopteerd voor een NOAC. De literatuur is echter hierover niet éénduidig. De recent voltooide RIVER-trial toonde bijvoorbeeld non-inferiority van rivaroxaban aan ten opzichte van warfarine bij patiënten met VKF en een biologische mitralisklepprothese voor de preventie van o.a. kleptrombose, stroke en majeure bloeding9. Een subanalyse van de ARISTOTLE-trial met apixaban kwam tot dezelfde conclusie10. Anderzijds zijn er case reports gepubliceerd van patiënten die onder behandeling met NOAC ernstige BPT ontwikkelden11,12. Ook onze patiënte ontwikkelde trombotische klepobstructie ondanks therapie met rivaroxaban.
Refententies
- Dangas, G.D., Weitz, J.I., Giustino, G., Makkar, R., Mehran, R. Prosthetic heart valve thrombosis. J Am Coll Cardiol, 2016, 68 (24), 2670-2689.
- Puri, R., Auffret, V., Rodés-Cabau, J. Bioprosthetic valve thrombosis. J Am Coll Cardiol, 2017, 69 (17), 2193-2211.
- Baumgartner, H., Falk, V., Bax, J., De Bonis, M., Hamm, C., Holm, P.J. et al. 2017 ESC/ EACTS guidelines for the management of valvular heart disease. Eur Heart J, 2017, 38 (36), 2739-2791.
- Otto, C.M., Nishimura, R.A., Bonow, R.O., Carabello, B.A., Erwin, J.P., Gentile, F. et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease. J Am Coll Cardiol, 2021, 77 (4), 450- 500.
- Egbe, A.C., Pislaru, S.V., Pellikka P.A., Poterucha, J.T., Schaff, H.V., Maleszewski, J.J. et al. Bioprosthesis valve thrombosis versus structural failure. J Am Coll Cardiol, 2015, 66 (21), 2285-2294.
- Sondegaard, L., De Backer, O., Kofoed, K.F., Jilaihawi, H., Fuchs, H. et al. Natural history of subclinical leaflet thrombosis affecting motion in bioprosthetic aortic valves. Eur Heart J, 2017, 38, 2201-2207.
- Egbe, A.C., Connolly, H.M., Pellikka, P.A., Schaff, H.V., Hanna, R., Maleszewski, J.J. et al. Outcomes of warfarin therapy for bioprostethic valve thrombosis of surgically implanted valves. JACC Cardiovasc Interv, 2017, 10 (4), 379-387.
- Petrescu, I., Egbe, A.C., Ionescu, F., Nkomo, V.T., Greason K.L., Pislaru, C. et al. Longterm outcomes of anticoagulation for bioprosthetic valve thrombosis. J Am Coll Cardiol, 2020, 75 (8), 857-866.
- Guimarães, H.P., Lopes, R.D., de Barros E Silva, P.G.M., Liporace, I.L., Sampaio, R.O. et al. Rivaroxaban in patients with atrial fibrillation and a bioprosthetic mitral valve, N Engl J Med, 2020, 383 (22), 2117-2126.
- Guimarães, P.O., Pokorney, S.D., Lopes, R.D., Wojdyla, D.M., Gersh, B.J., Giczewska, A. et al. Efficacy and safety of apixaban vs warfarin in patients with atrial fibrillation and prior bioprosthetic valve replacement or valve repair. Clin Cardiol, 2019, 42 (5), 568- 571.
- O'Callaghan, M., Chester, R., Schenckel, C., Lee, J.Z., Fernandes, R., Shamoun, F. Bioprosthetic valve thrombosis while on novel oral anticoagulant for atrial fibrillation. CASE, 2017, 2 (2), 54-58.
- Bamford, P., Rogers, J., Bassin, L., Kull, A. Large bioprosthetic aortic valve thrombi on DOACs. Heart Lung Circ, 2019, 28 (10), e139-e142.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.