Forum veineux
Les veines transportent le sang vers les oreillettes du coeur et contiennent environ 70 % du volume sanguin. Les pathologies veineuses suscitent relativement moins d'intérêt que les pathologies artérielles, ce qui est en partie dû au fait que l'athérosclérose est la cause la plus prévalente de morbi-mortalité cardiovasculaire. Cependant, le réseau veineux est aussi souvent impliqué dans des processus pathologiques. La thromboembolie veineuse (TEV) reste une affection très fréquente et on en a recensé de nombreux cas lors de la pandémie de COVID-19.
Cet article donne un aperçu large mais concis des affections veineuses (à l'exclusion de la TEV périphérique) et du rôle central des veines dans les interventions endovasculaires, avec une attention spécifique prêtée à celles qui concernent le cardiologue. Tant sur le plan diagnostique que thérapeutique, les veines sont une voie d'accès importante et, étant donné l'augmentation considérable des procédures endovasculaires, on observe également une augmentation des traumatismes veineux iatrogènes.
On utilise une classification anatomique en fonction de l'origine des veines : le retour veineux systémique, le retour veineux pulmonaire et le sinus coronaire (figure 1).
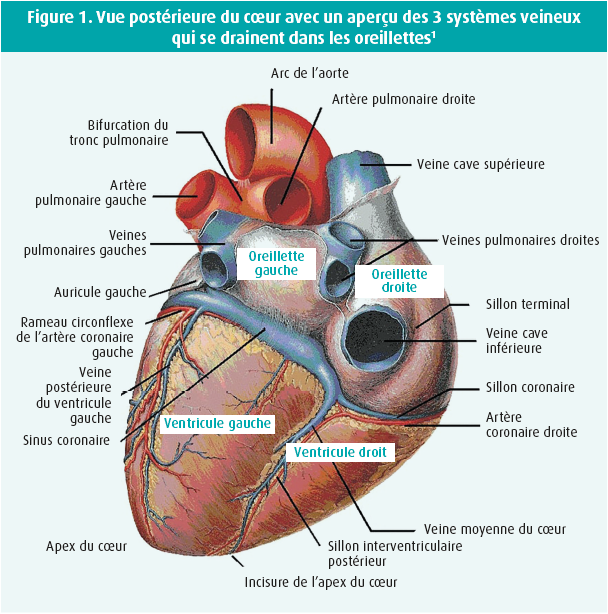
Retour veineux systémique
La veine cave supérieure (VCS) et la veine cave inférieure (VCI) drainent respectivement le sang des parties supérieures (tête, cou et membres supérieurs) et inférieures (abdomen, bassin et membres inférieurs) du corps vers l'oreillette droite. Le syndrome de la VCS est provoqué par une obstruction du flux sanguin dans cette veine et se caractérise par un oedème du visage avec une distension veineuse dans les bras et le thorax. L'obstruction résulte d'une thrombose dans le vaisseau (souvent provoquée par un corps étranger tel qu'un cathéter ou une sonde d'un dispositif cardiaque) ou d'une compression extrinsèque (par exemple par une tumeur pulmonaire, un lymphome ou - rarement - par une hypertrophie lipomateuse du septum interauriculaire).
Une déchirure de la VCS constitue une complication potentielle redoutée de l'extraction transveineuse de sondes. Un bras gonflé après l'implantation d'un pacemaker doit faire penser à une thrombose de la veine sous-clavière. Une VCS gauche persistante est une anomalie vasculaire congénitale : le sang de la moitié supérieure gauche du corps se draine dans le sinus coronaire, via une VCS gauche.
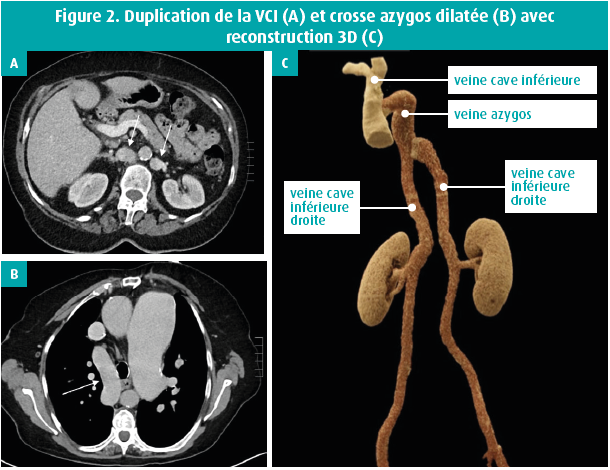
La pathologie spécifique de la veine cave inférieure (VCI) est le plus souvent une malformation congénitale, comme une duplication de la VCI, souvent associée à une continuation azygos ou hémiazygos (figure 2). Dans ce cas, la veine azygos ou hémiazygos est dilatée. Inversement, un ou plusieurs segments de la VCI peuvent être manquants. On a décrit une association avec le syndrome d'asplénie ou de polysplénie.2
L'intervention prophylactique ou thérapeutique la plus connue au niveau de la VCI est la pose d'un filtre chez les patients présentant des thromboses veineuses profondes récidivantes avec une réponse insuffisante ou une contre-indication absolue aux anticoagulants. Ces filtres peuvent être permanents ou temporaires.3
L'angioplastie veineuse percutanée au ballonnet et la pose de stents sont réalisées tant dans les veines périphériques que dans la VCI et la VCS. Les principales applications sont la sténose veineuse chez les patients hémodialysés porteurs d'une fistule AV ou la compression veineuse extrinsèque par une tumeur, par une fibrose ou par des artères comme l'artère iliaque commune droite dans le syndrome de May-Thurner ou l'aorte et l'artère mésentérique supérieure dans le syndrome de casse-noisette. Le stenting du sinus veineux est utilisé chez les patients présentant une hypertension intracrânienne et une sténose d'un sinus dural. Bien que les stents aient initialement été conçus exclusivement pour traiter les pathologies artérielles, on s'intéresse de plus en plus aux stents spécifiquement veineux.4
Comme évolution récente, citons l'implantation hétérotopique de valves caves en cas d'insuffisance tricuspide symptomatique sévère. Dans ce cas, on implante une valve dans la VCI, ce qui entraîne une réduction du reflux du sang vers la veine cave et, partant, de la congestion. Dans la technique 'bi-cave', on place une valve dans la VCI et dans la VCS. Ce traitement percutané peut être utile pour les patients symptomatiques souffrant d'insuffisance tricuspide sévère, qui n'entrent pas en ligne de compte pour une intervention chirurgicale ou une réparation bord à bord, mais il n'a pas encore été validé car les effets sur les critères d'évaluation concrets ne sont pas connus.5
Veines pulmonaires
Les veines pulmonaires acheminent le sang oxygéné des poumons vers l'oreillette gauche. Classiquement, nous avons 2 veines pulmonaires gauches et 2 veines pulmonaires droites, mais ces nombres peuvent varier.
Les principales anomalies anatomiques congénitales sont le retour veineux pulmonaire anormal partiel (RVPAP) et le retour veineux pulmonaire anormal total (RVPAT). Le RVPAP et le RVPAT forment un spectre d'anomalies caractérisées par une connexion anormale d'une, de plusieurs ou de toutes les veines pulmonaires avec une veine systémique ou directement avec l'oreillette droite. Ceci entraîne un shunt gauche-droit avec une surcharge du coeur droit. Le tableau clinique varie d'une découverte fortuite chez un patient asymptomatique à une insuffisance cardiaque droite en cas de RVPAP et à une cyanose postnatale en cas de RVPAT. Le RVPAP est souvent associé à une communication interauriculaire (CIA), qui constitue une deuxième source de shunt gauche-droit et contribue à la surcharge volumique du coeur droit. Le plus souvent, il s'agit d'une CIA secundum ou d'un défect du sinus veineux, dans lequel la paroi entre la veine pulmonaire supérieure droite et la VCS est absente.6 La prise en charge du RVPAP est conservatrice ou chirurgicale en fonction des symptômes, de la fonction du VD, de l'importance du rapport Qp/Qs (shunt gauche-droit significatif à partir de 1,5) et de la présence ou de l'absence du syndrome d'Eisenmenger. Dans le cas d'un RVPAP isolé d'une veine, le shunt est généralement trop petit pour justifier une intervention. Dans le syndrome du cimeterre (scimitar syndrome), les veines pulmonaires droites se drainent dans la VCI et ceci est associé à une dextrocardie, une hypoplasie du poumon droit ou une séquestration pulmonaire. Un cimeterre est un sabre oriental à lame courbe : ce terme a été choisi pour désigner ce syndrome, en raison de la forme de la densité radiographique qui correspond au drainage veineux pulmonaire anormal.
L'importance des veines pulmonaires sur le plan interventionnel réside surtout dans leur potentiel arythmogène et dans la pathogenèse de la fibrillation auriculaire (FA). L'isolation des veines pulmonaires (IVP) comme traitement de contrôle du rythme est un traitement d'ablation lors duquel on crée des cicatrices circulaires autour de l'abouchement des veines pulmonaires dans l'oreillette gauche. Le principal avantage de l'IVP est un meilleur contrôle des symptômes, mais il n'y a pas d'influence sur la mortalité. Les recommandations de classe 1 de l'ESC pour cette ablation par cathéter sont soit une FA associée à une insuffisance cardiaque à fraction d'éjection réduite, soit une FA insuffisamment contrôlée par des antiarythmiques.7
Sinus coronaire
Le sinus coronaire passe dans le sillon coronaire postérieur, contre la face diaphragmatique du coeur, entre l'oreillette gauche et le ventricule gauche (VG). Cette veine draine le sang de la circulation coronaire et débouche au niveau postéro-septal dans l'oreillette droite. Histologiquement, le sinus coronaire fait davantage penser à un 'cinquième ventricule' (e. a. en raison de la présence de fibres myocardiques) qu'à une structure typiquement veineuse.8
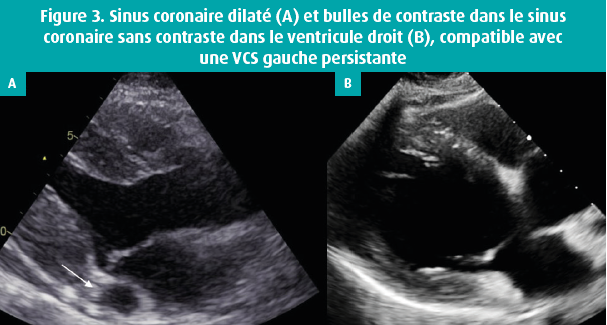
Sur le plan diagnostique, c'est surtout la découverte (fortuite) d'un sinus coronaire dilaté qui s'avère pertinente, car ceci peut être dû à une VCS gauche persistante qui se draine dans le sinus coronaire. Cette anomalie vasculaire est bénigne, mais elle constitue une information pertinente s'il faut implanter un pacemaker ou un DCI. En effet, l'accès au coeur droit est alors plus difficile via la veine sous-clavière gauche. Le diagnostic peut être posé à l'aide d'une échocardiographie de contraste via le bras gauche, lors de laquelle les bulles apparaissent d'abord dans le sinus coronaire dilaté, et seulement ensuite dans l'oreillette droite (figure 3). Chez les individus normaux, le ligament de Marshall est le vestige embryologique de la VCS gauche, et il peut être une source de troubles du rythme comme une tachycardie ou une fibrillation auriculaires, et donc une cible thérapeutique pour l'ablation.9 Une VCS gauche persistante est dans la plupart des cas associée à un défect du sinus coronaire. Il s'agit d'une anomalie du septum interauriculaire située entre l'anneau tricuspide et la VCI avec la valve d'Eustache, et c'est une cause de dilatation inexpliquée du coeur droit et d'hypertension pulmonaire. Enfin, la saturation veineuse en oxygène du sinus coronaire constitue un point important. En moyenne, elle atteint 20-25 % en raison de la forte extraction d'oxygène du tissu myocardique. Lors d'un cathétérisme cardiaque droit, un prélèvement de sang veineux près de l'abouchement du sinus coronaire peut donner lieu à une saturation en oxygène faussement basse dans l'oreillette droite. L'augmentation de la saturation en oxygène entre l'oreillette droite et l'artère pulmonaire peut alors conduire à la conclusion erronée d'un shunt gauche-droit significatif.
Sur le plan thérapeutique, le sinus coronaire est utilisé pour placer une sonde dans le VG par voie transveineuse. Ceci est utilisé en cas de traitement de resynchronisation cardiaque (TRC), où la sonde du VG est préférentiellement placée contre la paroi latérale du VG, et de pacing de la branche gauche, où la sonde est positionnée au niveau septal, contre la branche gauche.
Lors d'un examen électrophysiologique diagnostique, on place un cathéter multipolaire dans le sinus coronaire pour enregistrer les électrogrammes de l'oreillette et du ventricule gauches. Le sinus coronaire sert également de repère près de la fosse ovale lors d'une ponction transseptale. Le sinus coronaire peut constituer un substrat pour une FA et donc une cible thérapeutique pour l'ablation d'une FA. Le sinus coronaire est également important dans d'autres types de tachycardie supraventriculaire. Dans la tachycardie par réentrée nodale auriculo-ventriculaire, les fibres excédentaires gauches peuvent être situées près du sinus coronaire, ce qui permet une ablation par cette voie.10 Un flutter périmitral se produit de manière iatrogène après une IVP ; il peut être traité en créant une ligne d'isthme mitral incluant e. a. des lésions épicardiques depuis le sinus coronaire.
Enfin, mentionnons le Coronary Sinus Reducer, un stent conçu pour traiter l'angor réfractaire en redistribuant le sang vers les zones ischémiques du coeur. Cependant, cette technique est rarement utilisée en pratique.11
Références
- Sobotta, W.J. et al. Sobotta Atlas of human anatomy, Munich: Urban & Schwarzenberg; 1983.
- Oliveira, J.D., Martins, I. Congenital systemic venous return anomalies to the right atrium review. Insights Imaging, 2019, 10 (1), 115. doi: 10.1186/s13244-019-0802-y.
- DeYoung, E., Minocha, J. Inferior vena cava filters: guidelines, best practice, and expanding indications. Semin Intervent Radiol, 2016, 33 (2), 65-70.
- Schwein, A., Georg, Y., Lejay, A. et al. Endovascular Treatment for Venous Diseases: Where are the Venous Stents? Methodist Debakey Cardiovasc J, 2018, 14 (3), 208-213. doi: 10.14797/mdcj-14-3-208
- Sharkey, A., Munoz Acuna, R., Belani, K., Sharma, R.K., Chaudhary, O., Fatima, H., Laham, R., Mahmood, F. Heterotopic caval valve implantation for the management of severe tricuspid regurgitation: a case series. Eur Heart J Case Rep, 2020, 5 (1), ytaa428. doi: 10.1093/ehjcr/ytaa428.
- Lyen, S., Wijesuriya, S., Ngan-Soo, E. et al. Anomalous pulmonary venous drainage: a pictorial essay with a CT focus. J Congenit Heart Dis, 2017, 1, 7. https://doi. org/10.1186/s40949-017-0008-4
- Hindricks, G., Potpara, T., Dagres, N. et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J, 2021, 42 (5), 373-498. doi: 10.1093/eurheartj/ehaa612. Erratum in: Eur Heart J, 2021, 42 (5), 507. Erratum in: Eur Heart J, 2021, 42 (5), 546-547. Erratum in: Eur Heart J, 2021, 42 (40), 4194. PMID: 32860505.
- Barcelo, A., De la Fuente, L.M., Stertzer, S.H. Anatomic and histologic review of the coronary sinus. Int J Morphol, 2004, 22, 331-338.
- Habib, A., Lachman, N., Christensen, K.N., Asirvatham, S.J. The anatomy of the coronary sinus venous system for the cardiac electrophysiologist. Europace, 2009, 11 Suppl 5, v15-21. doi: 10.1093/europace/eup270.
- Rodríguez-Mañero, M., Schurmann, P., Valderrábano, M. Ligament and vein of Marshall: A therapeutic opportunity in atrial fibrillation. Heart Rhythm, 2016, 13 (2), 593-601. doi: 10.1016/j.hrthm.2015.10.018.
- Banai, S., Ben Muvhar, S., Parikh, K.H., Medina, A., Sievert, H., Seth, A., Tsehori, J., Paz, Y., Sheinfeld, A., Keren, G. Coronary sinus reducer stent for the treatment of chronic refractory angina pectoris: a prospective, open-label, multicenter, safety feasibility first-in-man study. J Am Coll Cardiol, 2007, 49 (17),1783-1789. doi: 10.1016/j.jacc.2007.01.061. PMID: 17466229.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.