Veneus forum
Venen transporteren bloed naar de atria van het hart en bevatten ongeveer 70 % van het bloedvolume. Veneuze pathologie krijgt relatief minder aandacht dan arteriële pathologie. Dit kan deels worden verklaard doordat atherosclerose de meest prevalente oorzaak is van cardiovasculaire morbiditeit en mortaliteit. Nochtans is het veneuze netwerk ook vaak betrokken in pathologische processen. Veneuze trombo-embolie (VTE) blijft een zeer frequente aandoening die recent een opflakkering heeft vertoond tijdens de COVID-19-pandemie.
Dit artikel biedt een ruim maar beknopt overzicht van veneuze aandoeningen (perifere VTE buiten beschouwing gelaten) en de centrale rol van venen bij endovasculaire interventies, met specifiek deze relevant voor de cardioloog. Zowel voor diagnostiek als therapie zijn venen een belangrijke toegangsweg en gezien de enorme toename van endovasculaire procedures is er ook een toename van iatrogene veneuze traumata.
Een anatomische indeling wordt gehanteerd op basis van de oorsprong van de venen: de systemische veneuze retour, de pulmonale veneuze retour en de sinus coronarius (figuur 1).
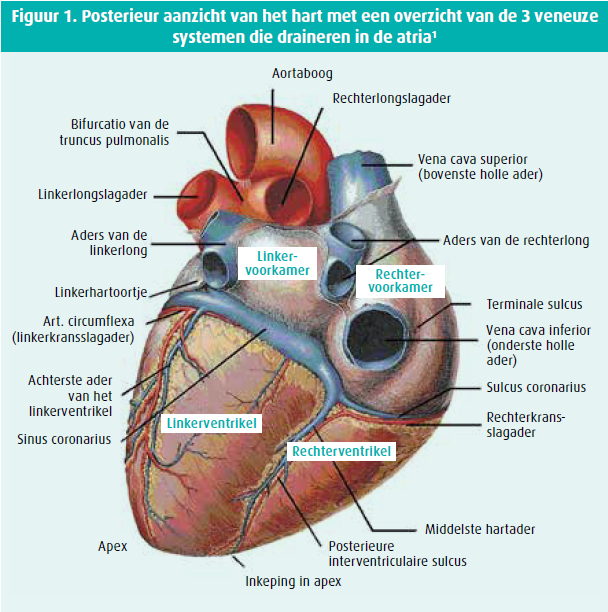
Systemische veneuze retour
De vena cava superior (VCS) en vena cava inferior (VCI) draineren het bloed van respectievelijk de bovenste (hoofd, hals en bovenste ledematen) en de onderste lichaamshelft (abdomen, pelvis en onderste ledematen) naar het rechteratrium.
Het VCS-syndroom ontstaat door een obstructie van de bloedstroom in deze vene en wordt gekenmerkt door oedeem van het gezicht met veneuze distensie in de armen en de thorax. De obstructie ontstaat door een trombose in het bloedvat (vaak veroorzaakt door een vreemd voorwerp zoals een katheter of een lead van een cardiaal device) of door extrinsieke compressie (bijvoorbeeld door een longtumor, lymfoom of zeldzaam door lipomateuze hypertrofie van het interatriaal septum).
Een scheur van de VCS is een gevreesde potentiële complicatie bij transveneuze leadextractie. Een gezwollen arm na pacemakerimplantatie moet doen denken aan een trombose van de vena subclavia. Een persistente linker-VCS is een aangeboren vasculaire afwijking waarbij het bloed van de linker bovenste lichaamshelft via een linker-VCS draineert in de sinus coronarius.
Specifieke pathologie van de vena cava inferior (VCI) is meestal een congenitale malformatie, zoals een ontdubbeling van de VCI, vaak gepaard met azygos of hemiazygos continuatie (figuur 2). Hierbij is de vena azygos of hemiazygos gedilateerd. Omgekeerd kunnen een of meerdere segmenten van de VCI ontbreken. Een associatie met asplenie- of polyspleniesyndroom is beschreven.2
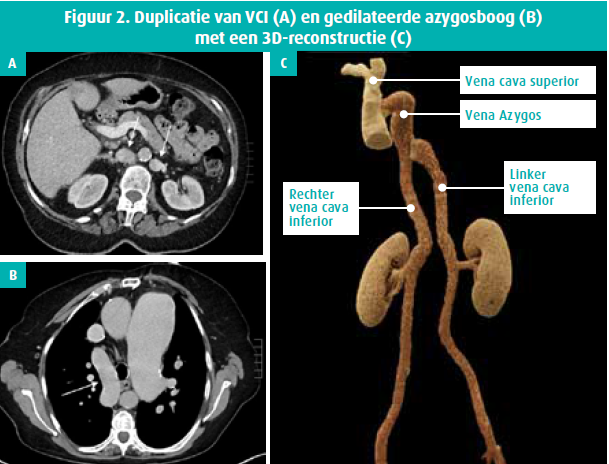
De meest gekende profylactische of therapeutische interventie in de VCI is het plaatsen van een filter bij patiënten met recidiverende diepveneuze trombose met onvoldoende respons op of met een absolute contra-indicatie voor anticoagulantia. Deze filters kunnen permanent of tijdelijk ter plekke blijven.3
Percutane veneuze ballonangioplastie en stenting wordt zowel in de perifere venen, VCI als VCS uitgevoerd. De voornaamste toepassingen zijn de veneuze stenose bij hemodialysepatiënten met een AV-fistel of extrinsieke veneuze compressie door een tumor, door fibrose of door arteriën zoals de rechterarteria iliaca communis bij het may-thurnersyndroom of de aorta en arteria mesenteria superior bij het notenkrakersyndroom. Veneuze sinusstenting wordt toegepast bij patiënten met intracraniële hypertensie en stenose van een durale sinus. Hoewel stents aanvankelijk uitsluitend ontworpen werden om arteriële pathologie te behandelen, is er een groeiende aandacht voor specifieke veneuze stents.4
Een recente evolutie is de heterotopische cavale klepimplantatie bij ernstig symptomatische tricuspidalisinsufficiëntie. Hierbij wordt een klep in de VCI geïmplanteerd wat resulteert in een reductie van de terugstroom van bloed naar de vena cava en van congestie. Bij de bicavale techniek wordt een klep in zowel de VCI als de VCS geplaatst. Deze percutane therapie kan nuttig zijn voor symptomatische patiënten met ernstige tricuspidalisinsufficiëntie die niet in aanmerking komen voor heelkunde of edge-to-edge repair, maar is nog niet gevalideerd omdat de effecten op harde eindpunten niet gekend zijn.5
Pulmonale venen
De pulmonale venen transporteren zuurstofrijk bloed van de longen naar het linkeratrium. Klassiek hebben we twee linker- en twee rechterlongvenen, maar er bestaan variaties in dit aantal.
De voornaamste congenitale anatomische anomalieën zijn de partiële abnormale pulmonale veneuze retour (PAPVR) en de totale abnormale pulmonale veneuze retour (TAPVR). PAPVR en TAPVR vormen een spectrum van afwijkingen gekenmerkt door een abnormale connectie van één, meerdere, of alle longvenen met een systemische vene of rechtstreeks met het rechteratrium. Dit leidt tot een links-rechts shunt met rechterhartoverbelasting. Het klinische beeld varieert van een toevallige vondst bij een asymptomatische patiënt tot rechterhartfalen bij PAPVR en postnatale cyanose bij TAPVR. PAPVR is vaak geassocieerd met een atriumseptum defect (ASD), wat een tweede bron van linksrechts shunt is en bijdraagt tot volumeoverbelasting van het rechterhart. Meestal betreft het een secundum ASD of een sinus venosus defect, waarbij de wand tussen de rechter bovenste pulmonale vene en de VCS ontbreekt.6 Het beleid bij PAPVR is conservatief of chirurgisch herstel afhankelijk van de symptomen, de RV-functie, de grootte van de Qp/Qs-ratio (significante links-rechts shunt vanaf 1,5) en de aan- of afwezigheid van eisenmengersyndroom. Bij geïsoleerde PAPVR van één vene is de shunt meestal te klein om een interventie te rechtvaardigen. Bij het scimitarsyndroom draineren de rechter pulmonale venen in de VCI en is geassocieerd met dextrocardie, hypoplasie van de rechterlong of longsequestratie. Scimitar is Engels voor een oosters gebogen zwaard en verwijst naar de vorm van de radiografische densiteit die overeenkomt met de abnormale pulmonaalveneuze drainage.
Het belang van de pulmonale venen op vlak van interventie ligt vooral in het aritmogene potentieel en de pathogenese van voorkamerfibrillatie (VKF). Pulmonaal vene-isolatie (PVI) als ritmecontroletherapie is een ablatiebehandeling waarbij cirkelvormige littekens worden gecreëerd rondom de uitmonding van de longvenen in het linkeratrium. Het voornaamste voordeel van PVI is een betere symptoomcontrole, maar de mortaliteit wordt niet beïnvloed. De ESC-klasse 1-aanbevelingen voor deze katheterablatie zijn ofwel VKF met hartfalen en gereduceerde ejectiefractie ofwel onvoldoende gecontroleerde VKF met anti-aritmische therapie.7
Sinus coronarius
De sinus coronarius loopt in de posterieure sulcus coronarius, tegen de diafragmazijde van het hart, tussen het linkeratrium en linkerventrikel (LV). Deze vene draineert het bloed van de coronaire circulatie en mondt posteroseptaal uit in het rechteratrium. Histologisch vertoont de sinus coronarius meer kenmerken van een 'vijfde hartkamer', onder andere door de aanwezigheid van myocardvezels, dan van een typische veneuze structuur.8
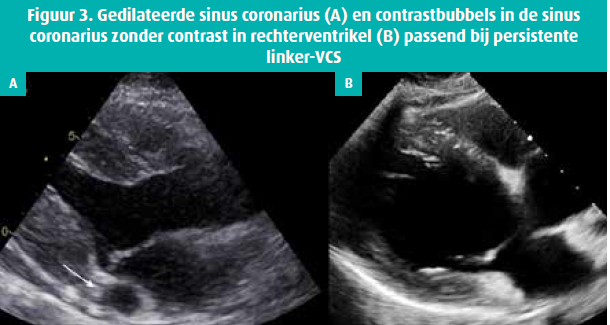
Op diagnostisch vlak is vooral de (toevals)vondst van een gedilateerde sinus coronarius relevant, omdat dit veroorzaakt kan worden door een persistente linker-VCS die draineert in de coronaire sinus. Deze vasculaire anomalie is onschuldig, maar is wel relevante informatie bij de implantatie van een pacemaker of ICD. De toegang tot het rechterhart is dan immers moeilijker via de linker vena subclavia. De diagnose kan gesteld worden met een contrast echocardiografie via de linkerarm waarbij de bubbels eerst in de gedilateerde sinus coronarius verschijnen en daarna pas in het rechteratrium (figuur 3). Het ligament van Marshall is bij normale individuen het embryologisch overblijfsel van de linker-VCS en kan een bron zijn van aritmie zoals atriale tachycardie of voorkamerfibrillatie en bijgevolg ook een therapeutisch doelwit voor ablatie.9 Persistente linker-VCS is in de meeste gevallen geassocieerd met een sinus coronarius defect. Dit is een atriumseptumdefect dat zich situeert tussen de tricuspiedannulus en de VCI met de Eustachian ridge en is een oorzaak van onverklaarde rechterhartdilatatie en pulmonale hypertensie. Tot slot is de veneuze zuurstofsaturatie van de sinus coronarius een belangrijk aandachtspunt. Deze bedraagt gemiddeld 20-25 % wegens de hoge zuurstofextractie van myocardweefsel. Bij een rechterhartkatheterisatie kan men bij afname van een veneus bloedgas nabij de uitmonding van de sinus coronarius een vals-lage zuurstofsaturatie in het rechteratrium meten. De step-up in zuurstofsaturatie tussen het rechteratrium en arteria pulmonalis kan dan tot de verkeerde conclusie van een significante links-rechts shunt leiden.
Op therapeutisch vlak wordt de sinus coronarius gebruikt om via transveneuze weg een LV-lead te plaatsen. Dit wordt toegepast bij cardiale resynchronisatietherapie (CRT), waar de LV-lead preferentieel tegen de laterale LV-wand geplaatst wordt, en bij linkerbundeltak pacing, waar de draad septaal wordt gepositioneerd tegen de linkerbundeltak.
Bij een diagnostisch elektrofysiologisch onderzoek wordt in de sinus coronarius een multipolaire katheter geplaatst om het linkeratriale en ventriculaire electrogram te registreren. De sinus coronarius fungeert ook als herkenningspunt nabij de fossa ovalis bij een transseptale punctie. De sinus coronarius kan een substraat zijn voor VKF en dus een therapeutisch doelwit bij VKF-ablatie. De sinus coronarius is ook belangrijk bij andere types van supraventriculaire tachycardie. Bij atrioventriculaire re-entry tachycardie kan de linkszijdige extraverbinding nabij de sinus coronarius liggen en kan ze langs die weg geableerd worden.10 Een perimitralis flutter ontstaat iatrogeen na een PVI en kan behandeld worden door het creëren van een mitralis isthmus lijn met onder andere epicardiale lesies vanuit de sinus coronarius.
Tot slot vermelden we de Coronary Sinus Reducer, een stent die werd ontworpen om refractaire angor pectoris te behandelen door het bloed te herverdelen naar de ischemische zones van het hart. Deze techniek wordt in de praktijk echter zelden toegepast.11
Referenties
- Sobotta, W.J. et al. Sobotta Atlas of human anatomy, Munich: Urban & Schwarzenberg; 1983.
- Oliveira, J.D., Martins, I. Congenital systemic venous return anomalies to the right atrium review. Insights Imaging, 2019, 10 (1), 115. doi: 10.1186/s13244-019-0802-y.
- DeYoung, E., Minocha, J. Inferior vena cava filters: guidelines, best practice, and expanding indications. Semin Intervent Radiol, 2016, 33 (2), 65-70.
- Schwein, A., Georg, Y., Lejay, A. et al. Endovascular Treatment for Venous Diseases: Where are the Venous Stents? Methodist Debakey Cardiovasc J, 2018, 14 (3), 208-213. doi: 10.14797/mdcj-14-3-208
- Sharkey, A., Munoz Acuna, R., Belani, K., Sharma, R.K., Chaudhary, O., Fatima, H., Laham, R., Mahmood, F. Heterotopic caval valve implantation for the management of severe tricuspid regurgitation: a case series. Eur Heart J Case Rep, 2020, 5 (1), ytaa428. doi: 10.1093/ehjcr/ytaa428.
- Lyen, S., Wijesuriya, S., Ngan-Soo, E. et al. Anomalous pulmonary venous drainage: a pictorial essay with a CT focus. J Congenit Heart Dis, 2017, 1, 7. https://doi. org/10.1186/s40949-017-0008-4
- Hindricks, G., Potpara, T., Dagres, N. et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J, 2021, 42 (5), 373-498. doi: 10.1093/eurheartj/ehaa612. Erratum in: Eur Heart J, 2021, 42 (5), 507. Erratum in: Eur Heart J, 2021, 42 (5), 546-547. Erratum in: Eur Heart J, 2021, 42 (40), 4194. PMID: 32860505.
- Barcelo, A., De la Fuente, L.M., Stertzer, S.H. Anatomic and histologic review of the coronary sinus. Int J Morphol, 2004, 22, 331-338.
- Habib, A., Lachman, N., Christensen, K.N., Asirvatham, S.J. The anatomy of the coronary sinus venous system for the cardiac electrophysiologist. Europace, 2009, 11 Suppl 5, v15-21. doi: 10.1093/europace/eup270.
- Rodríguez-Mañero, M., Schurmann, P., Valderrábano, M. Ligament and vein of Marshall: A therapeutic opportunity in atrial fibrillation. Heart Rhythm, 2016, 13 (2), 593-601. doi: 10.1016/j.hrthm.2015.10.018.
- Banai, S., Ben Muvhar, S., Parikh, K.H., Medina, A., Sievert, H., Seth, A., Tsehori, J., Paz, Y., Sheinfeld, A., Keren, G. Coronary sinus reducer stent for the treatment of chronic refractory angina pectoris: a prospective, open-label, multicenter, safety feasibility first-in-man study. J Am Coll Cardiol, 2007, 49 (17),1783-1789. doi: 10.1016/j.jacc.2007.01.061. PMID: 17466229.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.