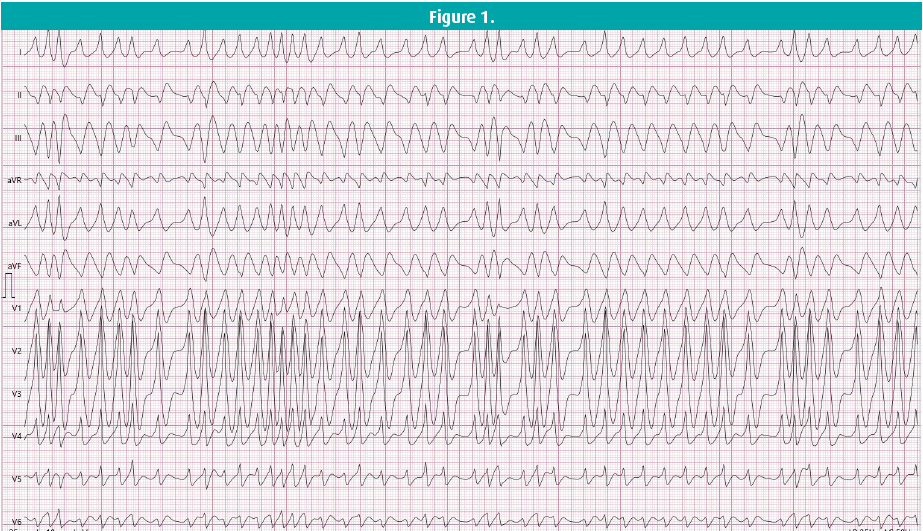
Ce cas clinique concerne une femme de 41 ans sans antécédents médicaux, qui s'est présentée au service des Urgences peu après minuit. Alors qu'elle était au volant, elle a soudainement ressenti des palpitations et une gêne thoracique, suite à quoi elle s'est immédiatement rendue aux Urgences. À son arrivée, elle avait une tension artérielle normale, une fréquence cardiaque fluctuant autour de 200 bpm et présentait de l'hyperventilation. La gazométrie artérielle n'a pas révélé de troubles électrolytiques, et un ECG à 12 dérivations a montré une tachycardie à complexes larges (figure 1). On lui a administré une dose de charge de 300 mg d'amiodarone, sans amélioration clinique. Au contraire, l'arythmie s'est accélérée pour atteindre une fréquence de 250+ bpm. Le cardiologue de garde a été contacté et on a décidé de procéder à une cardioversion électrique, qui a permis d'obtenir un rythme sinusal de 80 bpm. L'ECG suivant (figure 2), réalisé le lendemain, montre un rythme sinusal avec un intervalle PR court et des complexes QRS larges avec une onde delta, pathognomonique d'une pré-excitation. L'échocardiographie était normale. On a posé le diagnostic de syndrome de Wolff-Parkinson-White (WPW).
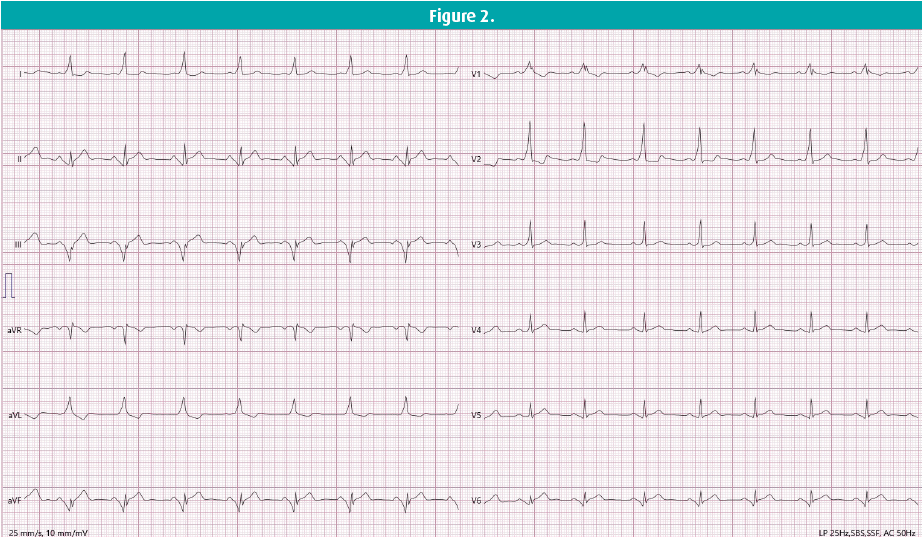
Le syndrome de WPW se caractérise par la présence d'une pré-excitation sur l'ECG - définie par un intervalle PR raccourci, des complexes QRS larges et la présence d'une déflexion initiale lente, limitée (onde delta) au début du complexe QRS en rythme sinusal - en association à des symptômes de tachyarythmie. En l'absence de symptômes, on ne peut parler que d'un 'profil' WPW. La figure 2 illustre les anomalies mentionnées ci-dessus, l'onde delta étant la plus prononcée dans les dérivations DI et V1-V3. Le protocole de reconnaissance automatique de l'ECG a d'ailleurs mal interprété cette situation, en la considérant à tort comme un bloc de branche droit incomplet avec hypertrophie ventriculaire droite.
Le premier ECG (figure 1), enregistré peu avant la cardioversion électrique, montre une tachycardie irrégulière à complexes larges autour de 200-300 bpm. Le diagnostic différentiel d'une tachycardie irrégulière à complexes larges englobe entre autres les torsades de pointes (TdP), la tachycardie supraventriculaire avec bloc de branche ou conduction aberrante, les troubles métaboliques ou électrolytiques et la tachycardie ventriculaire avec conduction variable associée ou complexes ectopiques fréquents. La présence d'un faisceau accessoire peut être à l'origine de plusieurs types de tachycardie, notamment la tachycardie par réentrée auriculo-ventriculaire (TRAV), tant orthodromique qu'antidromique, la fibrillation auriculaire (FA), le flutter auriculaire avec conduction aberrante ou la fibrillation ventriculaire (FV). On peut supposer que, dans ce cas, une TRAV est l'arythmie déclenchante, qui se transforme ensuite en FA avec réponse ventriculaire rapide (peut-être suite à un étirement auriculaire accru et à une augmentation de la pression intra-auriculaire), pour finalement dégénérer en FV. Ce mécanisme est très probablement la cause de la mort subite chez les patients présentant un syndrome de WPW. Dans le présent cas clinique, la figure 1 montre une tachycardie rapide, large, irrégulière (fast, broad, irregular - FBI), soit une FA avec une conduction aberrante. L'axe stable du complexe QRS exclut des TdP.
Dans ce contexte, l'amiodarone est contre-indiqué, car elle ralentit la conduction à travers le noeud AV et favorise la conduction à travers le faisceau accessoire, ce qui peut accélérer la réponse ventriculaire et conduire potentiellement à une FV. D'autres antiarythmiques tels que le vérapamil, le diltiazem, l'adénosine, la digoxine ou les bêtabloquants sont également contre-indiqués pour la même raison. Les seules options pharmacologiques appropriées en cas de FA avec conduction rapide via un faisceau accessoire sont les antiarythmiques de classe IC, notamment la flécaïnide et la propafénone. Chez les patients hémodynamiquement instables, on préfère une cardioversion électrique.
Le profil WPW concerne environ 0,1 à 0,3 % de la population, et on estime que 1 à 2 % de ces sujets développent annuellement une arythmie symptomatique.1,2 L'incidence de mort subite chez les patients asymptomatiques est faible, estimée à 0,13 % par an.3 L'ablation par cathéter est recommandée comme traitement de première ligne chez les patients symptomatiques. Une stratification soigneuse du risque est essentielle pour déterminer chez quels patients asymptomatiques il faut privilégier une ablation par cathéter plutôt qu'un suivi clinique.
Références
- Kobza, R., Toggweilier, S., Dillier, R., Abächerli, R., Cuculi, F., Frey, F. et al. Prevalence of preexcitation in a young population of male Swiss conscripts. Pacing Clin Elektrophysiol, 2011, 34 (8), 949-953.
- Krahn, A.D., Manfreda, J., Tate, R.B., Mathewson, F.A., Cuddy, T.E. The natural history of electrocardiographic preexcitation in men. The Manitoba Follow-up Study. Ann intern Med, 1992, 116 (6), 456-460.
- Obeyesekere, M.N., Leong-Sit, P., Massel, D., Manlucu, J., Modi, S., Krahn, A.D. et al. Risk of arrhythmia and sudden death in patients with asymptomatic preexcitation: a meta-analysis. Circulation, 2012, 125 (19), 2308-2315.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.