Les premières recommandations en matière de cardio-oncologie ont été présentées lors du dernier congrès de l'ESC à Barcelone.1 Ces dernières années, l'augmentation du nombre de patients à risque, des progrès considérables et la diversification des thérapies oncologiques ont entraîné une croissance exponentielle de cette jeune discipline. Les nouvelles recommandations structurent la pratique quotidienne grâce à l'introduction de nouvelles définitions, et elles peuvent servir de point de repère pour les décisions cliniques tout au long du parcours du patient, dès le diagnostic oncologique.
La définition basée uniquement sur la fraction d'éjection est abandonnée et la nouvelle définition de la cardiotoxicité est formulée d'un point de vue plus large, avec le terme générique de toxicité cardiovasculaire liée aux traitements anticancéreux, en abrégé CTR-CVT (cancer therapy related-cardiovascular toxicity) (figure 1).
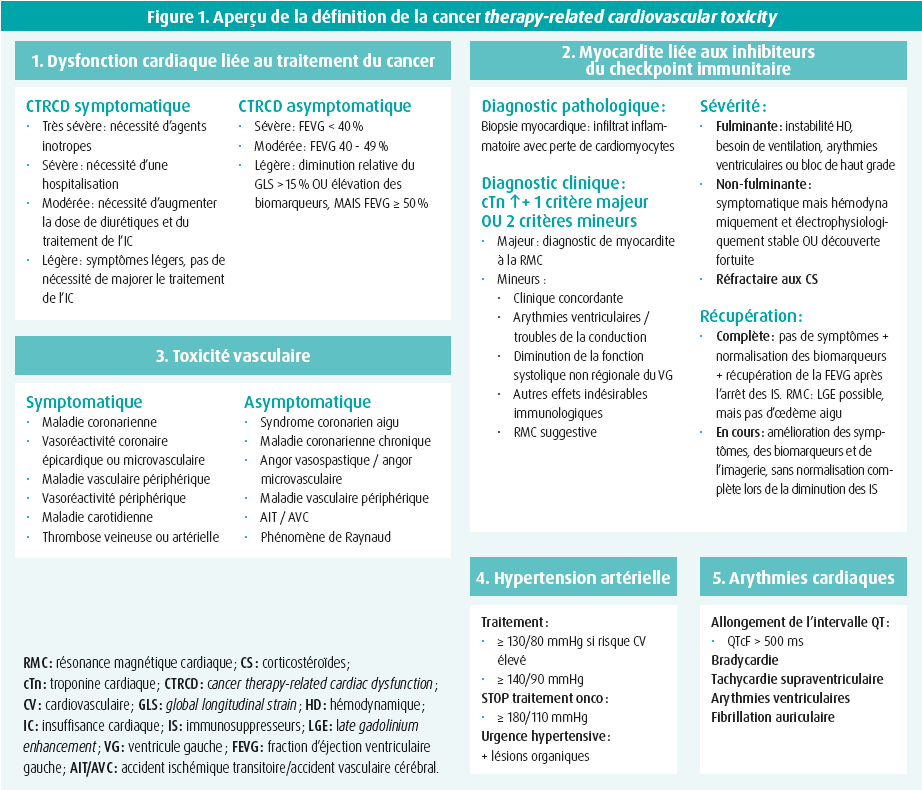
La cardiotoxicité classique, due par exemple à une chimiothérapie à base d'anthracyclines ou à un traitement par trastuzumab est classée ci-dessous comme une « dysfonction cardiovasculaire liée au traitement du cancer » ou CTRCD (cancer therapy-related cardiovascular dysfunction). Ici, le diagnostic n'est plus uniquement basé sur la fonction systolique et la fraction d'éjection du ventricule gauche (FEVG). On établit une distinction entre la CTRCD symptomatique ou asymptomatique. Dans les deux groupes, la sévérité est encore différenciée sur la base de la clinique, de l'imagerie (FEVG, global longitudinal strain [GLS]) et des biomarqueurs circulants (troponine [cTn] et brain natriuretic peptide [BNP]). Ainsi, une élévation isolée de la cTn sans diminution de la FEVG répond déjà à la définition de la CTRCD.
La nouvelle définition de la CTR-CVT inclut en outre des formes moins connues de toxicité, souvent associées à des traitements anticancéreux plus récents. Les définitions de la myocardite liée au traitement, de la toxicité vasculaire, de l'hypertension artérielle et des arythmies cardiaques sont expliquées en détail et contribuent à l'utilisation d'une terminologie commune.
Les recommandations ont été formulées avec deux objectifs principaux : réduire au maximum le risque de cardiotoxicité et éviter l'interruption, l'arrêt ou le retard inappropriés du traitement anticancéreux.
Rôle central de la stratification du risque
L'estimation du risque de cardiotoxicité est au coeur de la prise en charge du patient en cardio-oncologie. Le risque de cardiotoxicité est considéré comme un facteur dynamique, qui varie tout au long du parcours thérapeutique de chaque patient et qui est déterminé par des caractéristiques fixes et modifiables, inhérentes au patient ou au traitement. Une stratification adéquate du risque permet un traitement adapté, l'éducation du patient et un suivi personnalisé, adapté au profil de risque. Une stratification approfondie du risque avant le début du traitement oncologique est donc fortement recommandée pour tous les patients (classe IB). Outre une évaluation approfondie de la présence de facteurs de risque cardiovasculaire (CV) et/ou de maladies cardiovasculaires et une estimation du risque lié au type de cancer et à la thérapie proposée, un ECG fait toujours partie de l'évaluation initiale (classe IC). Pour une évaluation complète et standardisée du risque, on peut utiliser le score de risque de la Heart Failure Association de l'ESC (HFA) et de l'International Cardio-Oncology Society (ICOS): HFA-ICOS2, 3 (classe IIA, C). Pour les patients présentant un risque élevé ou très élevé (classe IC) ou un risque modéré (classe IIB, C), il est recommandé de les adresser à un cardio(onco)logue pour un bilan complémentaire. En pratique, ce sera l'oncologue ou l'hématologue qui effectuera cette stratification. Une bonne collaboration et des modèles d'orientation établis sont donc essentiels.
En outre, en fonction du traitement prévu, des examens complémentaires sont parfois recommandés. L'échocardiographie est recommandée chez tous les patients, préalablement à l'administration d'anthracyclines, de trastuzumab ou d'inhibiteurs du protéasome ou avant une transplantation de cellules souches (classe I) et elle doit être envisagée en cas d'utilisation de VEGFi, d'ITK BCR-ABL, de cellules CAR-T et de tumor-infiltrating lymphocytes (TIL).
Le dosage des biomarqueurs cardiaques circulants (cTn et/ou BNP) chez tous les patients est recommandé avant l'initiation d'une immunothérapie, y compris les inhibiteurs du checkpoint immunitaire et les cellules CAR-T (classe I), et il doit être envisagé avant l'utilisation d'inhibiteurs du protéasome (classe IIA).
Par ailleurs, tant l'échocardiographie que les biomarqueurs ont leur place chez les patients présentant un risque modéré à élevé sur la base de la stratification initiale du risque (classe I-IIB en fonction du risque et du traitement prévu). Ici, il est important de noter qu'un dosage initial des biomarqueurs n'est utile que s'il sera également utilisé pour le dépistage ou le diagnostic d'une CTR-CVT pendant/après le traitement oncologique (classe IC).
En ce qui concerne l'échocardiographie, les recommandations soulignent le rôle des mesures 3D pour la FEVG et l'utilisation du GLS pour l'estimation de la fonction systolique (classe IB et classe IC, respectivement). Le test MUGA n'a encore qu'un rôle limité dans l'évaluation de la FEVG et il n'a de place que lorsque l'échocardiographie n'est pas diagnostique et que l'IRM cardiaque n'est pas disponible (classe IIB, C).
Prévention primaire
La prévention de la CTR-CVT chez tous les patients est basée sur la prise en charge des facteurs de risque cardiovasculaire identifiés lors de l'évaluation initiale. à cet égard, il faut suivre les recommandations générales pour la prévention des MCV4 (classe IC). La modification du style de vie et une activité physique suffisante sont également primordiales dans cette population spécifique de patients.
Indépendamment de ceci, chez les patients à risque élevé ou très élevé, un traitement par IEC/ARB ou bêtabloquants (classe IIA, B) et/ou statines (classe IIA, C) peut être initié avant le début des anthracyclines/du trastuzumab ou de la thérapie ciblée.
Chez les patients à (très) haut risque, la thérapie oncologique peut également être adaptée, en adoptant une formulation liposomale pour les anthracyclines et/ou en administrant préventivement du dexrazoxane (classe IIA, B). Cependant, cette molécule n'est pas remboursée en Belgique pour cette indication.
Suivi personnalisé
Le suivi pendant et après les traitements oncologiques est individualisé en fonction de la stratification du risque et de la thérapie oncologique spécifique.
Dans les recommandations actuelles, vous trouverez un aperçu visuel clair du timing et des outils d'évaluation recommandés pendant et après le traitement, pour les différentes thérapies oncologiques.
Globalement, une évaluation échocardiographique est recommandée pour tous les patients ayant reçu une chimiothérapie à base d'anthracyclines, 12 mois après la fin du traitement (classe IB). En cas de traitement par trastuzumab, une évaluation échocardiographique trimestrielle est recommandée (classe IB). Des évaluations plus fréquentes peuvent être envisagées chez les patients à risque modéré (classe IIA). Elles sont recommandées en cas de risque élevé et très élevé (classe I).
Les inhibiteurs du facteur de croissance endothélial vasculaire induisent une hypertension artérielle chez > 10 % des patients et une surveillance tensionnelle est donc recommandée lors de chaque contact avec le patient (classe IC).
Dans le cadre de l'immunothérapie, un suivi par ECG et cTn est recommandé avant chaque dose pendant les 4 premières administrations puis, s'il est normal, avant chaque troisième dose (classe IIA, B). Une évaluation clinique doit être effectuée tous les 6 à 12 mois chez les patients à haut risque (classe I) et elle doit être envisagée chez les patients à plus faible risque (classe IIB).
Traitement de la CTR-CVT
Si une CTR-CVT se développe pendant ou après le traitement, une mise au point CV par un cardio(onco)logue est indiquée (classe IC).
En cas de CTRCD due aux anthracyclines ou au trastuzumab, on se cible principalement sur la cardioprotection, et le traitement oncologique doit être (temporairement) interrompu, voire arrêté en cas de CTRCD modérée à sévère (classe I). En cas de CTRCD asymptomatique légère, le traitement par anthracyclines peut être poursuivi. L'instauration d'un traitement de l'insuffisance cardiaque (IEC/ARB et/ ou bêtabloquants) est recommandée dans toutes les CTRCD symptomatiques et les CTRCD asymptomatiques sévères/ modérées (FEVG < 50 %) (classe IB). En cas de CTRCD asymptomatique légère, cette recommandation est moins forte (classe IIA, B/C). Avec le trastuzumab, des recommandations similaires s'appliquent, à ceci près que le traitement peut être poursuivi en cas de toxicité asymptomatique modérée (FEVG 40-49 %), sous réserve d'un suivi cardiovasculaire plus fréquent (classe IIA, B).
Il est important de s'attarder sur la prise en charge thérapeutique de la myocardite associée à l'immunothérapie, qui peut être rapidement progressive et qui est associée à un risque de mortalité de 50 %. L'immunothérapie doit toujours être arrêtée immédiatement et il faut rapidement administrer des corticostéroïdes à forte dose (méthylprednisolone 500-1 000 mg IV en bolus 1x/jour pendant (au moins) 3 jours sous surveillance continue de l'ECG (classe IC). La reprise de l'immunothérapie en cas d'évolution favorable avec résolution complète n'est pas exclue, mais elle doit être soigneusement discutée au sein d'une équipe pluridisciplinaire (classe IC).
Tous les patients cancéreux ont un risque intrinsèquement accru de développer une fibrillation auriculaire, et le traitement oncologique peut encore majorer ce risque.5 Tout comme dans la population générale, la nécessité d'une anticoagulation continue dans cette population spécifique est estimée sur la base du score CHA2DS2VASc (classe IIA, C).6 Il est important de noter que le risque thromboemboligène peut être sous-estimé en cas de cancer, de sorte que, même avec un score CHA2DS2VASc plus faible, l'initiation d'une anticoagulation peut déjà être envisagée après une évaluation correcte du risque hémorragique (IIB, C).
Suivi à long terme
Après un traitement par radiothérapie au niveau du coeur et/ou une chimiothérapie à base d'anthracyclines, le risque cardiovasculaire reste élevé7 et une nouvelle stratification du risque CV est recommandée chaque année, de même qu'un ECG et le dosage du BNP (classe IB). Une surveillance échocardiographique régulière est à envisager chez les patients à risque modéré (tous les 5 ans) et à haut risque (1, 3 et 5 ans après la fin du traitement, puis tous les 5 ans) (classe IIA, C). En outre, après une radiothérapie (> 15 Gy), un dépistage non invasif d'une maladie coronarienne peut être effectué tous les 5-10 ans (classe IIA, C).
Les premières recommandations de l'ESC en matière de cardio-oncologie soulignent donc l'importance de l'identification du risque de complications cardiovasculaires avant, pendant et après le traitement oncologique. Cependant, une implémentation réussie n'est possible que moyennant une bonne collaboration entre l'oncologue, l'hématologue et le cardiologue.
Financement
Hanne Boen est titulaire d'une bourse de doctorat du Fonds de la Recherche Scientifique (1192420N). Constantijn Franssen est titulaire d'un mandat clinique de la Fondation contre le Cancer (2021/1594).
Références
- Lyon, A.R., López-Fernández, T., Couch, L.S. et al. 2022 ESC Guidelines on cardiooncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio- Oncology Society (IC-OS): Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC). Eur Heart J, 2022, 43 (41), 4229-4361.
- Lyon, A.R., Dent, S., Stanway, S. et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail, 2020, 22 (11), 1945-1960.
- Rivero Santana, B., Caro Codon, J., Juarez Olmos, V. et al. HFA-ICOS cardiovascular toxicity risk score validation in CARDIOTOX registry. Eur Heart J, 2022, 43 (Supplement_2).
- Visseren, F.L.J., Mach, F., Smulders, Y.M. et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J, 2021, 42 (34), 3227-3337.
- Yun, J.P., Choi, E.K., Han, K.D. et al. Risk of Atrial Fibrillation According to Cancer Type: A Nationwide Population-Based Study. JACC CardioOncol, 2021, 3 (2), 221-232.
- Hindricks, G., Potpara, T., Dagres, N. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J, 2021, 42 (5), 373-498.
- Florido, R., Daya, N.R., Ndumele, C.E. et al. Cardiovascular Disease Risk Among Cancer Survivors. J Am Coll Cardiol, 2022, 80 (1), 22-32.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.