Op het afgelopen ESC-congres in Barcelona werden de eerste richtlijnen rond cardio-oncologie voorgesteld.1 Een stijgende groep patiënten at risk en een enorme vooruitgang en diversificatie van de oncologische therapieën zorgden in de afgelopen jaren voor een exponentiële groei van deze jonge discipline. De nieuwe richtlijnen brengen structuur voor de dagelijkse praktijk door de introductie van nieuwe definities en bieden een houvast voor klinische beslissingen gedurende het volledige traject van de patiënten startende bij de oncologische diagnose.
De definitie enkel op basis van ejectiefractie wordt achterwege gelaten en de nieuwe definitie van cardiotoxiciteit wordt vanuit een breder standpunt gesteld met als overkoepelende term 'cancer therapy related-cardiovascular toxicity' of CTR-CVT (figuur 1).
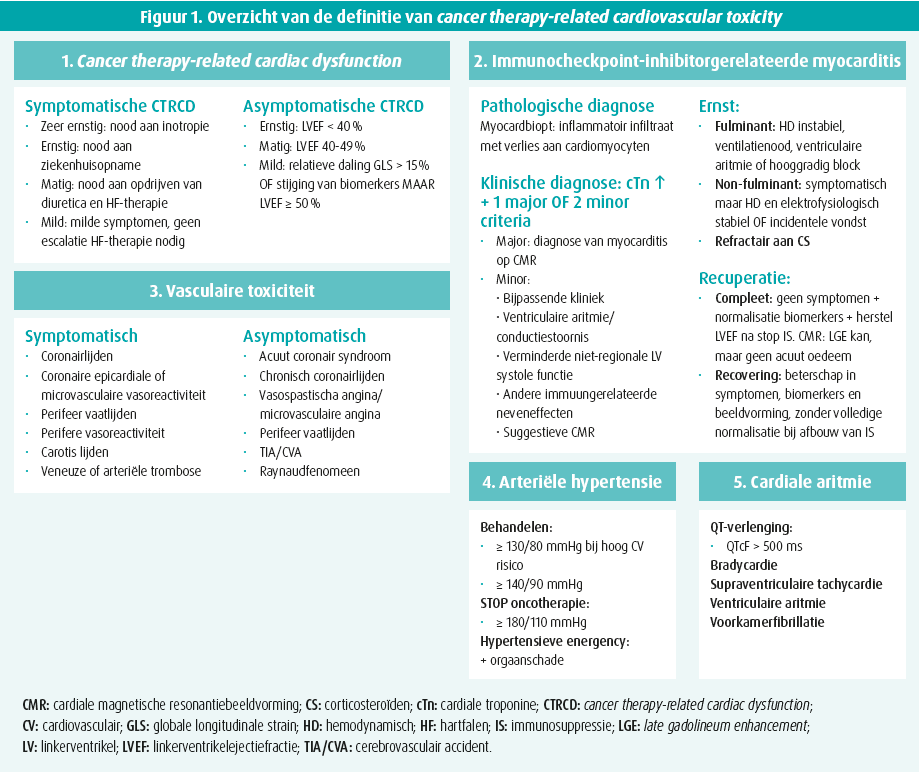
De klassieke cardiotoxiciteit door bijvoorbeeld anthracyclinechemotherapie of behandeling met trastuzumab wordt hieronder ingedeeld als 'cancer therapy-related cardiovascular dysfunction' of CTRCD. De diagnose wordt hierbij niet enkel meer gesteld op basis van systole functie en linkerventrikelejectiefractie (LVEF). Er wordt een verschil gemaakt tussen symptomatische of asymptomatische CTRCD. Binnen beide groepen wordt verder onderscheid gemaakt in ernst op basis van kliniek, beeldvorming (LVEF, globale longitudinale strain [GLS]) en circulerende biomerkers (troponines [cTn] en brain natriuretic petide [BNP]). Een geïsoleerde stijging van cTn zonder daling van de LVEF voldoet dus reeds aan de definitie van CTRCD.
De nieuwe definitie van CTR-CVT omvat daarnaast ook minder bekende vormen van toxiciteit, vaak geassocieerd met nieuwere kankerbehandelingen. Definities voor therapiegerelateerde myocarditis, vasculaire toxiciteit, arteriële hypertensie en cardiale aritmie worden uitgebreid toegelicht en dragen bij tot het gebruik van een gemeenschappelijke terminologie.
De richtlijnen zijn opgesteld met twee grote doelen: het risico op cardiotoxiciteit zo laag mogelijk krijgen en het ongepast onderbreken, stoppen of vertragen van kankertherapie vermijden.
Centrale rol voor risicostratificatie
Centraal in de aanpak van de cardio-oncologische patiënt is de inschatting van het cardiotoxiciteitsrisico. Het cardiotoxiciteitsrisico wordt aanzien als een dynamische factor, variërend over het behandelingstraject van elke individuele patiënt en wordt gevormd door vaste en aanpasbare patiënt- of behandelingskenmerken. Een adequate risicostratificatie geeft de opportuniteit tot een aangepaste behandeling, patiënteducatie en gepersonaliseerde opvolging, aangepast aan het risicoprofiel. Een grondige risicostratificatie voor de start van de oncologische therapie is dan ook sterk aanbevolen voor alle patiënten (klasse IB). Naast een grondige evaluatie van de aanwezigheid van cardiovasculaire (CV) risicofactoren en/of aandoeningen en een inschatting van het risico gerelateerd aan het kankertype en de voorgestelde therapie maakt een ecg steeds deel uit van de initiële evaluatie (klasse IC). Om een complete en gestandaardiseerde risico-inschatting te verrichten, kan worden gebruikgemaakt van de risicoscore van de hartfalenassociatie van het ESC (HFA) en de International Cardio-Oncology Society (ICOS): HFA-ICOS2, 3 (klasse IIA, C). Voor patiënten met een hoog of zeer hoog risico (klasse IC) of matig risico (klasse IIB, C) is doorverwijzing en verdere uitwerking door een cardio-(onco) loog aanbevolen. In de praktijk zal het de oncoloog of hematoloog zijn die deze stratificatie verricht. Een goede samenwerking en vaste doorverwijspatronen zijn dan ook essentieel.
Daarnaast zijn in functie van de geplande therapie soms extra bijkomende onderzoeken aanbevolen. Echocardiografie is aanbevolen bij alle patiënten voorafgaand aan de start van anthracyclines, trastuzumab, proteasoominhibitoren of voor stamceltransplantatie (klasse I) en is te overwegen bij gebruik van VEGFi, BCR-ABL TKI, CAR-T en tumor-infiltrating lymphocytes (TIL).
Bepaling van circulerende cardiale biomerkers (cTn en/of BNP) bij alle patiënten wordt aanbevolen voor de start van immunotherapie, waaronder immunocheckpoint-inhibitoren en CAR-T (klasse I) en is te overwegen voorafgaand aan proteasoominhibitoren (klasse IIA).
Daarnaast is er een plaats voor zowel echocardiografie als biomerkers bij patiënten met matig tot hoog risico op basis van de initiële risicostratificatie (klasse I-IIB afhankelijk van het risico en de geplande therapie). Belangrijk hierbij is te beseffen dat een baseline-biomerkerbepaling enkel nuttig is als deze ook zal worden gebruikt voor de screening of diagnose van CTR-CVT tijdens/na de oncologische behandeling (klasse IC).
Betreffende echocardiografie benadrukken de richtlijnen de rol van 3D-metingen voor LVEF en het gebruik van GLS voor inschatting van de systole functie (respectievelijk klasse IB en klasse IC). MUGA heeft nog slechts een beperkte rol in de evaluatie van LVEF en heeft enkel nog een plaats als echocardiografie niet diagnostisch is en cardiale MR niet beschikbaar is (klasse IIB, C).
Primaire preventie
Preventie van CTR-CVT bij alle patiënten is gebaseerd op de aanpak van de cardiovasculaire risicofactoren geïdentificeerd tijdens de initiële beoordeling. Hierbij worden de algemene richtlijnen voor CVD-preventie gevolgd4 (klasse IC). Ook in deze specifieke patiëntenpopulatie zijn levensstijlmodificatie en voldoende beweging primordiaal.
Bij patiënten met hoog of zeer hoog risico kan los hiervan een behandeling met ACE-I/ARB of bètablokkers (klasse IIA, B) en/of statines (klasse IIA, C) worden gestart voor de start van anthracyclines/ trastuzumab of gerichte therapie.
Bij (zeer)hoogrisicopatiënten kan de oncologische therapie ook worden aangepast onder de vorm van liposomale formulering voor anthracyclines en/of toediening van de preventieve agens dexrazoxan (klasse IIA, B). Dit laatste wordt in België echter niet terugbetaald voor deze indicatie.
Gepersonaliseerde opvolging
Opvolging tijdens en na oncologische behandelingen wordt geïndividualiseerd op basis van de risicostratificatie en de specifieke oncologische therapie.
In de huidige richtlijnen kan u een duidelijk visueel overzicht van de aanbevolen tijdstippen en methodes van evaluatie tijdens en na de behandeling terugvinden voor verschillende oncologische therapieën.
Globaal wordt voor alle patiënten na anthracycline chemotherapie een echocardiografische evaluatie aangeraden 12 maanden na het beëindigen van de therapie (klasse IB). Bij een behandeling met trastuzumab is een driemaandelijkse echocardiografische evaluatie aanbevolen (klasse IB). Frequentere evaluaties zijn te overwegen bij patiënten met een matig risico (klasse IIA) en zijn aanbevolen bij hoog en zeer hoog risico (klasse I).
Vasculaire endotheliale groeifactorinhibitoren geven bij > 10 % van de patiënten aanleiding tot arteriële hypertensie en bloeddrukcontrole is dan ook aanbevolen bij elk patiëntencontact (klasse IC).
Bij immunotherapie is opvolging met ecg en cTn aanbevolen voor elke dosis gedurende de eerste 4 toedieningen, en zo normaal nadien voor elke derde dosis (klasse IIA, B). Elke 6-12 maanden moet een klinische beoordeling worden voorzien voor hoogrisicopatiënten (klasse I) en is dit te overwegen bij lager risico (klasse IIB).
Behandeling van CTR-CVT
Bij het ontstaan van CTR-CVT tijdens of na de behandeling is een CV-oppuntstelling door een cardio(-onco)loog aangewezen (klasse IC).
Bij CTRCD door anthracyclines of trastuzumab wordt voornamelijk ingezet op cardioprotectie en moet de oncologische therapie (tijdelijk) worden onderbroken of gestopt als er matige tot ernstige CTRCD optreedt (klasse I). Bij milde asymptomatische CTRCD kan de behandeling met anthracyclines worden verdergezet. Start van hartfalentherapie (ACE-I/ARB en/of bètablokkers) is aanbevolen bij alle symptomatische CTRCD en ernstige/matige asymptomatische CTRCD (LVEF < 50 %) (klasse IB). Bij milde asymptomatische CTRCD is deze aanbeveling minder sterk (klasse IIA, B/C). Bij trastuzumab gelden gelijkaardige aanbevelingen, met uitzondering dat de behandeling mag worden verdergezet bij matige asymptomatische toxiciteit (LVEF 40-49 %), mits frequentere cardiovasculaire opvolging (klasse IIA, B).
Belangrijk om te vermelden is de therapeutische aanpak van immunotherapiegeassocieerde myocarditis, die snel progressief kan zijn en gepaard gaat met 50 % mortaliteitsrisico. De immunotherapie moet steeds meteen worden gestopt en er moet vroegtijdig worden gestart met een hoge dosis corticosteroïden (methylprednisolon 500-1 000 mg IV bolus 1x/dag gedurende (minstens) 3 dagen onder continue ecg-monitoring (klasse IC). Heropstart van immunotherapie bij een gunstige evolutie met volledige resolutie is niet uitgesloten, maar moet zorgvuldig besproken in een multidisciplinair team (klasse IC).
Alle patiënten met kanker hebben een reeds verhoogd risico op de ontwikkeling van voorkamerfibrillatie, oncologische therapie kan dit risico verder verhogen.5
Noodzaak tot continue anticoagulatie binnen deze specifieke populatie wordt net als in de algemene populatie ingeschat op basis van de CHA2DS2VASc-score (klasse IIA, C).6 Belangrijk hierbij is dat het trombo-emboligene risico bij kanker onderschat kan zijn, dus ook bij een lagere CHA2DS2VASc-score kan start van anticoagulantie reeds worden overwogen na een correcte beoordeling van het bloedingsrisico (IIB, C).
Langetermijnsopvolging
Na behandeling met radiotherapie ter hoogte van het hart en/of anthracycline chemotherapie blijft het cardiovasculaire risico verhoogd7 en is elk jaar een nieuwe CV risicostratificatie aanbevolen, met inbegrip van ecg en bepaling van BNP (klasse IB). Regelmatige echocardiografische controle is te overwegen bij matig- (elke 5 jaar) en hoogrisicopatiënten (1, 3 en 5 jaar na het beëindigen van de therapie, nadien vijfjaarlijks) (klasse IIA, C).
Na radiotherapie (> 15 Gy) kan bovendien elke 5-10 jaar een niet-invasieve screening voor coronairlijden worden voorzien (klasse IIA, C).
De eerste cardio-oncologische ESC-richtlijnen benadrukken dus het belang van het identificeren van het risico op cardiovasculaire complicaties voor, tijdens en na de oncologische behandeling. Een succesvolle implementatie is echter alleen haalbaar als er een goede samenwerking is tussen oncoloog, hematoloog en cardioloog.
Funding
Hanne Boen is houder van een doctoraatsbursaal van het Fonds Wetenschappelijk Onderzoek (1192420N). Constantijn Franssen is houder van een klinisch mandaat van Stichting tegen Kanker (2021/1594).
Referenties
- Lyon, A.R., López-Fernández, T., Couch, L.S. et al. 2022 ESC Guidelines on cardiooncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio- Oncology Society (IC-OS): Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC). Eur Heart J, 2022, 43 (41), 4229-4361.
- Lyon, A.R., Dent, S., Stanway, S. et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail, 2020, 22 (11), 1945-1960.
- Rivero Santana, B., Caro Codon, J., Juarez Olmos, V. et al. HFA-ICOS cardiovascular toxicity risk score validation in CARDIOTOX registry. Eur Heart J, 2022, 43 (Supplement_2).
- Visseren, F.L.J., Mach, F., Smulders, Y.M. et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J, 2021, 42 (34), 3227-3337.
- Yun, J.P., Choi, E.K., Han, K.D. et al. Risk of Atrial Fibrillation According to Cancer Type: A Nationwide Population-Based Study. JACC CardioOncol, 2021, 3 (2), 221-232.
- Hindricks, G., Potpara, T., Dagres, N. et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J, 2021, 42 (5), 373-498.
- Florido, R., Daya, N.R., Ndumele, C.E. et al. Cardiovascular Disease Risk Among Cancer Survivors. J Am Coll Cardiol, 2022, 80 (1), 22-32.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.