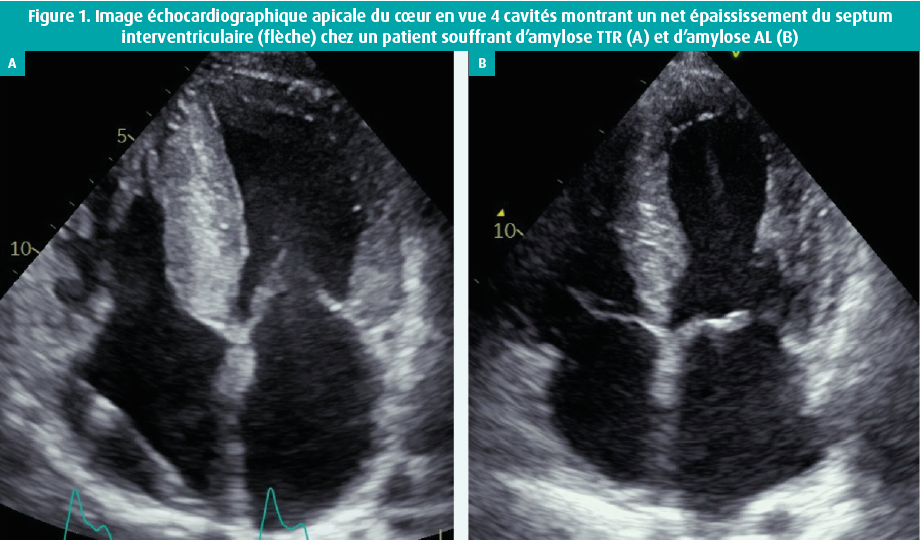
L'amylose est une affection caractérisée par le dépôt extracellulaire anormal de fibrilles de protéines.1, 2 La maladie survient lorsqu'une protéine précurseur perd sa sous-structure native, acquiert une configuration aberrante en feuillets bêta, précipite et perturbe ainsi la fonction cellulaire et tissulaire. Plusieurs organes peuvent être touchés en cas d'amylose systémique. Dans le coeur, l'affection entraîne une cardiomyopathie restrictive progressive3, une diminution de la fonction cardiaque, des troubles de la conduction, des troubles du rythme, une valvulopathie et/ou une insuffisance cardiaque droite.4 Deux types importants d'amyloïde provoquent plus de 95 % des cas d'amylose cardiaque, à savoir l'amylose à chaînes légères (AL) et l'amylose à transthyrétine (TTR). L'amylose à chaînes légères peut survenir lorsque le patient possède un clone de plasmocytes qui produit une fraction de chaînes légères amyloïdogènes. L'amylose à transthyrétine peut se présenter sous une forme acquise (chez les patients âgés, amylose dite « sénile ») ou dans le cadre d'une maladie génétique héréditaire.2, 5-7 Bien qu'elle soit rare4, l'amylose cardiaque est davantage diagnostiquée ces dernières années, grâce à une meilleure conscientisation et à l'amélioration des techniques diagnostiques8-10 (figure 1). En outre, la disponibilité de nouvelles thérapies ou indications thérapeutiques (p. ex. stabilisateurs ou éliminateurs de la transthyrétine, inhibiteurs ciblés des plasmocytes ou transplantation d'organe) entraîne une demande accrue de caractérisation exacte des dépôts amyloïdes11, 12, typiquement sur la base d'une biopsie tissulaire.5, 13 Dans cet article, nous expliquons comment le pathologiste diagnostique et caractérise l'amylose cardiaque. Nous ébauchons en outre la contribution potentielle de l'analyse protéomique basée sur la spectrométrie de masse, une technique analytique moderne de plus en plus utilisée pour le diagnostic clinique.
Méthodes histologiques pour la mise en évidence et le typage de l'amyloïde
L'examen histologique reste la référence pour le diagnostic de l'amylose.6, 14, 15 La biopsie endomyocardique est réalisée lors d'un cathétérisme cardiaque droit. Pour ce faire, on effectue au moins 3 prélèvements au niveau du septum ventriculaire droit. Les biopsies sont de préférence acheminées fraîches ou réfrigérées (0-4 °C) vers un laboratoire de pathologie proche, expérimenté dans le diagnostic de l'amylose. Pour que les biopsies ne sèchent pas, on peut placer une gaze humide à côté des biopsies dans le récipient. Le transport 'frais' permet de congeler une des biopsies pour l'immunofluorescence. Les deux autres biopsies sont alors fixées dans du formol tamponné et traitées pour former des blocs de paraffine dont on réalisera des coupes. Il est essentiel que le formulaire de demande soit complet et qu'il reprenne bien les renseignements cliniques.
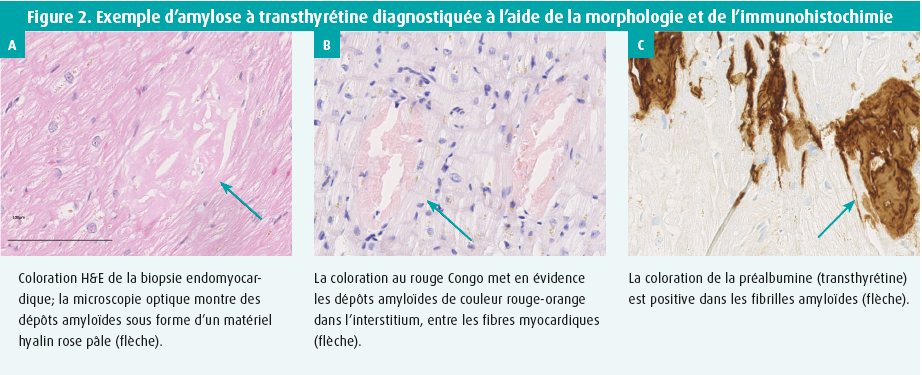
Le pathologiste examine au microscope les biopsies, colorées notamment au rouge Congo.16, 17 Le rouge Congo se lie aux fibrilles amyloïdes et présente une couleur rouge-orange typique qui vire au vert en lumière polarisée.15 Bien qu'il s'agisse d'une technique invasive, la biopsie endomyocardique est beaucoup plus sensible que les biopsies extracardiaques (telles que les biopsies de graisse abdominale et de moelle osseuse) pour le diagnostic de l'amylose systémique.18
Alors que la coloration au rouge Congo peut détecter les dépôts amyloïdes dans les biopsies, l'immunohistochimie peut aider à caractériser l'amyloïde trouvée (figure 1). L'immunohistochimie est une technique qui utilise un colorant lié à des anticorps monoclonaux spécifiques pour visualiser des protéines ou des épitopes spécifiques. De cette manière, la transthyrétine ou les chaînes légères peuvent également être mises en évidence. La technique est bien établie et peu coûteuse. L'inconvénient est que la sensibilité et la spécificité sont variables dans l'amylose, parce qu'une coloration aspécifique peut se produire. En effet, tant les chaînes légères que la transthyrétine sont des molécules abondamment présentes dans le sang.19-21 De plus, la plupart des laboratoires ne disposent pas d'anticorps pour les sous-types rares, de sorte que les types d'amylose ApoAI, APoAIV et AFib restent sous-détectés.22, 23 De ce fait, la littérature indique que l'immunohistochimie ne parvient pas à caractériser correctement l'amyloïde dans 20-25 % des cas.22 Une alternative à l'immunohistochimie est l'utilisation de la microscopie immunoélectronique14, 18, 24, lors de laquelle le problème de la coloration de fond disparaît. Cependant, même dans ce cas, les types rares restent sous-détectés en raison de la nécessité de réactifs spéciaux.
Microdissection au laser et analyse protéomique basée sur la spectrométrie de masse
Une alternative intéressante pour le diagnostic de l'amylose est l'analyse protéomique par spectrométrie de masse de biopsies tissulaires.
Pour ce faire, toutes les protéines présentes dans les coupes de tissus inclus en paraffine sont d'abord extraites dans un tampon riche en détergent, au moyen de chaleur et d'ultrasons (protocole HYPERsol) (figure 3). Pour augmenter la sensibilité, les zones présentant des dépôts amyloïdes peuvent être excisées préalablement dans les coupes de la biopsie endomyocardique, à l'aide de la microdissection au laser.16 Ici, les régions colorées au rouge Congo sont excisées au laser sous contrôle microscopique et collectées de manière spécifique. Ensuite, les protéines extraites sont identifiées par chromatographie en phase liquide couplée à la spectrométrie de masse en tandem ou LC-MS/MS.25
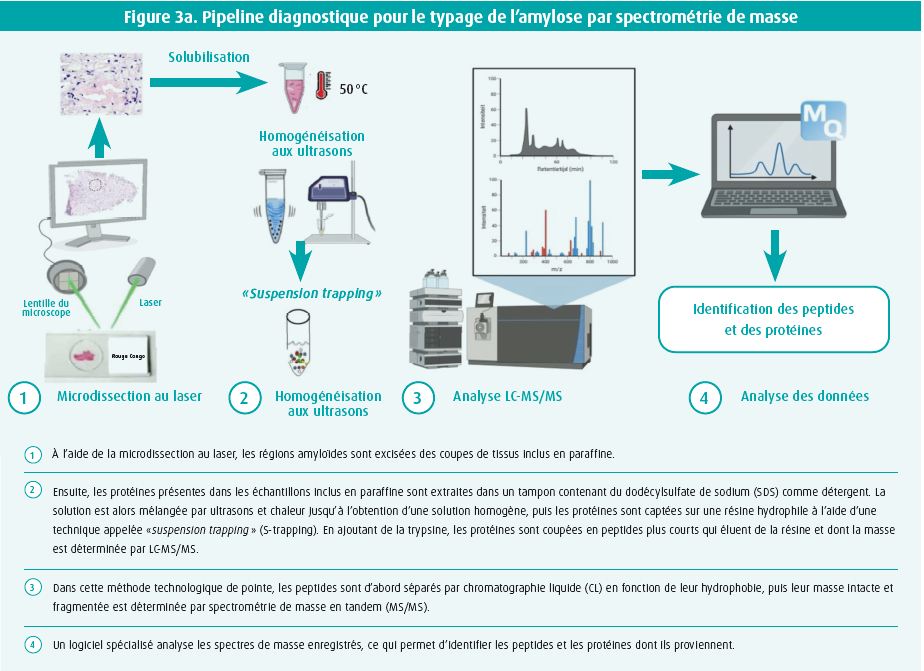
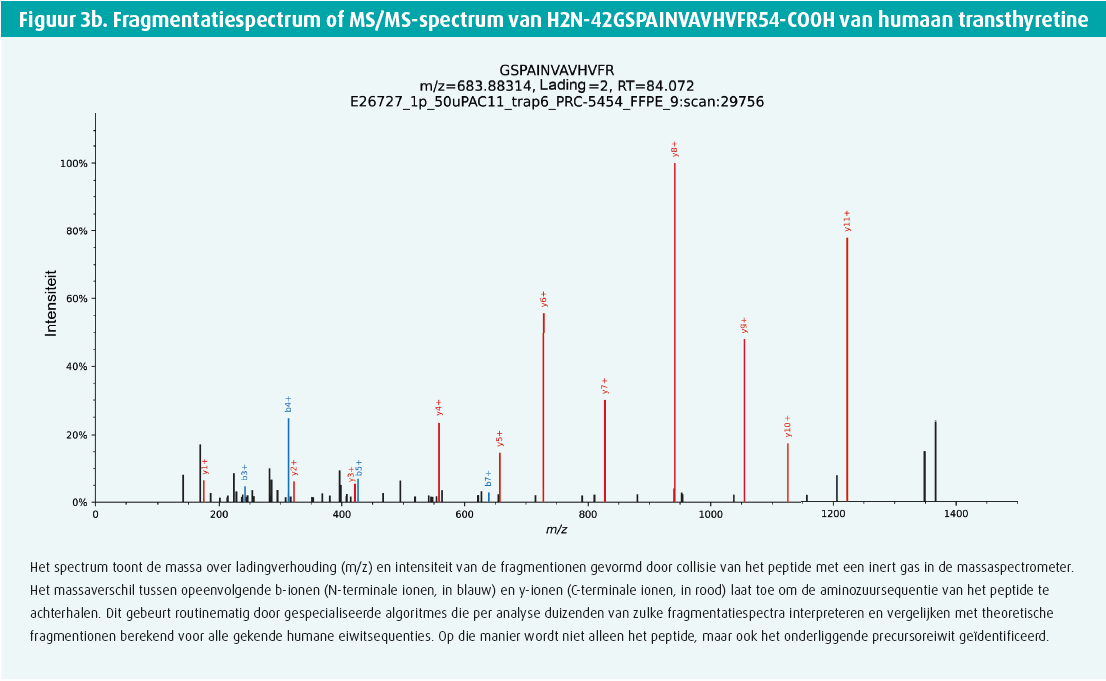
Pour l'analyse LC-MS/MS, les protéines sont coupées en peptides plus courts à l'aide d'enzymes. Ces peptides sont ensuite séparés sur la base de l'hydrophobie sur une chromatographie liquide (LC) couplée à un spectromètre de masse. Les peptides qui éluent de la colonne chromatographique sont immédiatement ionisés pour une détermination de masse sur le spectromètre de masse couplé. Cet appareil effectue deux types de mesures de masse (spectrométrie de masse en tandem ou MS/MS). D'une part, il mesure la masse des peptides intacts et, d'autre part, il fragmente également les peptides et mesure la masse des fragments résultants (figure 3). à partir de ces deux types de spectres de masse, un logiciel spécialisé peut ensuite retrouver la séquence des peptides ainsi que l'identité des protéines précurseurs. De cette manière, on obtient une vue d'ensemble des protéines présentes dans le lysat de tissu ainsi qu'une indication de leur abondance. Dans certaines études, l'ajout d'un logiciel spécialisé permet même de distinguer la forme héréditaire de la forme acquise de l'amylose à transthyrétine.26
études protéomiques récentes portant sur le sous-typage de l'amylose cardiaque
La plupart des études confirment la valeur ajoutée de l'analyse LC-MS/MS pour le diagnostic de l'amylose, avec une amélioration de la sensibilité et de la spécificité comparativement à l'immunohistochimie (tableau 1).
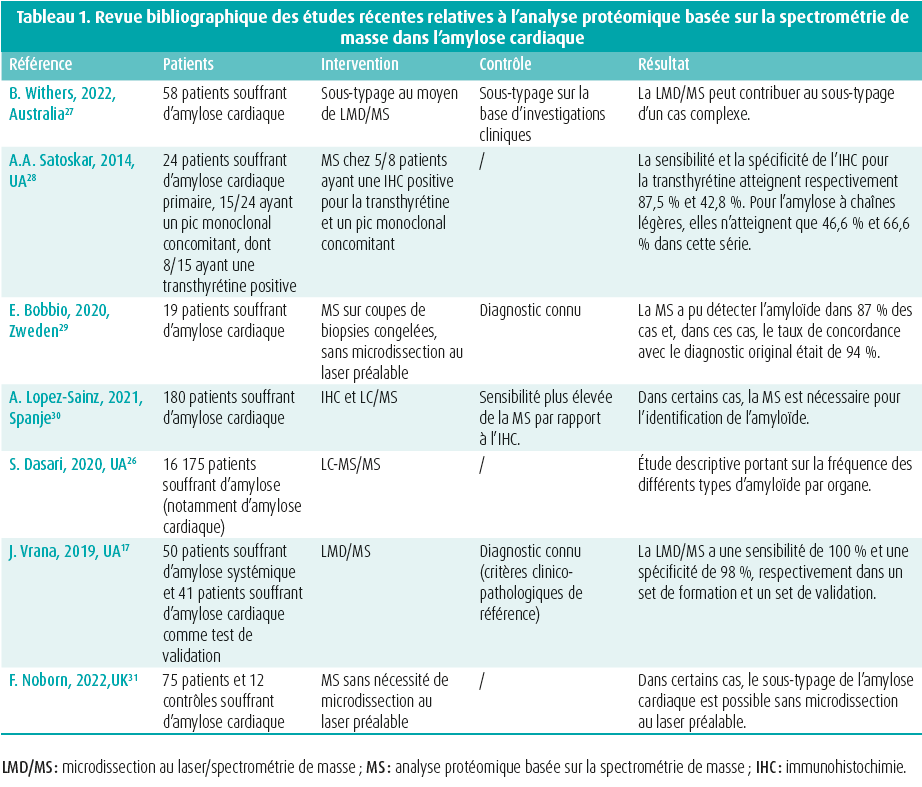
Cependant, l'analyse LC-MS/MS ne fait actuellement pas partie du diagnostic de routine en Belgique, bien que plusieurs centres universitaires, dont l'UZ Gent-VIB, soient en train de développer un pipeline. Ce test diagnostique reste relativement coûteux et exigeant en main-d'oeuvre. Néanmoins, l'analyse LC-MS/MS offre une perspective pour les cas où le diagnostic par immunohistochimie pose des difficultés ou en cas de discordances avec la clinique, en particulier lorsque des conséquences thérapeutiques significatives (et souvent coûteuses) sont en jeu.
Résumé et discussion
L'évolution de la maladie, le pronostic et le traitement de l'amylose cardiaque dépendent largement du type d'amyloïde. L'examen au microscope optique avec coloration au rouge Congo et l'immunohistochimie des biopsies tissulaires reste une méthode de première ligne pour le diagnostic et le sous-typage, malgré les limitations existantes (sensibilité et spécificité suboptimales). Dans les cas complexes, l'analyse protéomique basée sur la spectrométrie de masse peut être un complément précieux pour identifier le type d'amyloïde avec un degré élevé de certitude.19
Références
- Martinez-Naharro, A., Hawkins, P.N., Fontana, M. Cardiac amyloidosis. Clin Med (Lond), 2018, 18, 30-35.
- Garcia-Pavia, P., Rapezzi, C., Adler, Y., Arad, M., Basso, C., Brucato, A. et al. Diagnosis and treatment of cardiac amyloidosis: a position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J, 2021, 42, 1554-1568.
- Rubin, J., Maurer, M.S. Cardiac Amyloidosis: Overlooked, Underappreciated, and Treatable. Annu Rev Med, 2020, 71, 203-219.
- Flodrova, P., Flodr, P., Pika, T., Vymetal, J., Holub, D., Dzubak, P. et al. Cardiac amyloidosis: from clinical suspicion to morphological diagnosis. Pathology, 2018, 50, 261-268.
- Castiglione, V., Franzini, M., Aimo, A., Carecci, A., Lombardi, C.M., Passino, C. et al. Use of biomarkers to diagnose and manage cardiac amyloidosis. Eur J Heart Fail, 2021, 23 (2), 217-230.
- Maleszewski, J.J. Cardiac amyloidosis: a clinical and pathological review. Diagn Histopathol, 2022, 28 (4), 181-191.
- Maurer, M.S., Perry, E., Comenzo, R., Semigran, M., Rapezzi, C. Addressing Common Questions Encountered in the Diagnosis and Management of Cardiac Amyloidosis. Circulation, 2017, 135, 1357-1377.
- Rossi, M., Varrà, G.G., Porcari, A., Saro, R., Pagura, L., Lalario, A. et al. Re-Definition of the Epidemiology of Cardiac Amyloidosis. Biomedicines, 2022, 10, 1566-1573.
- Gilstrap, L.G., Dominici, F., Wang, Y., El-Sady, S., Singh, A., Carli, M.F.D. et al. Epidemiology of Cardiac Amyloidosis-Associated Heart Failure Hospitalizations Among Fee-for- Service Medicare Beneficiaries in the United States. Circ Heart Fail, 2019, 12 (6), e005407.
- Bonderman, D., Pölzl, G., Ablasser, K., Agis, H., Aschauer, S., Auer-Grumbach, M. et al. Diagnosis and treatment of cardiac amyloidosis: an interdisciplinary consensus statement. Wien Klin Wochenschr, 2020, 132, 742-761.
- Benson, M.D., Kluve-Beckerman, B., Zeldenrust, S.R., Siesky, A.M., Bodenmiller, D.M., Showalter, A.D. et al. Targeted suppression of an amyloidogenic transthyretin with antisense oligonucleotides. Muscle Nerve, 2006, 33, 609-627.
- Varga, C., Dorbala, S., Lousada, I., Polydefkis, J.M., Wechalekar, A., Maurer, S.M. et al. The diagnostic challenges of cardiac amyloidosis: A practical approach to the two main types. Blood reviews, 2021, 45.
- Hafeez, A.S., Bavry, A.A. Diagnosis of Transthyretin Amyloid Cardiomyopathy. Cardiol Ther, 2020, 9, 85-95.
- Prochorec-Sobieszek, M., Bilińska, Z.T., Grzybowski, J., Michalak, E., Jakubowska, E., Sobieszczańska-Małek, M. et al. Cardiac amyloidosis diagnosed by endomyocardial biopsy. Clinical, histopathological, immunohistochemical and ultrastructural studies. Kardiol Pol, 2005, 63, 20-35.
- Banypersad, S.M., Moon, J.C., Whelan, C., Hawkins, P.N., Wechalekar, A.D. Updates in cardiac amyloidosis: a review. J Am Heart Assoc, 2012, 1 (2), e000364.
- Wisniowski, B., Wechalekar, A. Confirming the Diagnosis of Amyloidosis. Acta Haematol, 2020, 143 (4), 312-321.
- Vrana, J.A., Gamez, J.D., Madden, B.J., Theis, J.D., Bergen, R., Dogan, A. Classification of amyloidosis by laser microdissection and mass spectrometry-based proteomic analysis in clinical biopsy specimens. Blood, 2009, 114 (24), 4957-4959.
- Ash, S., Shorer, E., Ramgobin, D., Vo, M., Gibbons, J., Golamari, R. et al. Cardiac amyloidosis - A review of current literature for the practicing physician. Clin Cardiol, 2021, 44 (3), 322-331.
- Röcken, C., Schwotzer, E.B., Linke, R.P., Saeger, W. The classification of amyloid deposits in clinicopathological practice. Histopathology, 1996, 29 (4), 325-335.
- Röcken, C., Sletten, K. Amyloid in surgical pathology. Virchows Arch, 2003, 443 (1), 3-16.
- Espina, V., Wulfkuhle, J.D., Calvert, V.S., VanMeter, A., Zhou, W., Coukos, G. et al. Laser-capture microdissection. Nat Protoc, 2006, 1 (2), 586-603.
- Gilbertson, J.A., Theis, J.D., Vrana, J.A., Lachmann, H., Wechalekar, A., Whelan, C. et al. A comparison of immunohistochemistry and mass spectrometry for determining the amyloid fibril protein from formalin-fixed biopsy tissue. J Clin Pathol, 2015, 68 (4), 314-317.
- Joury, A., Faaborg-Andersen, C., Quintana, R.A., daSilva-deAbreu, A., Nativi-Nicolau, J. Diagnostic Tools for Cardiac Amyloidosis: A Pragmatic Comparison of Pathology, Imaging and Laboratories. Curr Probl Cardiol, 2022, 101106.
- Frenzel, H., Schwartzkopff, B., Kuhn, H., Lösse, B., Thormann, J., Hort, W. et al. Cardiac amyloid deposits in endomyocardial biopsies. Light microscopic, ultrastructural, and immunohistochemical studies. Am J Clin Pathol, 1986, 85 (6), 674-680.
- Haver, D.V., Dendooven, A., Impens, F. Proteomics-based analysis and diagnosis of formalin-fixed paraffin-embedded amyloidosis samples. 2021.
- Dasari, S., Theis, J.D., Vrana, J.A., Rech, K.L., Dao, L.N., Howard, M.T. et al. Amyloid Typing by Mass Spectrometry in Clinical Practice: a Comprehensive Review of 16,175 Samples. Mayo Clin Proc, 2020, 95 (9), 1852-1864.
- Withers, B., McCaughan, G., Hayward, C., Kotlyar, E., Jabbour, A., Rainer, S. et al. Clinical characteristics and prognosis of cardiac amyloidosis defined by mass spectrometry-based proteomics in an Australian cohort. Intern Med J, 2020, 52 (1), 69-78.
- Satoskar, A.A., Efebera, Y., Hasan, A., Brodsky, S., Nadasdy, G., Dogan, A. et al. Strong transthyretin immunostaining: potential pitfall in cardiac amyloid typing. Am J Surg Pathol, 2011, 35 (11), 1685-1690.
- Bobbio, E., Bollano, E., Esmaily, S., Thomsen, C., Noborn, F., Sihlbom, C. et al. Clinical Diagnosis and Subtyping of Cardiac Amyloidosis by Mass Spectrometry. J Heart Lung Translplant, 2020, 39 (4, Supplement), S234-S235.
- López-Sainz, Á., Hernandez-Hernandez, A., Gonzalez-Lopez, E., Domínguez, F., Restrepo- Cordoba, M.A., Cobo-Marcos, M. et al. Clinical profile and outcome of cardiac amyloidosis in a Spanish referral center. Rev Esp Cardiol (Engl Ed), 2021, 74 (2), 149-158.
- Noborn, F., Thomsen, C., Vorontsov, E., Bobbio, E., Sihlbom, C., Nilsson, J. et al. Subtyping of cardiac amyloidosis by mass spectrometry-based proteomics of endomyocardial biopsies. Amyloid, 2022, 1-13.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.