Considérations particulières concernant la fibrillation auriculaire sur voie accessoire
L'amiodarone, antiarythmique de classe III selon la classification de Vaughan-Williams, exerce une action sur les différents canaux ioniques du myocarde, avec essentiellement un effet majeur sur la période réfractaire et la repolarisation cellulaire. Elle agit également en inhibant de manière non compétitive les récepteurs bêta-adrénergiques.1-4
La description publiée récemment par Von Kemp et al. dans ce journal du cas clinique concernant l'utilisation de l'amiodarone pour le traitement aigu d'une fibrillation auriculaire (FA), associée à une réponse ventriculaire rapide sur voie accessoire, a retenu toute notre attention.5 Il paraît important à ce sujet de faire le point sur l'utilisation de l'amiodarone dans les arythmies supraventriculaires en général, et plus spécifiquement dans la fibrillation atriale (FA). Il est d'autre part utile d'analyser son action par voie intraveineuse (IV) en administration aiguë par rapport au traitement oral (PO). La présence d'une voie accessoire lors de l'installation d'une FA servira de base à la discussion à ce propos. Nous mentionnerons à cette occasion l'utilisation des différents antiarythmiques dans cette situation particulière. Nous préciserons par ailleurs quelques éléments de diagnostic différentiel de ces rythmes rapides, irréguliers à QRS larges.
Utilisation de l'amiodarone dans les tachycardies supraventriculaires
L'amiodarone a été préconisée de longue date pour le traitement aigu et chronique de plusieurs formes d'arythmie supraventriculaire.6,7 Les dernières recommandations internationales lui attribuent la plupart du temps des propositions de classe IIb avec des niveaux de preuve C.8 Ce degré de recommandation assez faible s'explique essentiellement d'une part par l'absence de grandes études contrôlées et la crainte d'effets secondaires à terme lors des traitements chroniques, mais également par l'utilisation plus large et plus aisée d'antiarythmiques très efficaces, tels que ceux de la classe IC. L'administration chronique de l'amiodarone dans la prévention de récidives d'arythmies supraventriculaires a par ailleurs été très largement remplacée, de nos jours, par les techniques d'ablation, souvent en première intention. L'amiodarone garde néanmoins une place en tant qu'option possible pour le traitement d'arythmies rebelles bien spécifiques, difficilement contrôlables, tant en aigu qu'en chronique.8
Amiodarone et fibrillation auriculaire
La fibrillation auriculaire constitue de nos jours l'arythmie non seulement la plus fréquente, mais souvent la plus problématique en termes de récidives. Le traitement par voie orale en prévention des récidives à long terme des FA est de ce fait proposé en classe I (CL I/A) dans les dernières recommendations.9 Cela peut paraître un peu surprenant, si l'on prend en considération les effets secondaires potentiels inhérents à l'utilisation à long terme de l'amiodarone. Ces recommandations tiennent certainement compte de l'efficacité antiarythmique particulièrement élevée de l'amiodarone, mais également de son effet ralentisseur au niveau de la réponse ventriculaire. Il y est toutefois bien précisé que d'autres antiarythmiques sont à privilégier dans la mesure du possible. En présence d'une altération de la fonction ventriculaire, l'amiodarone reste néanmoins la médication de choix.
Le rôle de l'amiodarone dans le contrôle de la fréquence ventriculaire dans des cas rebelles de FA est également admis en tant que solution de dernier recours. Une place préférentielle pour les situations où coexiste une altération de la fonction ventriculaire gauche est toujours confirmée. Même l'administration par voie IV en aigu peut de cette manière faire partie de l'approche, dans des cas précis de détérioration hémodynamique en présence d'une FA à réponse rapide (classe IIb/B).9
Les effets non désirés de l'utilisation de l'amiodarone en phase chronique sont bien connus, mais les problèmes proarythmiques sérieux, si l'on excepte les bradycardies, sont rares. Le problème principal concerne l'allongement de l'intervalle QT, phénomène inhérent au mécanisme d'action de la médication sur la repolarisation cellulaire. Un allongement significatif du QT comporte effectivement un risque théorique de torsades de pointes.10,11 Celles-ci restent toutefois exceptionnelles pour l'amiodarone et sont évaluées à moins de 1 %.11 Cette incidence paradoxalement faible par rapport à l'effet souvent majeur de l'amiodarone sur l'intervalle QT peut être attribuée, selon Antzelevitch, à une moindre dispersion transmurale de la repolarisation au niveau du myocarde, par comparaison avec d'autres médications antiarythmiques qui allongent également l'intervalle QT.12 Signalons par ailleurs que des torsades de pointes ont également été rapportées lors d'injections IV d'amiodarone, avec une incidence estimée à 1,5 %.13
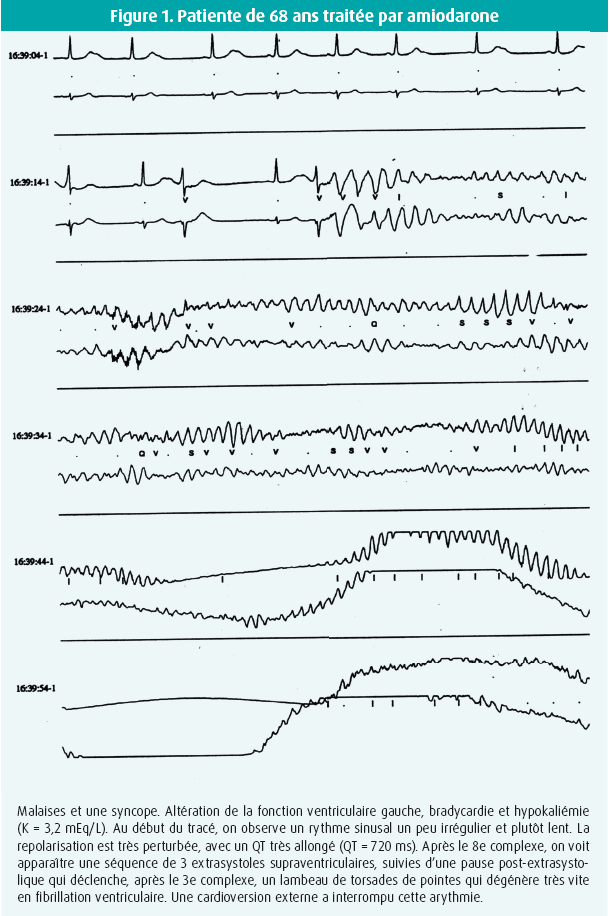
Nous avons tenté il y a plusieurs années, alors que les techniques d'ablation étaient encore hésitantes, particulièrement en ce qui concerne la FA, d'évaluer l'importance de ces torsades de pointes dues à l'amiodarone, dans la pratique cardiologique courante. Nous avons pu de cette manière colliger un total de 8 cas de torsades de pointes sur amiodarone, répertoriés et documentés, émanant de plusieurs centres cardiologiques. Deux de ces épisodes ont évolué en fibrillation ventriculaire, heureusement traitée efficacement par cardioversion électrique (figure 1).14 Les caractéristiques principales observées dans ces cas de torsades de pointes comportaient une fonction myocardique altérée, une bradycardie significative et, souvent, une hypokaliémie profonde.
La tentative de conversion en aigu d'une FA d'installation récente par injection IV d'amiodarone est une pratique courante en urgence. Cette attitude n'est toutefois pas à préconiser en priorité, sachant qu'il a été bien démontré que cette médication a un effet retardé sur la remise en rythme sinusal, par comparaison aux autres antiarythmiques.15 L'action bénéfique de l'amiodarone sur le contrôle de la réponse ventriculaire s'avère toutefois être un élément qui pourrait plaider en sa faveur. L'utilisation de l'amiodarone pour la conversion d'une FA en aigu devrait donc être réservée préférentiellement aux patients dont la fonction ventriculaire est altérée, ou à ceux qui présentent une contre-indication à l'utilisation d'autres antiarythmiques, tels que la flécaïnide ou la propafénone (classe I/A).9
Fibrillation auriculaire et voie accessoire
L'installation d'une FA en présence d'une voie accessoire peut être responsable de tracés électrocardiographiques impressionnants et aboutir à des situations à risque, en raison d'une conduction extrêmement rapide du rythme atrial vers les ventricules. Les voies accessoires sont effectivement constituées de fibres myocardiques, dépourvues de propriétés frénatrices, contrairement à ce qui s'observe au niveau de la conduction auriculo- ventriculaire (AV) nodale (figure 2).
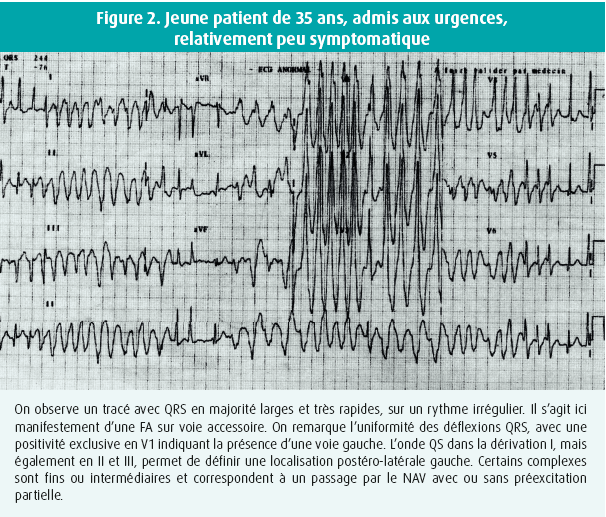
Il est surprenant de constater que les recommandations de l'ACC/AHA/ESC de 2006 laissaient encore une place à l'amiodarone dans le traitement aigu d'une FA hémodynamiquement stable, en présence d'une voie accessoire conduisant rapidement, tout en conseillant la prudence (classe IIb/B).16 Les recommandations de l'ESC de 2019 et celles de l'ACC/AHA/ESC de 2020, en revanche, contre-indiquent formellement son utilisation et la placent en classe III,8,9 en raison de plusieurs publications qui font état d'accélérations de la conduction par la voie accessoire, y compris des observations d'évolution vers une fibrillation ventriculaire.17-19 Cette attribution en classe III est devenue absolue, en dépit de rapports qui tentent malgré tout de démontrer l'effet favorable de l'amiodarone dans ces situations et son innocuité potentielle.20
Contrairement aux autres ralentisseurs de la conduction atrio-ventriculaire (anticalciques non dihydropyridines/bêtabloquants/ digitale …) qui sont également contre-indiqués en phase aiguë d'une fibrillation auriculaire en présence d'une voie accessoire patente, le risque potentiel de l'amiodarone dans ces situations est moins clair. La sécurité supposée de l'amiodarone ainsi que son effet favorable sur la période réfractaire de la voie accessoire la plaçaient théoriquement en situation idéale pour traiter ces arythmies.21,22 La position actuelle en classe III des recommandations internationales met toutefois fin à toute ambiguïté.8,9 Cette décision, peu contestable il est vrai, repose malgré tout essentiellement sur la description de ces cas assez rares d'accélération de la conduction par la voie accessoire et sur la dégradation possible en arythmies ventriculaires létales.
En quoi l'amiodarone par voie orale se distingue-t-elle de celle par voie intraveineuse ?
A priori, la raison pour laquelle l'injection d'amiodarone par voie intraveineuse (IV) en phase aiguë comporterait plus de risques que l'administration en chronique est peu claire. L'amiodarone par voie orale possède un effet thérapeutique puissant mais complexe, en agissant sur les différents canaux ioniques du myocarde. L'action antiarythmique de cette médication en chronique se ferait en réalité en grande partie par l'intermédiaire de son métabolite, la déséthylamiodarone, ce qui la différencie des effets observés à la suite de l'administration par voie intraveineuse. Le mécanisme d'action par voie orale concerne en grande partie la conduction AV nodale, associée à un effet marqué sur la période réfractaire antérograde des voies accessoires.21,22 Ce dernier élément lui avait conféré une place idéale dans ces indications. Le traitement par ablation a bien entendu modifié considérablement ce choix.
L'injection d'amiodarone en IV, quant à elle, serait responsable d'une action modérée mais réelle, au niveau de la période réfractaire du noeud atrio-ventriculaire. Cela pourrait être essentiellement dû à un effet indirect bêta-inhibiteur de la substance. Celle-ci serait en partie responsable du ralentissement des influx de la FA à travers le noeud AV (NAV). Ce mécanisme réduirait, en présence d'une voie accessoire, comme pour d'autres frénateurs du NAV, le nombre d'impulsions transmises aux ventricules et, par conséquent, les conductions rétrogrades cachées (« concealed conduction ») dans la voie accessoire. Ce phénomène est bien connu pour favoriser un passage antérograde plus rapide de la FA à travers la voie accessoire. La question qui se pose est de savoir si ce mécanisme est suffisant pour expliquer l'accélération de la conduction lors de l'administration IV de l'amiodarone, compte tenu également de l'allongement de la période réfractaire au niveau de la voie accessoire,21,22 même si cet allongement est plus marqué lorsque l'amiodarone est administrée par voie orale par rapport à la voie veineuse. Cet effet favorable au niveau de la période réfractaire a donné à l'amiodarone, probablement à tort, une réputation de grande sécurité dans ces indications. Toutefois, comme signalé plus haut, plusieurs cas d'accélération de la réponse ventriculaire par la voie accessoire ont été décrits, après une injection IV.17-19 Une explication probable est liée à l'hypotension inhérente à la substance elle-même lors de l'injection par voie intraveineuse, mais surtout aux excipients, tels que le polysorbate 80 et l'alcool benzoïque, contenus dans la solution d'amiodarone IV. L'hypotension qui entraînerait une réaction adrénergique réflexe a effectivement été invoquée comme cause potentielle de ce phénomène d'accélération de la conduction par la voie accessoire.17 Cela pourrait sembler contradictoire par rapport à l'action bêta-frénatrice de l'amiodarone, telle que celle supposée agir au niveau du NAV. Une chute tensionnelle majeure peut toutefois entraîner un réponse adrénergique importante, particulièrement après une administration IV trop rapide, surtout chez des sujets déjà en situation hémodynamique précaire. La présence d'une image électrocardiographique parfois inquiétante, d'un rythme extrêmement rapide, à QRS larges, peut quelquefois ajouter à la précipitation et à l'administration trop rapide de la médication en urgence.
Un argument majeur supplémentaire qui plaide contre l'utilisation de l'amiodarone en IV pour cette indication est le délai d'action de cette médication pour la conversion d'une FA en phase aiguë, indépendamment de la présence d'une voie accessoire. Nous avons déjà souligné que l'amiodarone n'est pas un traitement de première intention pour une conversion aiguë d'une FA, et a fortiori en présence d'une voie accessoire.
En résumé, l'injection IV d'amiodarone en présence d'une FA sur voie accessoire patente doit être considérée comme contre-indiquée, en raison du danger, quoique rare, d'une dégradation vers des arythmies ventriculaires potentiellement létales.
Quel est le traitement aigu d'une FA avec réponse ventriculaire rapide sur voie accessoire ?
Rappelons que, s'il existe une menace hémodynamique dans ce contexte, une cardioversion sans délai est impérative. En dehors de cette situation d'urgence extrême, l'approche thérapeutique d'une FA sur voie accessoire peut se concevoir avec un antiarythmique de classe IC, tel que la flécaïnide (1 à 2 mg/kg en perfusion) ou la propafénone (2 mg/kg en perfusion).9, 25, 26 Un certain délai d'action (15 à 30 min) pour obtenir un effet maximal est toutefois inhérent à ce type de médication. Rappelons que la présence d'une altération de la fonction ventriculaire ou d'une cardiopathie significative est une contre-indication à leur utilisation. Certaines précautions restent malgré tout également nécessaires, en raison d'une influence possible sur la conduction AV nodale et infranodale.
L'ajmaline (classe antiarythmique IA) en injection IV lente de 1 mg/kg (à raison de 10 mg/min), médication bien connue des électrophysiologistes mais commercialement indisponible dans plusieurs pays, peut constituer une alternative. Cet antiarythmique, à tort peu utilisé dans la pratique courante, possède toutefois une action rapide et souvent très efficace. L'avantage de l'ajmaline réside dans son délai d'action, qui est très court (quelques minutes) et variable selon les situations, et dans son temps de demivie d'élimination très bref (13 minutes), ce qui la rend très maniable. Elle exerce également peu d'effets négatifs sur le plan hémodynamique. Ces caractéristiques ont comme conséquence une utilisation assez souple.25, 26 Rappelons que l'ajmaline a été largement utilisée pour l'évaluation des propriétés électrophysiologiques des voies accessoires, en particulier l'estimation de leur période réfractaire.27
Les antiarythmiques de classes IA et IC ont pour avantage que leur effet thérapeutique s'avère être malgré tout assez rapide, surtout en ce qui concerne l'ajmaline. Ils agissent en allongeant la période réfractaire de la voie accessoire, phénomène que l'on peut observer en assistant fréquemment à une diminution ou à la disparition de la préexcitation sur les tracés en fibrillation. Une action supplémentaire non négligeable de ces antiarythmiques est leur pouvoir de conversion de la fibrillation atriale en rythme sinusal, ce qui met immédiatement le patient à l'abri d'une évolution à risque. Cette conversion est d'autant plus probable que la FA, dans les cas présents, est presque toujours d'installation récente. Le passage en rythme sinusal précède quelquefois la disparition de la préexcitation.
L'ECG : Le diagnostic différentiel
L'ECG en FA avec passage par une voie accessoire
L'ECG en FA avec passage par une voie accessoire est souvent décrit comme un rythme (très) rapide, irrégulier et à QRS larges (figure 2). Certaines caractéristiques spécifiques distinguent cette situation d'autres arythmies qui pourraient donner le change. Dans le cas présent, le rythme est effectivement irrégulier et très rapide, ce qui est dû au passage préférentiel ou exclusif par la voie accessoire dont la structure est de nature musculaire, sans propriétés frénatrices. Les intervalles minimaux entre 2 QRS élargis sont parfois extrêmement courts, quelquefois inférieurs à 200 ms. Ces intervalles RR peuvent donner une idée de la période réfractaire de la voie accessoire. Les QRS peuvent avoir des morphologies différentes, alternant quelquefois avec des complexes fins. Dans ces cas, les QRS larges témoignent d'un passage préférentiel ou complet par la voie accessoire. Les complexes fins sont dus à une conduction exclusive par le NAV, et les formes intermédiaires représentent des complexes de fusion entre une conduction conjointe par le NAV et par la voie accessoire.
La présence d'une voie accessoire se caractérise par l'orientation uniformément similaire des déflexions à QRS larges, particulièrement explicite dans la dérivation V1 (figure 2). Les QRS larges témoignent donc d'une préexcitation maximale et permettent de vérifier la compatibilité de leur morphologie avec la présence d'une voie accessoire, ainsi que de préciser sa localisation anatomique. Une concordance négative (QS) dans les précordiales, par exemple, ne peut en aucune manière être en relation avec la présence d'une voie accessoire.
La FA avec aberration de la conduction, en l'absence de passage par une voie accessoire
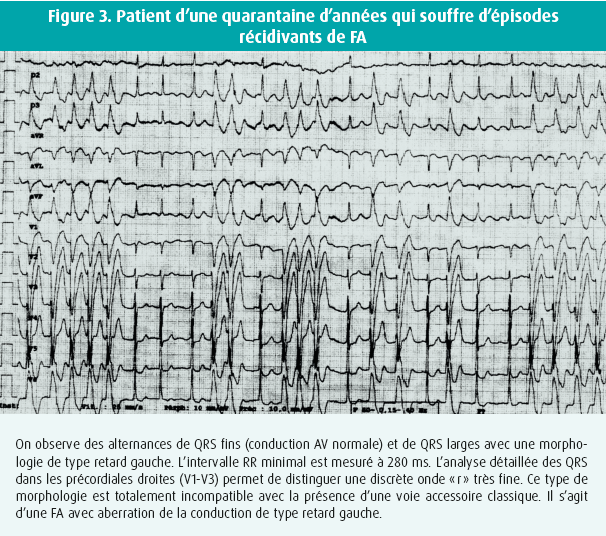
Dans ce cas, les cycles RR sont par définition également irréguliers, mais la valeur minimale des espaces RR est rarement inférieure à 240-250 ms, car le passage exclusif par le NAV est un filtre naturel pour la conduction vers les ventricules. Cela est dû aux caractéristiques spécifiques des cellules nodales, mais également à la présence de conductions incomplètes au sein du NAV, qui empêchent une succession trop rapide des influx (conductions cachées/ concealed conduction). Par ailleurs, les QRS en aberration ont généralement une morphologie caractéristique d'un bloc de branche classique. Il n'est pas rare de trouver, sur des tracés prolongés, des alternances d'aberration à type de retard droit et de retard gauche. On peut également y observer des formes intermédiaires qui représentent des aberrations partielles. Toutes ces caractéristiques distinguent ces tracés en FA avec aberration des enregistrements de FA sur voie accessoire (figure 3).
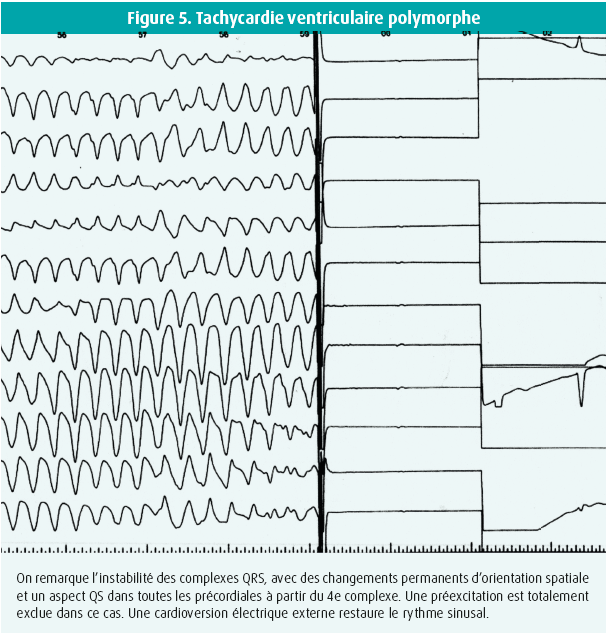
Les tachycardies ventriculaires polymorphes
En présence d'une cardiopathie significative, en particulier ischémique, on peut enregistrer des lambeaux d'arythmies ventriculaires rapides dont les couplages sont quelques fois très courts et qui peuvent donner le change pour une FA sur voie accessoire, si les accès sont prolongés.
Dans ces situations, la clinique est souvent assez claire, et les périodes d'arythmie ventriculaire sont rarement prolongées, hormis dans les situations d'urgence vitale. Par ailleurs, la morphologie des QRS est par définition éminemment variable, sans uniformité d'orientation, comme on peut le voir en présence d'une voie accessoire (figure 4 et 5).

Les torsades de pointes
Il s'agit de rythmes également très rapides et à QRS larges. La définition comporte une variabilité de la morphologie des QRS, avec une opposition continuelle des complexes ventriculaires et un aspect tout à fait caractéristique de changement d'orientation des activités ventriculaires, qui semblent torsadées. Ceci est encore une fois totalement incompatible avec une préexcitation (figure 1).
Conclusion
L'utilisation de l'amiodarone dans le traitement des arythmies supraventriculaires a perdu de son importance depuis l'avènement de l'ablation. Il persiste toutefois quelques indications spécifiques, en particulier dans la prévention des récidives de fibrillation auriculaire.
La fibrillation auriculaire associée à une conduction rapide par une voie accessoire est une situation peu fréquente, mais pour laquelle l'utilisation d'amiodarone par voie intraveineuse est formellement contre-indiquée. Cette médication, souvent administrée en urgence en raison de sa réputation de sécurité, peut effectivement provoquer, dans de rares cas, des arythmies ventriculaires létales, même si cette situation est assez exceptionnelle. Les antiarythmiques de classes IC ou IA sont les médications de prédilection dans ces cas de figure, sauf en présence d'une altération hémodynamique, auquel cas une cardioversion électrique rapide s'impose.
Références
- Vaughan Williams, E.M.A. Classification of Antiarrhythmic Actions Reassessed after a Decade of New Drugs, J Clin Pharmacol, 1984, 24 (4), 129-147.
- Task Force of the Working Group on Arrhythmias of the European Society of Cardiology. The Sicilian Gambit, Circulation, 1991, 84, 1831-1851.
- Hamilton, D., Nandkeolyar, S., Lan, H., Desai, P., Evans, J., Hauschild, C. et al. Amiodarone, a Comprehensive Guide for Clinicians. Am J Cardiovascular Drugs, 2020, 20, 549-558.
- Zipes, D., Prystowsky, E., Heger, J. Amiodarone: Electrophysiologic Actions, Pharmacokinetics and Clinical effects. J Am Coll Cardiol, 1984, 3, 1059-1071.
- von Kemp, M., Vermeersch, G., Schwagten, B. Lorsque l'amiodarone n'est pas le bon choix … Journal Cardiol, 2022, 34 (6), 25-28.
- ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias. J Am Coll Cardiol, 2003, 42, 1493-1531.
- Rosenbaum, M.B., Chiale, P.A., Ryba, D., Elizari, M. Control of Tachyarrhythmias associated with Wolff-Parkinson-White Syndrome by Amiodarone Hydrochloride. Am J Cardiol, 1974, 34, 215-223.
- Brugada, P., Katritsis, D.G., Arbelo, E., Arribas, F., Bax, J.J., Blomström-Lundqvist, C. et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardias. Eur Heart J, 2019, 00, 1-65.
- 2020 ESC Guidelines for the diagnosis and Management of Atrial Fibrillation. Eur Heart J, 2020, 42, 373-498.
- Kirchhof, P., Franz, M., Bardai, A., Wilde, A. Giant T-U Waves precede Torsades de Pointes in Long QT Syndrome. J Am Coll Cardiol, 2009, 54, 143-149.
- Hohnloser, S., Klingenheben, T., Singh, B. Amiodarone-associated Proarrhythmic Effects. Ann Intern Med, 1994, 121, 529-535.
- Antzelevitch, C. Role of transmural dispersion of repolarisation in the genesis of drug-induced torsades de pointes. Heart Rhythm, 2005, 2 (suppl), S9-15.
- Shenthar, J., Rachaiah, J., Pillai, V., Chakali, S., Balasubramanian, V., Nanjappa, M. Incidence of drug-induced torsades de pointes with intravenous amiodarone. Indian Heart J, 2017, 69, 707-713.
- Scavee, C., Blommaert, D., Mairesse, G., Nanan, A., de Meester, A., De Roy, L. Torsades de Pointes after Amiodarone administration. Acta Cardiologica, 2001, 56, 332.
- Chevalier, P., Durand-Dubief, A., Burri, H., Cucherat, M., Kirkorian, G., Touboul, P. Amiodarone versus placebo and class IC drugs for cardioversion of recent onset atrial fibrillation: a meta-analysis. J Am Coll Cardiol, 2003, 41, 255-262.
- ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation. Europace, 2006, 6, 651-745.
- Boriani, G., Biffi, M., Frabetti, L. et al. Ventricular Fibrillation after intravenous amiodarone in Wolff-Parkinson-White syndrome with atrial fibrillation. Am Heart J, 1996, 131, 1214-1216.
- Schützenberger, W., Leish, F., Gmeiner, R. Enhanced accessory pathway conduction following intravenous amiodarone in atrial fibrillation. A case report. Int J Cardiol, 1987, 16, 93-95.
- Tijunels, M.A., Herbert, M.E. Myth: Intravenous amiodarone is safe in patients with atrial fibrillation and Wolff-Parkinson- White syndrome in the emergency department. CEJM, 2005, 7, 262-265.
- Ren, J., Yang, Y., Zhu, J., Wu, S., Wang, J., Zhang. H., Shao, X. The use of intravenous amiodarone in patients with atrial fibrillation and Wolff-Parkinson-White syndrome. Pacing Clin Electrophysiol, 2021, 44, 35-43.
- Wellens, H.J.J., Brugada, P., Abdollah, H., Dassen, W. A comparison of the electrophysiologic effects of intravenous and oral amiodarone in the same patient. Circulation, 1984, 69, 120-124.
- Feld, G.K., Nademanee, K., Stevenson, W., Weiss, J., Klitzner, T., Singh, B.N. Clinical and electrophysiologic effects of amiodarone in patients with atrial fibrillation complicating the Wolff-Parkinson-White syndrome. Am Heart J, 1988, 115, 102-107.
- Nunain, S., Garrat, C., Linker, N., Gill, J., Ward, D., Camm, A.J. A comparison of intravenous Propafenone and flecainide in the treatment of tachycardias associated with the Wolff- Parkinson-White Syndrome. Pace, 1991, 14, 2028-2034.
- Boahene, K., Klein, G., Yee, R., Sharma, A., Fujimura, O. Termination of acute atrial Fibrillation in the Wolff-Parkinson-White Syndrome by Procainamide and Propafenone: Importance of Atrial Fibrillatory Cycle length. J Am Coll Cardiol, 1991, 16, 1408-1414.
- Aronson, J.K. Ajmaline and its derivates. Meyler's Side Effects of Drugs, 2016, 7th Ed.
- Zipes, D. Therapy for cardiac arrhythmias. Braunwald's Heart Disease: A textbook of Cardiovascular Medicine, 2019.
- Wellens, H.J.J., Bar, F., Gorgels, A., Vanagt, E. Use of ajmaline in patients with the Wolff- Parkinson-White syndrome to disclose short refractory period of the accessory pathway. Am J Cardiol, 1980, 45, 130-133.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.