Jacqueline Bernheim Award
La dysfonction auriculaire est une cause fréquente de morbi-mortalité cardiaque. Dans cette thèse de doctorat, la dysfonction auriculaire a été étudiée dans le cadre de la régurgitation mitrale fonctionnelle (partie 1), de l'accident vasculaire cérébral (AVC) cryptogénique (partie 2) et de l'insuffisance cardiaque (partie 3). En 2023, la régurgitation mitrale fonctionnelle auriculaire (RMFA) est reconnue comme une entité distincte, compte tenu de sa physiopathologie unique qui est fondamentalement différente de celle de la régurgitation mitrale fonctionnelle dans le cadre de l'insuffisance ventriculaire gauche. Un élément important dans la physiopathologie est le fameux déséquilibre des feuillets annulaires, qui est déterminé par le degré de dilatation de l'anneau, la croissance des feuillets et la dysfonction de l'anneau. Dans les parties 2 et 3, on a démontré que la mécanique de l'oreillette gauche (OG) joue un rôle important, respectivement dans la physiopathologie de l'AVC cryptogénique et de l'insuffisance cardiaque à fraction d'éjection réduite. L'imagerie de la déformation (strain) de l'OG s'est récemment imposée comme un nouveau type de biomarqueur qui permet de détecter une détérioration subtile de la fonction de l'OG et qui est donc extrêmement utile dans un tel contexte.
Le 10 février, lors du congrès annuel de la SBC, le prix Jacqueline Bernheim a été décerné à Sébastien Deferm pour sa thèse de doctorat sur la pathologie auriculaire. En 1628, le rôle important de l'oreillette gauche (OG) dans le système circulatoire avait déjà été magnifiquement décrit par le physicien britannique William Harvey. Néanmoins, ce n'est que très récemment que l'importance de la fonction auriculaire pour un remplissage optimal du ventricule gauche (VG) et pour le débit cardiaque a été réellement reconnue. Cependant, nos connaissances sur la dysfonction de l'OG restaient limitées. De plus, la dysfonction de l'OG était invariablement considérée comme la conséquence d'une autre pathologie cardiaque, plutôt que comme une cause potentielle. Cette thèse de doctorat tente de combler cette lacune et s'est concentrée sur l'impact de la dysfonction de l'OG dans 3 domaines majeurs, à savoir : 1) la régurgitation mitrale (RM), 2) l'accident vasculaire cérébral (AVC) ischémique cryptogénique et 3) l'insuffisance cardiaque à fraction d'éjection réduite (HFrEF).
La régurgitation mitrale fonctionnelle auriculaire (RMFA)
Traditionnellement, on considère que la régurgitation mitrale secondaire ou fonctionnelle résulte invariablement d'un déséquilibre fonctionnel entre l'augmentation des forces de tethering des feuillets sous-valvulaires (traction sous-valvulaire) et la réduction des forces de fermeture du ventricule gauche (VG) dans un appareil valvulaire mitral structurellement normal.1, 2 Ce scénario se produit typiquement dans le contexte d'un remodelage défavorable du VG et est associé à un mauvais pronostic.
Toutefois, on s'est récemment rendu compte que la régurgitation mitrale et/ou tricuspide fonctionnelle pouvait également être liée à une pathologie auriculaire isolée, même en l'absence de dilatation du VG ou de dysfonction systolique (radiale). Cette 'régurgitation mitrale fonctionnelle auriculaire' (RMFA) s'observe typiquement dans le contexte d'une fibrillation auriculaire (FA) et/ou d'une insuffisance cardiaque à fraction d'éjection préservée (HFpEF). Les éléments clés dans la physiopathologie de cette entité unique sont 1) la dilatation annulaire, 2) la croissance des feuillets et 3) la dysfonction annulaire3-5 (figure 1).
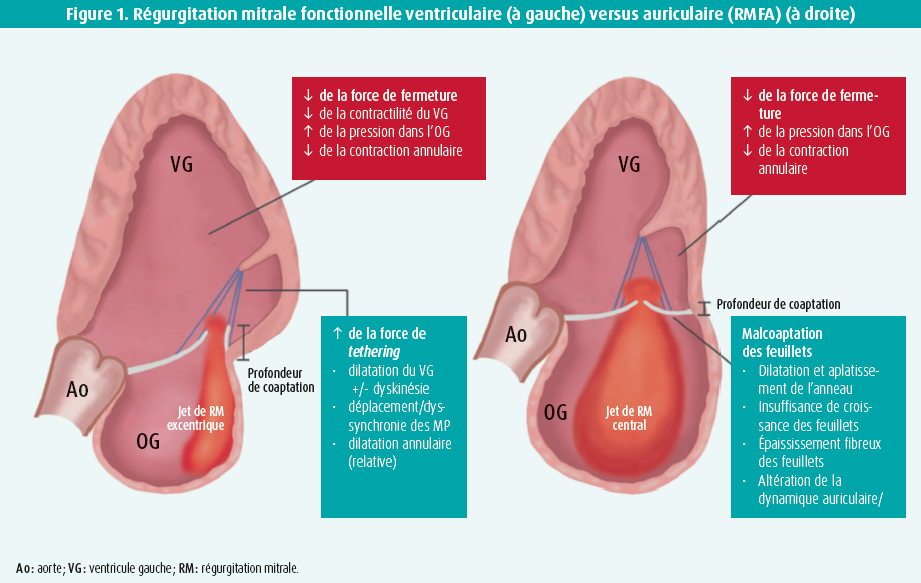
Gertz et al.6 ont décrit pour la première fois une relation indépendante entre la dilatation de l'oreillette gauche (OG), la dilatation de l'anneau mitral et la régurgitation mitrale fonctionnelle (RMF) dans une petite cohorte de patients âgés souffrant de FA, adressés en vue d'une isolation des veines pulmonaires (IVP). Les patients qui ont conservé un rythme sinusal pendant le suivi ont également présenté une réduction significative de la RM, attribuée à la contraction de l'OG et des diamètres annulaires. Cependant, ces observations ont été contredites par d'autres petites études mécanistiques7, 8, qui affirmaient qu'une dilatation auriculaire et annulaire isolée était insuffisante pour provoquer une RM cliniquement significative. La controverse peut s'expliquer en partie par la croissance adaptative des feuillets.9, 10 En effet, la traction exercée sur les feuillets par une dilatation annulaire excessive active la voie du TGF-ß (facteur de croissance transformant bêta) qui conduit à une croissance compensatoire des feuillets. Deux études récentes ont montré que la croissance adaptative des feuillets est surtout importante chez les patients présentant une dilatation annulaire modérée (5-8 cm/m²), car le degré de croissance compensatoire des feuillets dans ce sousgroupe détermine l'apparition éventuelle d'une malcoaptation. Ainsi, en d'autres termes, ce n'est pas la dilatation annulaire en soi, mais plutôt le déséquilibre des feuillets annulaires qui détermine la survenue d'une fuite. En outre, l'activation excessive de la même voie conduit à un épaississement défavorable des feuillets et à une fibrose qui, à leur tour, peuvent entraîner une restriction des feuillets valvulaires.11, 12 Il est donc possible que cette voie moléculaire devienne une cible future pour un traitement visant à stimuler la croissance des feuillets, sans entraîner leur épaississement.
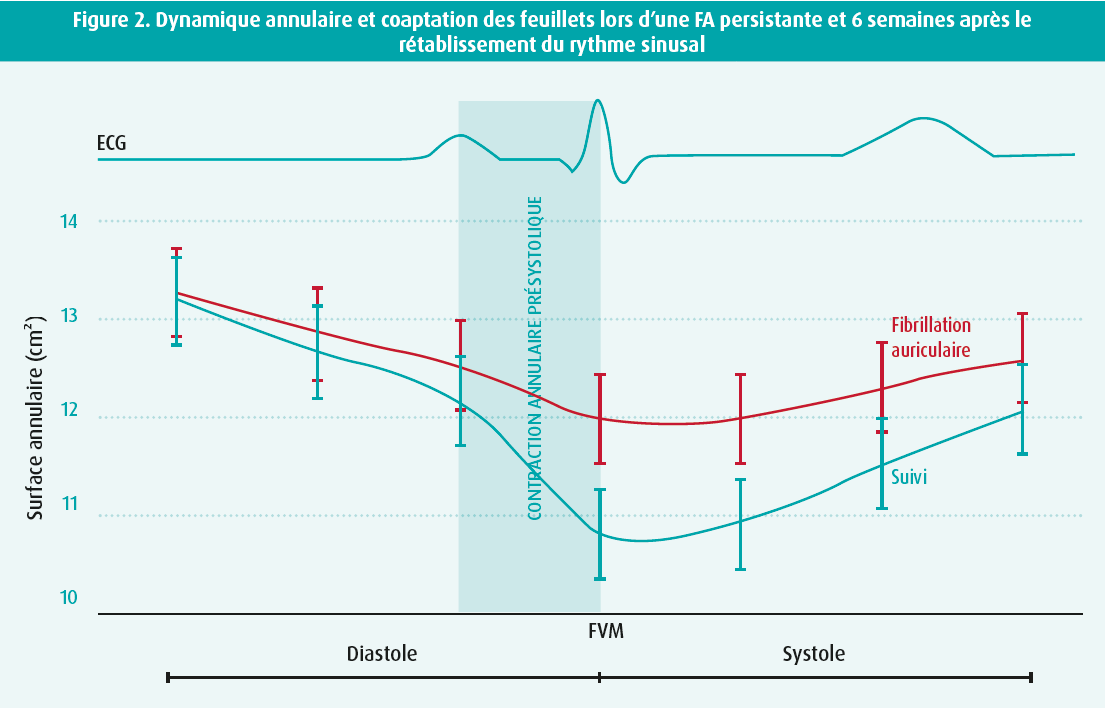
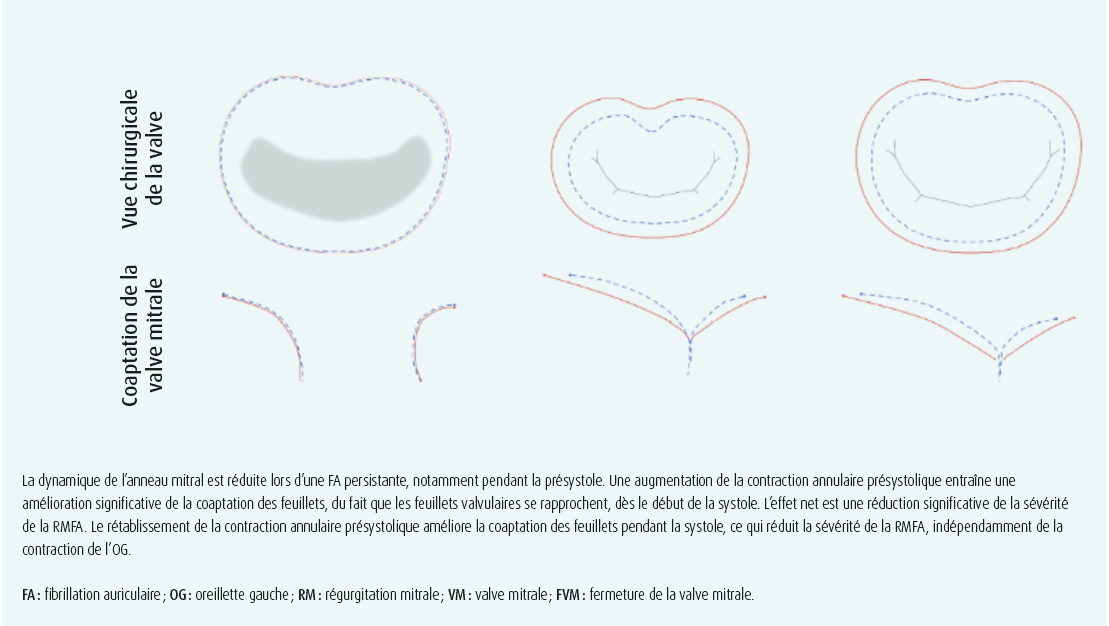
Outre la dilatation annulaire, une autre étude prospective menée par notre groupe a montré que la dynamique de l'anneau mitral est sévèrement perturbée en cas de FA persistante, ce qui contribue à son tour à la physiopathologie de la RMFA. Six semaines après le rétablissement du rythme sinusal, on a constaté une réduction significative de la RMFA, qui a été attribuée à l'amélioration de la dynamique annulaire plutôt qu'au remodelage de l'OG (figure 2).13 On peut supposer que cette amélioration de la dynamique annulaire en fin de diastole (présystolique) reflète une récupération de la fonction de pompe auriculaire, bien que ceci reste inexpliqué à ce jour.
Malheureusement, tous les patients ne connaissent pas ce 'happy end'. L'annuloplastie chirurgicale de la valve mitrale peut constituer un traitement de secours pour les patients souffrant d'une insuffisance mitrale sévère avec une dilatation auriculaire excessive chez qui le rétablissement du rythme sinusal n'est pas judicieux ou n'est plus possible. L'annuloplastie de la valve mitrale dans le contexte d'une fuite mitrale fonctionnelle 'ventriculaire' est controversée, en raison de l'absence de bénéfices en termes de survie et de la fréquence relativement élevée de fuites récidivantes dues à la persistance du tethering des feuillets sous-valvulaires. Cependant, une étude rétrospective14 a montré que l'annuloplastie de la valve mitrale produisait un résultat durable et une meilleure survie globale dans le contexte de la RMFA comparativement à son pendant ventriculaire.
Il est important de noter que la supériorité de l'annuloplastie de la valve mitrale dans le contexte de la RMFA était significativement meilleure, même après correction des différences d'EuroSCORE II dans les deux groupes. Un phénotypage correct du type de RM fonctionnelle est donc très important, étant donné les différences en termes de pronostic et d'options thérapeutiques.
à l'époque des précédentes recommandations de 2017, la RMFA n'était pas considérée comme une entité distincte, mais plutôt classée dans la catégorie des RM secondaires, au même titre que son pendant ventriculaire. En outre, on se demandait si la dilatation annulaire était suffisante en soi pour provoquer une RM cliniquement significative. Les connaissances physiopathologiques susmentionnées, les caractéristiques échocardiographiques typiques et les options thérapeutiques possibles pour la RMFA ont notamment été décrites en détail dans une revue state-of-the-art publiée dans le Journal of the American College of Cardiology.3 Cet article de revue a été cité plus de 160 fois à ce jour, et il a partiellement contribué à ce que la RMFA soit désormais reconnue comme une entité distincte dans les dernières recommandations européennes et américaines.
Comme indiqué ci-dessus, la FA et/ou l'HFpEF sont les deux scénarios typiques qui donnent lieu à une dilatation excessive de l'OG et de l'anneau dans le contexte d'une fraction d'éjection ventriculaire gauche (FEVG) préservée. La dilatation chronique de l'oreillette (due à une postcharge élevée de l'OG dans le contexte de l'HFpEF ou d'une FA) entraîne une dilatation de l'anneau sous-jacent, ce qui écarte les feuillets valvulaires jusqu'à l'apparition d'une RMFA. Actuellement, on estime qu'un tiers des cas de RM cliniquement significative est attribuable à une pathologie auriculaire. Il s'agit principalement de patients âgés, majoritairement de sexe féminin, présentant un grand nombre de comorbidités et une FA fréquente.15 Des études épidémiologiques ont montré une mortalité significativement plus élevée comparativement à la RM dégénérative avec une FEVG préservée16 et chez des sujets du même âge.15 Globalement, la survie à 5 ans n'atteignait que 50 % dans l'Olmsted Community Study, malgré une surface moyenne de l'orifice régurgitant effectif (EROA) de 0,20 cm², ce qui correspond en principe à une RM modérée. On peut s'attendre à ce que l'incidence de la RMFA ne cesse d'augmenter dans les années à venir, étant donné le vieillissement de la population, couplé à une prévalence croissante de FA et d'HFpEF.
What's next? La question clé reste de savoir si la mortalité en cas de RMFA est principalement due au nombre élevé de comorbidités, à la myopathie auriculaire ou à la RMFA elle-même. En effet, il est théoriquement possible qu'une RM low-volume soit déjà hémodynamiquement significative pour un VG non dilaté et peu compliant et pour une OG à la physiologie restrictive. D'autre part, des études récentes menées par le groupe Mayo17 ont montré une association entre la RMFA et les résultats dans l'HFpEF. Cependant, cette association s'est estompée après l'inclusion de la myopathie de l'OG dans le modèle de régression, ce qui pourrait indiquer que le degré de myopathie de l'OG était quand même plus important que la sévérité de la RMFA elle-même. D'autres études prospectives randomisées sur l'HFpEF en cas de RMFA sont nécessaires pour déterminer si la RMFA doit être considérée comme un marqueur de risque ou un facteur de risque de mauvais pronostic. Outre la question de savoir quel patient tire des bénéfices d'un traitement donné, il reste à savoir quelles interventions nous pouvons proposer à ces patients si le rétablissement du rythme sinusal n'offre pas de solution. L'avènement des nouveaux dispositifs transcathéter 'bord à bord' permet un effet de réparation prolongé, en partie grâce à la région plus large des bras du clip (clips XTW et NTW) sans risque élevé de sténose iatrogène. Compte tenu du profil de risque du patient typique souffrant de RMFA, qui est âgé et qui présente un grand nombre de comorbidités, la réparation transcathéter bord à bord (TEER) constituera vraisemblablement le premier choix dans un futur proche. Quatre études récentes18, 19, 20, 21 ont déjà pu démontrer une efficacité et une sécurité satisfaisantes dans ce contexte. Enfin, l'attention s'est récemment déplacée vers la valve tricuspide, où la régurgitation tricuspide fonctionnelle auriculaire (RTFA) est désormais considérée comme une entité distincte. En effet, la RMFA et la RTFA sont les manifestations d'une même maladie. Contrairement à son pendant gauche, l'anneau valvulaire tricuspide est plus large et principalement constitué de graisse, ce qui signifie qu'il se dilatera encore plus facilement en réponse à un stimulus externe. Cette observation explique très probablement la fréquence élevée de la régurgitation tricuspide concomitante chez les patients souffrant de RMFA.8, 22
Dysfonction auriculaire et AVC cryptogénique
La deuxième partie s'est concentrée sur la myopathie auriculaire dans le contexte d'un AVC. Selon des données récentes de l'Organisation mondiale de la Santé, l'AVC reste la deuxième cause de décès dans le monde et une cause majeure d'invalidité permanente. Dans environ 1 AVC ischémique sur 3, aucun facteur causal n'est retenu malgré un bilan approfondi incluant un Holter de 24 heures. Rétrospectivement, il apparaît cependant qu'une FA silencieuse non détectée est impliquée dans environ 30 % de ces AVC cryptogéniques.24 Ainsi, dans ce contexte, il existe un besoin critique d'identifier un sous-groupe de patients pouvant potentiellement tirer des bénéfices d'un contrôle du rythme plus long, voire d'une anticoagulation préalable. En effet, le Holter de 24 heures préconisé par les recommandations ne suffit pas, les taux de détection de FA atteignant à peine 10 %.
Comme on le sait, le remodelage de l'OG est un important substrat sous-jacent dans la physiopathologie de la FA et de l'AVC ischémique.25 L'imagerie de la déformation de l'OG (via échocardiographie speckle-tracking [STE]) permet aujourd'hui la détection précoce d'une détérioration subtile de la mécanique de l'OG et peut donc être utilisée pour identifier les patients courant un risque de FA.
La valeur prédictive de l'imagerie de la déformation de l'OG pour la détection d'une FA occulte a été étudiée chez 191 patients ayant présenté un AVC cryptogénique.26 Les deux points forts de cette étude (comparativement aux études précédentes) étaient 1) le court intervalle d'un jour entre l'hospitalisation pour AVC et l'échocardiographie et 2) le monitoring ambulatoire uniforme du rythme à l'aide d'un patch mobile qui a enregistré automatiquement les événements arythmiques pendant 30 jours, suivi d'une surveillance de routine. On a finalement diagnostiqué une FA chez 15 % des patients qui présentaient déjà une altération marquée de la fonction de l'OG lors de leur admission, comparativement au groupe témoin. Ici, le boosterpump strainrate de l'OG, une mesure de la fonction contractile de l'OG en fin de diastole, s'est avéré être le facteur prédictif le plus puissant pour détecter une FA occulte, et il pourrait donc affiner sensiblement la stratification du risque pour la FA.
Cependant, on ne sait toujours pas dans quelle mesure la diminution de la fonction mécanique de l'OG est attribuable à une 'sidération' de l'oreillette après la reconversion de la FA ou si elle indique une myopathie auriculaire sous-jacente, prédisposée au développement de la FA. En outre, des études complémentaires sont indiquées pour évaluer l'efficacité et la rentabilité des stratégies de monitoring du rythme, voire d'une éventuelle instauration d'anticoagulants guidée par l'imagerie. L'étude ARCADIA, qui randomise des patients souffrant d'un AVC cryptogénique, présentant des signes de myopathie auriculaire, vers de l'aspirine ou du rivaroxaban, avec comme critère d'évaluation primaire une récidive d'AVC, semble également importante dans le cadre de cette réflexion.
La dysfonction auriculaire dans le contexte d'une insuffisance cardiaque à fraction d'éjection réduite
Dans la troisième partie, la dysfonction auriculaire a été étudiée dans le contexte de l'HFrEF. On dispose de preuves croissantes indiquant le rôle de la mécanique de l'OG dans la physiopathologie de l'insuffisance cardiaque, grâce à son interaction dynamique avec le VG. Dans le contexte spécifique de l'HFrEF, on observe une association claire entre la déformation du réservoir de l'OG (une mesure de la dilatation passive de l'OG pendant la systole) et les pressions télédiastoliques du VG, le statut fonctionnel et les résultats globaux.27, 28
Jusqu'à récemment, on ne savait pas comment l'OG réagit à un épisode de surcharge aiguë de pression/volume, comme dans le cas d'une HFrEF aiguë décompensée. L'imagerie de la déformation complémentaire chez des patients souffrant d'HFrEF aiguë décompensée a montré un impact clair sur la mécanique de l'OG, tant sur la fonction de réservoir passif que sur la fonction de pompe d'appoint active. Six semaines après une décongestion fructueuse, guidée par un monitoring hémodynamique invasif, on a observé une récupération importante de la mécanique de l'OG, qui était liée à un critère d'évaluation combiné de mortalité et d'hospitalisation pour insuffisance cardiaque dans cette petite étude mécanistique.29 Le degré de récupération de la mécanique de l'OG peut expliquer pourquoi certains patients sont plus souvent réhospitalisés que d'autres, malgré un degré comparable de dysfonction du VG.
Enfin, l'importance de la mécanique de l'OG a été soulignée une fois de plus dans une autre étude portant sur des patients souffrant d'HFrEF, après une thérapie de resynchronisation cardiaque.30 Parallèlement à l'effet néfaste connu de la stimulation ventriculaire droite chronique sur la fonction du VG, cette étude a montré qu'une fréquence élevée de stimulation auriculaire droite était préjudiciable à la fonction mécanique de l'OG et associée à une augmentation de la mortalité et des hospitalisations pour insuffisance cardiaque.
En résumé, on peut donc dire que William Harvey (en 1628) et par extension Eugene Braunwald (dans les années 60) avaient donc raison, depuis si longtemps. En 2023, le temps est venu de considérer la dysfonction auriculaire comme une entité distincte cliniquement significative, en raison de son impact sur le débit cardiaque, la qualité de vie et les critères d'évaluation concrets.31
Références
- Asgar, A.W., Mack, M.J., Stone, G.W. Secondary mitral regurgitation in heart failure: Pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol, 2015, 65 (12), 1231-1248.
- Bertrand, P.B., Schwammenthal, E., Levine, R.A., Vandervoort, P.M. Exercise Dynamics in Secondary Mitral Regurgitation: Pathophysiology and Therapeutic Implications. Circulation, 2017, 135 (3), 297-314.
- Deferm, S., Bertrand, P.B., Verbrugge, F.H., Verhaert, D., Rega, F., Thomas, J.D. et al. Atrial Functional Mitral Regurgitation. J Am Coll Cardiol, 2019, 73 (19), 2465-2476.
- Deferm, S., Dauw, J., Vandervoort, P.M., Bertrand P.B. Atrial Functional Mitral and Tricuspid Regurgitation. Curr Treat Options Cardiovasc Med, 2020, 22 (10), 30.
- Zoghbi, W.A., Levine, R.A., Flachskampf, F., Grayburn, P., Gillam, L., Leipsic, J. et al. Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2022, 15 (11), 1870-1882.
- Gertz, Z.M., Raina, A., Saghy, L., Zado, E.S., Callans, D.J., Marchlinski, F.E. et al. Evidence of Atrial Functional Mitral Regurgitation Due to Atrial Fibrillation. J Am Coll Cardiol, 2011, 58 (14), 1474-1481.
- Otsuji, Y., Kumanohoso, T., Yoshifuku, S., Matsukida, K., Koriyama, C., Kisanuki, A. et al. Isolated annular dilation does not usually cause important functional mitral regurgitation: Comparison between patients with lone atrial fibrillation and those with idiopathic or ischemic cardiomyopathy. J Am Coll Cardiol, 2002, 39 (10), 1651-1656.
- Zhou, X., Otsuji, Y., Yoshifuku, S., Yuasa, T., Zhang, H., Takasaki, K. et al. Impact of Atrial Fibrillation on Tricuspid and Mitral Annular Dilatation and Valvular Regurgitation. Circ J, 2002, 66 (10), 913-916.
- Kim, D.H., Heo, R., Handschumacher, M.D., Lee, S., Choi, Y.S., Kim, K.R. et al. Mitral Valve Adaptation to Isolated Annular Dilation. Insights Into the Mechanism of Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2019, 12 (4), 665-667.
- Kagiyama, N., Hayashida, A., Toki, M., Fukuda, S., Ohara, M., Hirohata, A. et al. Insufficient Leaflet Remodeling in Patients with Atrial Fibrillation: Association with the Severity of Mitral Regurgitation. Circ Cardiovasc Imaging, 2017, 10 (3), e005451.
- Dal-Bianco, J.P., Aikawa, E., Bischoff, J., Guerrero, J.L., Hjortnaes, J., Beaudoin, J. et al. Myocardial infarction alters adaptation of the tethered mitral valve. J Am Coll Cardiol, 2016, 67 (3), 275-287.
- Grande-Allen, K.J., Barber, J.E., Klatka, K.M., Houghtaling, P.L., Vesely, I., Moravec, C.S. et al. Mitral valve stiffening in end-stage heart failure: Evidence of an organic contribution to functional mitral regurgitation. J Thorac Cardiovasc Surg, 2005, 130 (3), 783-790.
- Deferm, S., Bertrand, P.B., Verhaert, D., Verbrugge, F.H., Dauw, J., Thoelen, K. et al. Mitral Annular Dynamics in AF Versus Sinus Rhythm. JACC Cardiovasc Imaging, 2022, 15 (1), 1-13.
- Deferm, S., Bertrand, P.B., Verhaert, D., Dauw, J., Van Keer, J.M., Van De Bruaene, A. et al. Outcome and durability of mitral valve annuloplasty in atrial secondary mitral regurgitation. Heart, 2021, 107 (18), 1503-1509.
- Dziadzko, V., Dziadzko, M., Medina-Inojosa, J.R., Benfari, G., Michelena, H.I., Crestanello, J.A. et al. Causes and mechanisms of isolated mitral regurgitation in the community: Clinical context and outcome. Eur Heart J, 2019, 40 (27), 2194-2202.
- Mesi, O., Gad, M.M., Crane, A.D., Ramchand, J., Puri, R., Layoun, H. et al. Severe Atrial Functional Mitral Regurgitation: Clinical and Echocardiographic Characteristics, Management and Outcomes. JACC Cardiovasc Imaging, 2021, 14 (4), 797-808.
- Tamargo, M., Obokata, M., Reddy, Y.N.V., Pislaru, S.V., Lin, G., Egbe, A.C. et al. Functional mitral regurgitation and left atrial myopathy in heart failure with preserved ejection fraction. Eur J Heart Fail, 2020, 22 (3), 489-498.
- Yoon, S.H., Makar, M., Kar, S., Chakravarty, T., Oakley, L., Sekhon, N. et al. Outcomes After Transcatheter Edge-to-Edge Mitral Valve Repair According to Mitral Regurgitation Etiology and Cardiac Remodeling. JACC Cardiovasc Interv, 2022, 15 (17), 1711-1722.
- Sodhi, N., Asch, F.M., Ruf, T., Petrescu, A., von Bardeleben, S., Lim, D.S. et al. Clinical Outcomes With Transcatheter Edge-to-Edge Repair in Atrial Functional MR From the EXPAND Study. JACC Cardiovasc Interv, 2022, 15 (17), 1723-1730.
- Tanaka, T., Sugiura, A., öztürk, C., Vogelhuber, J., Tabata, N., Wilde, N. et al. Transcatheter Edge-to-Edge Repair for Atrial Secondary Mitral Regurgitation. JACC Cardiovasc Interv, 2022, 15 (17), 1731-1740.
- Doldi, P., Stolz, L., Orban, M., Karam, N., Praz, F., Kalbacher, D. et al. Transcatheter Mitral Valve Repair in Patients With Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2022, 15 (11), 1843-1851.
- Utsunomiya, H., Itabashi, Y., Mihara, H., Berdejo, J., Kobayashi, S., Siegel, R.J. et al. Functional Tricuspid Regurgitation Caused by Chronic Atrial Fibrillation: A Real-Time 3-Dimensional Transesophageal Echocardiography Study. Circ Cardiovasc Imaging, 2017, 10 (1), e004897.
- Yamasaki, N., Kondo, F., Kubo, T., Okawa, M., Matsumura, Y., Kitaoka, H. et al. Severe Tricuspid Regurgitation in the Aged: Atrial Remodeling Associated With Long-Standing Atrial Fibrillation. J Cardiol, 2006, 48 (6), 315-323.
- Ntaios, G. Embolic Stroke of Undetermined Source: JACC Review Topic of the Week. J Am Coll Cardiol, 2020, 75 (3), 333-340.
- Hoit, B.D. Left atrial size and function: Role in prognosis. J Am Coll Cardiol, 2014, 63 (6), 493-505.
- Deferm, S., Bertrand, P.B., Churchill, T.W., Sharma, R., Vandervoort, P.M., Schwamm, L.H. et al. Left Atrial Mechanics Assessed Early during Hospitalization for Cryptogenic Stroke Are Associated with Occult Atrial Fibrillation: A Speckle-Tracking Strain Echocardiography Study. J Am Soc Echocardiogr, 2021, 34 (2), 156-165.
- Cameli, M., Sparla, S., Losito, M., Righini, F.M., Menci, D., Lisi, M. et al. Correlation of Left Atrial Strain and Doppler Measurements with Invasive Measurement of Left Ventricular End-Diastolic Pressure in Patients Stratified for Different Values of Ejection Fraction. Echocardiography, 2016, 33 (3), 398-405.
- D'Andrea, A., Caso, P., Romano, S., Scarafile, R., Cuomo, S., Salerno, G. et al. Association between left atrial myocardial function and exercise capacity in patients with either idiopathic or ischemic dilated cardiomyopathy: A two-dimensional speckle strain study. Int J Cardiol, 2009, 132 (3), 354-363.
- Deferm, S., Martens, P., Verbrugge, F.H., Bertrand, P.B., Dauw, J., Verhaert, D. et al. LA Mechanics in Decompensated Heart Failure. JACC Cardiovasc Imaging, 2020, 13 (5), 1107-1115.
- Martens, P., Deferm, S., Bertrand, P.B., Verbrugge, F.H., Ramaekers, J., Verhaert, D. et al. The Detrimental Effect of RA Pacing on LA Function and Clinical Outcome in Cardiac Resynchronization Therapy. JACC Cardiovasc Imaging, 2020, 13 (4), 895-906.
- Bisbal, F., Baranchuk, A., Braunwald, E., Bayés de Luna, A., Bayés-Genís, A. Atrial Failure as a Clinical Entity: JACC Review Topic of the Week. J Am Coll Cardiol, 2020, 75 (2), 222-232.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.