Jacqueline Bernheim Award
Atriale disfunctie is een frequente oorzaak van cardiale morbiditeit en mortaliteit. Binnen dit doctoraatsonderzoek werd atriale disfunctie bestudeerd binnen functionele mitralisklepregurgitatie (deel 1), cryptogeen cerebrovasculair accident (CVA) (deel 2) en hartfalen (deel 3). Atriale functionele mitralisklepregurgitatie (AFMR) wordt anno 2023 erkend als een aparte entiteit, rekening houdende met de unieke pathofysiologie die fundamendeel verschillend is ten opzichte van functionele mitralisklepregurgitatie in de setting van linkerventrikelfalen. Belangrijk in de pathofysiologie is het zogenaamde onevenwicht tussen leafletlengte en annulusgrootte dat bepaald wordt door de mate van annulaire dilatatie, leafletgroei en annulaire disfunctie. In deel 2 en 3 werd aangetoond dat linkeratrium (LA)-mechanica een belangrijke rol speelt binnen de pathofysiologie van respectievelijk cryptogeen CVA en hartfalen met verminderde ejectiefractie. LA strain imaging is recentelijk ontstaan als een nieuw soort biomarker die toelaat een subtiele achteruitgang in LA-functie op te sporen en dus uitermate nuttig is in dergelijke context.
Op 10 februari werd tijdens het jaarlijkse BSC-congres de Jacqueline Bernheimprijs uitgereikt aan Sébastien Deferm voor zijn doctoraatsthesis over atriale (voorkamer) pathologie. In 1628 werd de belangrijke rol van het linkeratrium (LA) binnen de bloedsomloop al op prachtige wijze beschreven door de Britse natuurkundige William Harvey. Desondanks werd pas de afgelopen jaren het belang van de atriale functie voor een optimale vulling van het linkerventrikel (LV) en cardiale output echt erkend. Onze kennis over disfunctie van het LA bleef echter beperkt. Bovendien werd LA-disfunctie steevast beschouwd als het gevolg van overige cardiale pathologie, in plaats van een potentiële oorzaak. Deze doctoraatsthesis probeert die leemte in te vullen en heeft zich toegespitst op de impact van LA-disfunctie binnen drie grote domeinen, namelijk: 1) mitralisklepregurgitatie (MR), 2) cryptogeen ischemisch cerebrovasculair accident (CVA), 3) hartfalen met verminderde ejectiefractie (HFrEF).
Atriale functionele mitralisklepregurgitatie (AFMR)
Traditioneel wordt aangenomen dat secundaire of functionele mitralisklepregurgitatie steevast het gevolg is van een functioneel onevenwicht tussen toegenomen subvalvulaire leaflet tethering forces (subvalvulaire tractie) en verminderde linkerventrikel (LV) closing forces bij een structureel normaal mitralisklepapparaat.1, 2 Dit scenario speelt zich typisch af in de context van ongunstige LV-remodellering en is geassocieerd aan een slechte prognose.
Recentelijk kwam men echter tot het inzicht dat functionele mitralis- en/of tricuspidalisregurgitatie ook gerelateerd kan zijn aan geïsoleerde atriale pathologie, zelfs in afwezigheid van LV-dilatatie of systolische (radiale) disfunctie. Deze zogenaamde 'atriale functionele mitralisklepregurgitatie' (AFMR) wordt typisch waargenomen in de context van voorkamerfibrillatie (VKF) en / of hartfalen met bewaarde ejectiefractie (HFpEF). Sleutelelementen binnen de pathofysiologie van deze unieke entiteit zijn 1) annulaire dilatatie, 2) leafletgroei en 3) annulaire disfunctie3-5 (figuur 1).
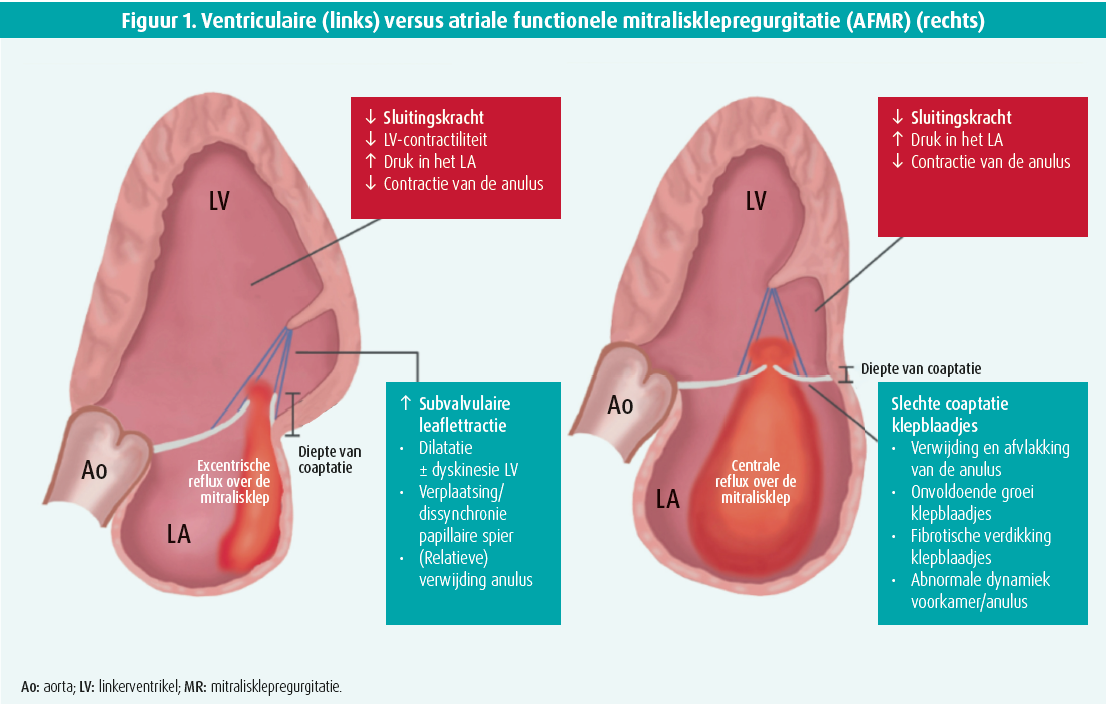
Gertz et al.6 beschreven voor het eerst een onafhankelijk verband tussen linkeratrium (LA)-dilatatie, mitralisklepannulusdilatatie en functionele mitralisklepregurgitatie (FMR) in een kleine cohorte van oudere patiënten met VKF verwezen voor pulmonaire vene-isolatie (PVI). Patiënten die tijdens follow-up met succes sinusritme behielden, vertoonden ook een significante reductie in MR, toegeschreven aan inkrimping van LA en annulaire diameters. Die bevindingen werden echter tegengesproken door andere kleine mechanistische studies7, 8 die claimden dat geïsoleerde atriale en annulaire dilatatie onvoldoende zijn om klinisch significant MR te veroorzaken. De controverse kan deels worden verklaard door adaptieve leafletgroei.9, 10 Leaflettractie door excessieve annulaire dilatatie activeert immers de transforming growth factor beta pathway die leidt tot compensatoire leafletgroei. Twee recente studies toonden aan dat adaptieve leafletgroei vooral belangrijk is bij patiënten met matige annulaire dilatatie (5-8 cm/m2) omdat de mate van compensatoire leafletgroei bij deze subgroep bepaalt of malcoaptatie zal optreden. Met andere woorden is het dus niet per se annulaire dilatatie, maar eerder de annulaire leafletonbalans die bepaalt of er lekkage zal optreden. Bovendien leidt overmatige activatie van dezelfde pathway ook tot ongunstige leafletverdikking en fibrose, wat op zijn beurt kan leiden tot restrictie van de klepblaadjes.11, 12 Het is mogelijk dat deze moleculaire pathway dus nog een toekomstig doelwit wordt voor behandeling met het oog op stimulatie van leafletgroei zonder daarbij aanleiding te geven tot leafletverdikking.
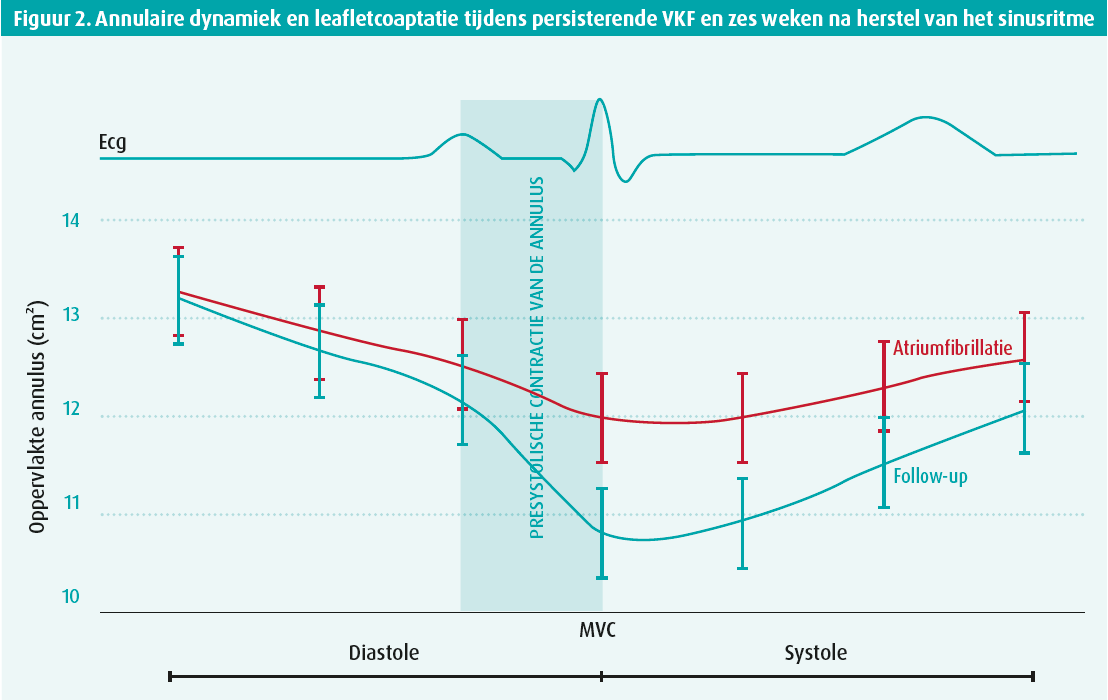
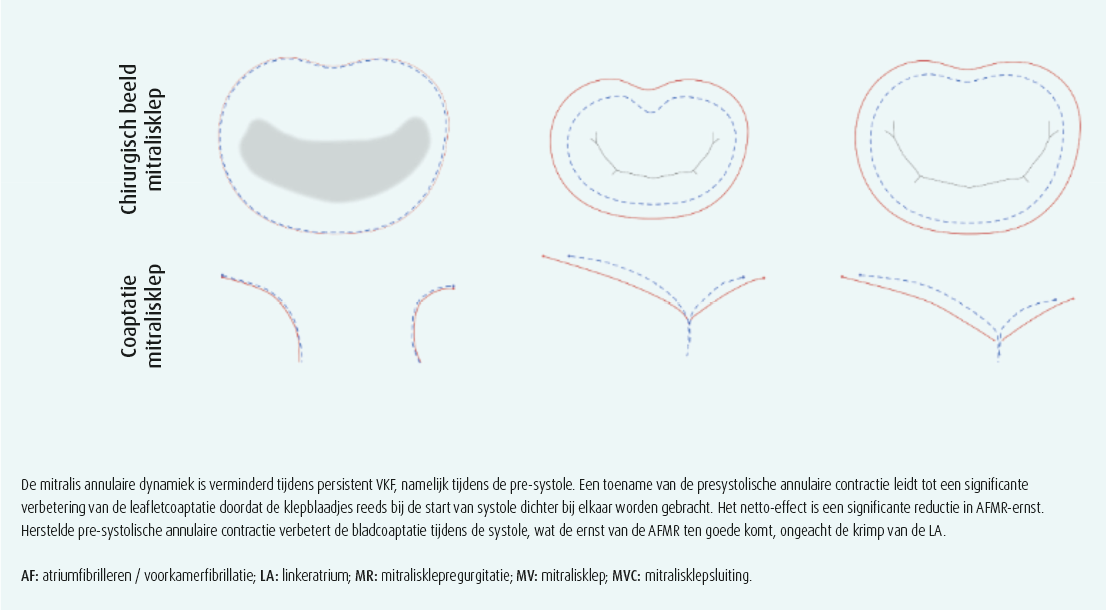
Naast annulaire dilatatie toonde aanvullend prospectief onderzoek van onze groep dat de mitralisklepannulusdynamiek ernstig verstoord is tijdens persisterende VKF, wat op zijn beurt bijdraagt tot de pathofysiologie van AFMR. Zes weken na herstel van het sinusritme was er een significante reductie in AFMR, wat werd toegeschreven aan een verbeterde annulaire dynamiek, eerder dan aan remodellering van het LA (figuur 2).13 Vermoedelijk is deze verbeterde annulaire dynamiek tijdens late diastole (pre-systole) een weerspiegeling van een recuperatie van de atriale boosterpompfunctie, hoewel dit tot op heden onopgehelderd blijft.
Spijtig genoeg is dergelijke happy ending niet weggelegd voor iedere patiënt. Chirurgische mitralisklepannuloplastie kan fungeren als bail-out therapie voor patiënten met ernstige mitralisklepinsufficiëntie met excessieve atriale dilatatie bij wie sinusritmeherstel niet zinvol of niet langer mogelijk is. Mitralisklepannuloplastie in de context van 'ventriculaire' functionele mitraliskleplekkage is controversieel door afwezigheid van een overlevingsvoordeel en relatief hoge frequentie van recidief lekkage ten gevolge van persisterende subvalvulaire leaflet tethering. Retrospectief onderzoek14 toonde echter dat mitralisklepannuloplastie leidde tot een duurzaam resultaat en een betere globale overleving in de context van AFMR ten opzichte van zijn ventriculaire tegenhanger. Belangrijk is dat de superioriteit van mitralisklepannuloplastie in de setting AFMR significant beter was, zelfs wanneer gecorrigeerd werd voor verschillen in EuroSCORE II in beide groepen. Correcte fenotypering van het type functionele MR is dus van groot belang gezien de verschillende prognoses en behandelingsopties.
Ten tijde van de vorige richtlijnen uit 2017 werd AFMR niet beschouwd als aparte entiteit, maar in plaats daarvan geclassificeerd onder secundaire MR samen met zijn ventriculaire tegenhanger. Bovendien twijfelde men of annulaire dilatatie op zich voldoende was om een klinisch significante MR te veroorzaken. De bovenstaande pathofysiologische inzichten, typische echocardiografische karakteristieken en mogelijke behandelingsopties voor AFMR werden o.a. uitgebreid beschreven in een state of the art review gepubliceerd in het Journal of the American College of Cardiology.3 Dit reviewartikel werd tot op heden meer dan 160 keer geciteerd en heeft er deels mede toe geleid dat AFMR nu wel erkend wordt als aparte entiteit in de laatste Europese en Amerikaanse richtlijnen.
Zoals hogerop aangegeven zijn VKF en / of HFpEF de twee typische scenario's die aanleiding geven tot excessieve LA en annulaire dilatatie in de context van bewaarde linkerventrikelejectiefractie (LVEF). Chronische atriale dilatatie (ten gevolge van een hoge LA-afterload in de context van HFpEF of door VKF) veroorzaakt dilatatie van de onderliggende annulus, wat de klepblaadjes uit elkaar trekt tot AFMR optreedt. Momenteel is naar schatting een derde van de gevallen van klinisch significante MR toe te schrijven aan atriale pathologie. Het gaat dan vooral om oudere patiënten, predominant vrouwelijk met een groot aantal comorbiditeiten en frequente VKF.15 Uit epidemiologisch onderzoek bleek een significant hogere mortaliteit in vergelijking met degeneratieve MR met bewaarde LV-ejectiefractie16 en leeftijdsgenoten.15 Globaal geschat bedroeg de vijfjaarsoverleving slechts 50 % in de Olmsted Community Study ondanks een gemiddeld effective regurgitant orifice area (EROA) van 0,20 cm2, wat in principe overeenstemt met slechts matige MR. Het valt te verwachten dat de incidentie van AFMR de komende jaren alleen maar zal blijven toenemen in onze vergrijzende bevolking met stijgende prevalentie van VKF en HFpEF.
What's next? De hamvraag blijft of de mortaliteit in AFMR hoofdzakelijk gedreven wordt door het hoge aantal comorbiditeiten, atriale myopathie of AFMR zelf. Het is immers theoretisch mogelijk dat een 'low-volume' MR al hemodynamisch significant is voor een niet-gedilateerd weinig compliant LV en LA met restrictieve fysiologie. Anderzijds toonde recent onderzoek van de Mayo-groep17 een associatie tussen AFMR en uitkomsten in HFpEF. Deze associatie vervaagde echter na inclusie van LA-myopathie in het regressiemodel, wat erop zou kunnen duiden dat de graad van LA-myopathie toch belangijker was dan de ernst van AFMR zelf. Aanvullend prospectief gerandomiseerd onderzoek in HFpEF met AFMR is noodzakelijk om te onderzoeken of AMFR moet worden aanzien als risicomarker dan wel als risicofactor voor de zwakke prognose. Naast de vraag welke patiënt voordeel haalt uit een behandeling blijft de vraag welke interventies we dergelijke patiënten kunnen aanbieden als sinusritmeherstel geen uitweg biedt. De komst van de nieuwe transkatheter edge-to-edge-devices laat een uitgebreid repair-effect toe mede door de bredere schouderregio in de cliparmen (XTW- & NTW-clips) zonder hoog risico op iatrogene stenose. Gezien het risicoprofiel van de typische AFMR-patiënt met hoge leeftijd en een groot aantal comorbiditeiten zal transkatheter edge-to-edge repair (TEER) vermoedelijk in de nabije toekomst de eerste voorkeursoptie zijn. Vier recente trials18, 19, 20, 21 konden reeds een goede werking en veiligheid in deze setting aantonen. Tot slot werd de aandacht recentelijk verlegd naar de tricuspidalisklep, waar zogenaamde atriale functionele tricuspidalisklepregurgitatie (AFTR) nu aanzien wordt als aparte entiteit. AFMR en AFTR zijn immers beide een uiting van dezelfde ziekte. In tegenstelling tot zijn linkszijdige tegenhanger is de tricuspidalisklepannulus groter en hoofdzakelijk uit vet opgebouwd, waardoor deze nog makkelijker zal dilateren als reactie op een externe stimulus. Deze bevinding verklaart hoogstwaarschijnlijk de hoge frequentie van concomitante tricuspudalisklepregurgitatie in patiënten met AFMR.8, 22
Atriale disfunctie en cryptogeen CVA
Deel 2 heeft zich toegespitst op atriale myopathie binnen de context van een CVA. Volgens recente gegevens van de Wereldgezondheidsorganisatie blijft een CVA wereldwijd de tweede belangrijkste doodsoorzaak en een belangrijke oorzaak van blijvende invaliditeit. In ongeveer een op drie ischemische CVA's wordt geen oorzakelijke factor weerhouden, ondanks een uitgebreide work-up inclusief 24-uursholtermonitoring. In retrospect blijkt echter dat ongedetecteerde silentieuze VKF betrokken is bij ongeveer 30 % van deze cryptogene CVA's.24 Er is binnen deze context dus een kritieke behoefte om een subgroep van patiënten te identificeren die mogelijk baat heeft bij meer langdurige ritmecontrole of zelfs voorafgaande antistollingstherapie. De door de richtlijnen aanbevolen 24-uursholtermonitoring schiet immers tekort met VKF-detectiepercentages die nauwelijks oplopen tot 10 %.
Zoals gekend vormt LA-remodellering een belangrijk onderliggend substraat binnen de pathofysiologie van zowel VKF als ischemisch CVA.25 Strain imaging van het LA (via speckle-trackingechocardiografie [STE]) laat tegenwoordig toe een subtiele achteruitgang in LA-mechanica vroegtijdig op te sporen en kan dus worden aangewend om risicopatiënten voor VKF op te sporen.
De voorspellende waarde van LA strain imaging voor de detectie van occulte VKF werd bestudeerd bij 191 patiënten met cryptogeen CVA.26 Twee bijzonder sterke punten van deze studie (in vergelijking met eerdere studies) waren 1) het korte tijdsinterval van een dag tussen opname wegens CVA en echocardiografie en 2) uniforme ambulante ritmemonitoring aan de hand van een mobiele patch / pleister die gedurende 30 dagen automatisch aritmische events registreerde, gevolgd door routineuze follow-up. VKF werd finaal vastgesteld bij 15 % van de patiënten die bij opname al een duidelijk verminderde LA-functie vertoonden ten opzichte van de controlegroep. De LA boosterpump strainrate, een maat voor de LA contractiele functie tijdens late diastole, bleek hierbij de sterkste voorspeller om occulte VKF op te sporen en kon daardoor de risicostratificatie voor VKF gevoelig verfijnen.
Het blijft echter onduidelijk in welke mate de verminderde LA mechanische functie toe te schrijven is aan 'atriale stunning' post VKF-reconversie; dan wel wijst naar een onderliggende atriale myopathie die voorbeschikt is voor het ontwikkelen van VKF. Bovendien is bijkomend onderzoek aangewezen om de doeltreffendheid en kosteneffectiviteit van ritmemonitoringstrategieën en zelfs eventuele startantistolling op geleide van beeldvorming te evalueren. De ARCADIA-trial, die patiënten met cryptogeen CVA en evidentie voor atriale myopathie randomiseert voor aspirine vs. rivaroxaban met recidief CVA als primaire uitkomst, lijkt ook belangrijk binnen deze denkpiste.
Atriale disfunctie in de context van hartfalen met verminderde ejectiefractie
In deel drie werd atriale disfunctie binnen de context van HFrEF bestudeerd. Er is steeds meer evidentie voor de rol van LA-mechanica binnen de pathofysiologie van hartfalen, dankzij zijn dynamische interactie met het LV. Specifiek in de context van HFrEF blijkt een duidelijke associatie tussen LA reservoir strain (een maat voor de passieve uitzetting van het LA tijdens systole) en LV einddiastolische drukken, functionele status en globale uitkomsten.27, 28
Hoe het LA omgaat met een episode van acute druk / volume-overload, zoals in de setting van acuut gedecompenseerd HFrEF, was tot voor kort onduidelijk. Aanvullende strain imaging bij patiënten met acuut gedecompenseerd HFrEF toonde een duidelijke impact op LA-mechanica, zowel de passieve reservoirfunctie als de actieve boosterpompfunctie. Zes weken na succesvolle decongestie op geleide van invasieve hemodynamische monitoring werd een belangrijke recuperatie in LA-mechanica vastgesteld, die gerelateerd was aan een gecombineerd eindpunt van mortaliteit en hartfalenhospitalisatie in deze kleine mechanistische studie.29 De mate van herstel van de LA-mechanica verklaart mogelijk waarom sommige patiënten vaker opnieuw worden gehospitaliseerd t.o.v. andere, ondanks een vergelijkbare mate van LV-disfunctie.
Het belang van LA-mechanica werd tot slot nogmaals benadrukt in een andere studie van HFrEF-patiënten na cardiale resynchronisatietherapie.30 Parallel met het gekende nadelige effect van chronische rechterventrikelpacing op de LV-functie, werd in deze studie aangetoond dat een hoge frequentie van rechter atriale pacing nadelig was voor de mechanische functie van het LA en geassocieerd was aan hogere mortaliteit en hartfalenhospitalisatie.
Samengevat mogen we dus stellen dat William Harvey (in 1628) en bij uitbreiding Eugene Braunwald (in de jaren '60) het dus al die jaren bij het rechte eind hadden. Anno 2023 is de tijd rijp om atriale disfunctie als een aparte klinische relevante entiteit te beschouwen door haar impact op cardiale output, levenskwaliteit en harde eindpunten.31
Referenties
- Asgar, A.W., Mack, M.J., Stone, G.W. Secondary mitral regurgitation in heart failure: Pathophysiology, prognosis, and therapeutic considerations. J Am Coll Cardiol, 2015, 65 (12), 1231-1248.
- Bertrand, P.B., Schwammenthal, E., Levine, R.A., Vandervoort, P.M. Exercise Dynamics in Secondary Mitral Regurgitation: Pathophysiology and Therapeutic Implications. Circulation, 2017, 135 (3), 297-314.
- Deferm, S., Bertrand, P.B., Verbrugge, F.H., Verhaert, D., Rega, F., Thomas, J.D. et al. Atrial Functional Mitral Regurgitation. J Am Coll Cardiol, 2019, 73 (19), 2465-2476.
- Deferm, S., Dauw, J., Vandervoort, P.M., Bertrand P.B. Atrial Functional Mitral and Tricuspid Regurgitation. Curr Treat Options Cardiovasc Med, 2020, 22 (10), 30.
- Zoghbi, W.A., Levine, R.A., Flachskampf, F., Grayburn, P., Gillam, L., Leipsic, J. et al. Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2022, 15 (11), 1870-1882.
- Gertz, Z.M., Raina, A., Saghy, L., Zado, E.S., Callans, D.J., Marchlinski, F.E. et al. Evidence of Atrial Functional Mitral Regurgitation Due to Atrial Fibrillation. J Am Coll Cardiol, 2011, 58 (14), 1474-1481.
- Otsuji, Y., Kumanohoso, T., Yoshifuku, S., Matsukida, K., Koriyama, C., Kisanuki, A. et al. Isolated annular dilation does not usually cause important functional mitral regurgitation: Comparison between patients with lone atrial fibrillation and those with idiopathic or ischemic cardiomyopathy. J Am Coll Cardiol, 2002, 39 (10), 1651-1656.
- Zhou, X., Otsuji, Y., Yoshifuku, S., Yuasa, T., Zhang, H., Takasaki, K. et al. Impact of Atrial Fibrillation on Tricuspid and Mitral Annular Dilatation and Valvular Regurgitation. Circ J, 2002, 66 (10), 913-916.
- Kim, D.H., Heo, R., Handschumacher, M.D., Lee, S., Choi, Y.S., Kim, K.R. et al. Mitral Valve Adaptation to Isolated Annular Dilation. Insights Into the Mechanism of Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2019, 12 (4), 665-667.
- Kagiyama, N., Hayashida, A., Toki, M., Fukuda, S., Ohara, M., Hirohata, A. et al. Insufficient Leaflet Remodeling in Patients with Atrial Fibrillation: Association with the Severity of Mitral Regurgitation. Circ Cardiovasc Imaging, 2017, 10 (3), e005451.
- Dal-Bianco, J.P., Aikawa, E., Bischoff, J., Guerrero, J.L., Hjortnaes, J., Beaudoin, J. et al. Myocardial infarction alters adaptation of the tethered mitral valve. J Am Coll Cardiol, 2016, 67 (3), 275-287.
- Grande-Allen, K.J., Barber, J.E., Klatka, K.M., Houghtaling, P.L., Vesely, I., Moravec, C.S. et al. Mitral valve stiffening in end-stage heart failure: Evidence of an organic contribution to functional mitral regurgitation. J Thorac Cardiovasc Surg, 2005, 130 (3), 783-790.
- Deferm, S., Bertrand, P.B., Verhaert, D., Verbrugge, F.H., Dauw, J., Thoelen, K. et al. Mitral Annular Dynamics in AF Versus Sinus Rhythm. JACC Cardiovasc Imaging, 2022, 15 (1), 1-13.
- Deferm, S., Bertrand, P.B., Verhaert, D., Dauw, J., Van Keer, J.M., Van De Bruaene, A. et al. Outcome and durability of mitral valve annuloplasty in atrial secondary mitral regurgitation. Heart, 2021, 107 (18), 1503-1509.
- Dziadzko, V., Dziadzko, M., Medina-Inojosa, J.R., Benfari, G., Michelena, H.I., Crestanello, J.A. et al. Causes and mechanisms of isolated mitral regurgitation in the community: Clinical context and outcome. Eur Heart J, 2019, 40 (27), 2194-2202.
- Mesi, O., Gad, M.M., Crane, A.D., Ramchand, J., Puri, R., Layoun, H. et al. Severe Atrial Functional Mitral Regurgitation: Clinical and Echocardiographic Characteristics, Management and Outcomes. JACC Cardiovasc Imaging, 2021, 14 (4), 797-808.
- Tamargo, M., Obokata, M., Reddy, Y.N.V., Pislaru, S.V., Lin, G., Egbe, A.C. et al. Functional mitral regurgitation and left atrial myopathy in heart failure with preserved ejection fraction. Eur J Heart Fail, 2020, 22 (3), 489-498.
- Yoon, S.H., Makar, M., Kar, S., Chakravarty, T., Oakley, L., Sekhon, N. et al. Outcomes After Transcatheter Edge-to-Edge Mitral Valve Repair According to Mitral Regurgitation Etiology and Cardiac Remodeling. JACC Cardiovasc Interv, 2022, 15 (17), 1711-1722.
- Sodhi, N., Asch, F.M., Ruf, T., Petrescu, A., von Bardeleben, S., Lim, D.S. et al. Clinical Outcomes With Transcatheter Edge-to-Edge Repair in Atrial Functional MR From the EXPAND Study. JACC Cardiovasc Interv, 2022, 15 (17), 1723-1730.
- Tanaka, T., Sugiura, A., öztürk, C., Vogelhuber, J., Tabata, N., Wilde, N. et al. Transcatheter Edge-to-Edge Repair for Atrial Secondary Mitral Regurgitation. JACC Cardiovasc Interv, 2022, 15 (17), 1731-1740.
- Doldi, P., Stolz, L., Orban, M., Karam, N., Praz, F., Kalbacher, D. et al. Transcatheter Mitral Valve Repair in Patients With Atrial Functional Mitral Regurgitation. JACC Cardiovasc Imaging, 2022, 15 (11), 1843-1851.
- Utsunomiya, H., Itabashi, Y., Mihara, H., Berdejo, J., Kobayashi, S., Siegel, R.J. et al. Functional Tricuspid Regurgitation Caused by Chronic Atrial Fibrillation: A Real-Time 3-Dimensional Transesophageal Echocardiography Study. Circ Cardiovasc Imaging, 2017, 10 (1), e004897.
- Yamasaki, N., Kondo, F., Kubo, T., Okawa, M., Matsumura, Y., Kitaoka, H. et al. Severe Tricuspid Regurgitation in the Aged: Atrial Remodeling Associated With Long-Standing Atrial Fibrillation. J Cardiol, 2006, 48 (6), 315-323.
- Ntaios, G. Embolic Stroke of Undetermined Source: JACC Review Topic of the Week. J Am Coll Cardiol, 2020, 75 (3), 333-340.
- Hoit, B.D. Left atrial size and function: Role in prognosis. J Am Coll Cardiol, 2014, 63 (6), 493-505.
- Deferm, S., Bertrand, P.B., Churchill, T.W., Sharma, R., Vandervoort, P.M., Schwamm, L.H. et al. Left Atrial Mechanics Assessed Early during Hospitalization for Cryptogenic Stroke Are Associated with Occult Atrial Fibrillation: A Speckle-Tracking Strain Echocardiography Study. J Am Soc Echocardiogr, 2021, 34 (2), 156-165.
- Cameli, M., Sparla, S., Losito, M., Righini, F.M., Menci, D., Lisi, M. et al. Correlation of Left Atrial Strain and Doppler Measurements with Invasive Measurement of Left Ventricular End-Diastolic Pressure in Patients Stratified for Different Values of Ejection Fraction. Echocardiography, 2016, 33 (3), 398-405.
- D'Andrea, A., Caso, P., Romano, S., Scarafile, R., Cuomo, S., Salerno, G. et al. Association between left atrial myocardial function and exercise capacity in patients with either idiopathic or ischemic dilated cardiomyopathy: A two-dimensional speckle strain study. Int J Cardiol, 2009, 132 (3), 354-363.
- Deferm, S., Martens, P., Verbrugge, F.H., Bertrand, P.B., Dauw, J., Verhaert, D. et al. LA Mechanics in Decompensated Heart Failure. JACC Cardiovasc Imaging, 2020, 13 (5), 1107-1115.
- Martens, P., Deferm, S., Bertrand, P.B., Verbrugge, F.H., Ramaekers, J., Verhaert, D. et al. The Detrimental Effect of RA Pacing on LA Function and Clinical Outcome in Cardiac Resynchronization Therapy. JACC Cardiovasc Imaging, 2020, 13 (4), 895-906.
- Bisbal, F., Baranchuk, A., Braunwald, E., Bayés de Luna, A., Bayés-Genís, A. Atrial Failure as a Clinical Entity: JACC Review Topic of the Week. J Am Coll Cardiol, 2020, 75 (2), 222-232.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.