Au cours de la dernière décennie, la chirurgie à coeur ouvert a été largement remplacée par des procédures percutanées mini-invasives dans le contexte des cardiopathies structurelles. Pour une navigation sûre dans l'espace tridimensionnel (3D), il est capital d'utiliser une combinaison de techniques d'imagerie telles que l'échocardiographie 2D/3D, la tomographie computérisée multi-barrettes (MDCT) et l'imagerie par résonance magnétique cardiaque (RMC) lors de la planification préprocédurale de telles interventions percutanées.
En outre, il est récemment apparu qu'une stratégie d'imagerie multimodale peut également être extrêmement utile dans le cadre post-procédural, ce qui constitue l'objet spécifique de cet article. Bien que l'échocardiographie Doppler reste invariablement notre modalité d'imagerie de première ligne pour le suivi des interventions valvulaires percutanées, nous utilisons de plus en plus d'autres techniques d'imagerie avancées telles que le MDCT et la RMC, voire l'imagerie nucléaire. En pratique clinique, ces techniques sont utilisées : 1) pour confirmer les observations échocardiographiques ou pour mieux cartographier le remodelage des cavités; 2) en cas de discordance entre différentes mesures à l'écho ; ou 3) lorsqu'on suspecte un problème structurel sur la base de l'échocardiographie.
Dans cet article, nous traiterons plus en détail du rôle d'une stratégie d'imagerie multimodale après un remplacement valvulaire aortique transfémoral (TAVR) en cas de fuite paravalvulaire ou lorsqu'on mesure un gradient transvalvulaire élevé lors d'une échocardiographie de routine.
Imagerie multimodale après un TAVR dans le contexte d'un gradient transvalvulaire élevé
Les recommandations européennes et américaines actuelles1-4 préconisent une échocardiographie transthoracique (ETT) détaillée dans les 30 jours et dans l'année suivant un TAVR, puis un suivi annuel. Au cours de cet examen, on évalue systématiquement le myocarde (volume/masse du ventricule gauche, fonction systolique globale et régionale, diastologie), les pathologies cardiaques concomitantes et, bien évidemment, la morphologie et l'hémodynamique de la valve aortique (via le pic de vitesse transvalvulaire, le gradient moyen et le calcul de la surface effective de l'orifice [effective orifice area, EOA]). à tout moment, il est important de rester attentif à certains signes d'alarme (les fameux 'red flags', présentés à la figure 1) qui peuvent indiquer une dysfonction de la valve aortique. En particulier, la mesure d'un gradient transvalvulaire moyen supérieur ou égal à 20 mmHg est assez fréquente et le diagnostic différentiel après un TAVR est beaucoup plus complexe que dans le cas d'une sténose de la valve aortique native. Par conséquent, une approche par étapes est nécessaire dans ce cas, pour exclure ou confirmer une dysfonction valvulaire. L'étape 1 consiste à reconfirmer la détérioration hémodynamique, tandis que l'étape 2 recherche l'étiologie de la dysfonction de la valve artificielle.5
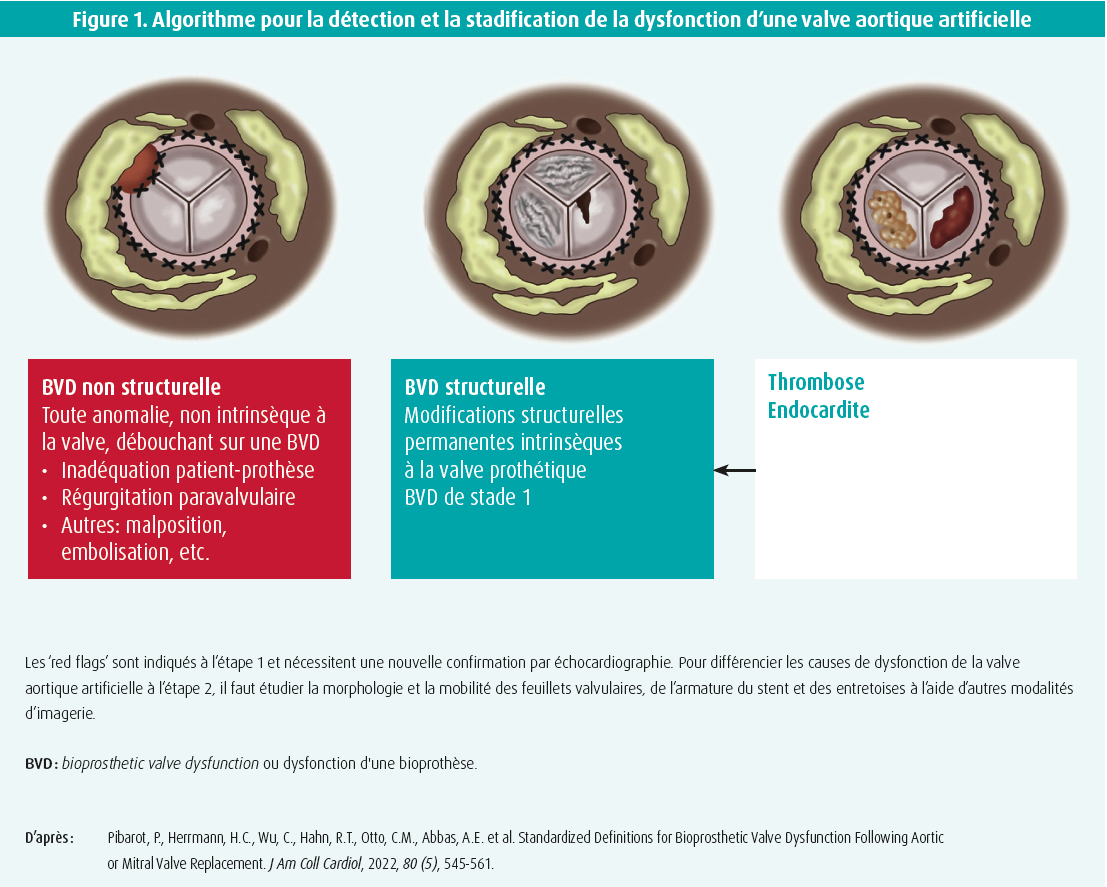
étape 1 : confirmation de la détérioration hémodynamique à l'aide de l'ETT
Tout d'abord, il semble important de confirmer qu'il existe bel et bien une détérioration hémodynamique de la valve aortique artificielle, en tenant compte des éléments suivants :
1) les pièges de l'équation de Bernoulli simplifiée, les principes de la dynamique des fluides et de la contraction du flux (figure 2), 2) les conditions temporelles et hémodynamiques au moment de l'ETT, et 3) les erreurs de mesure possibles (figure 2). Vous en trouverez une description détaillée dans le document complémentaire du Consortium VARC3.6
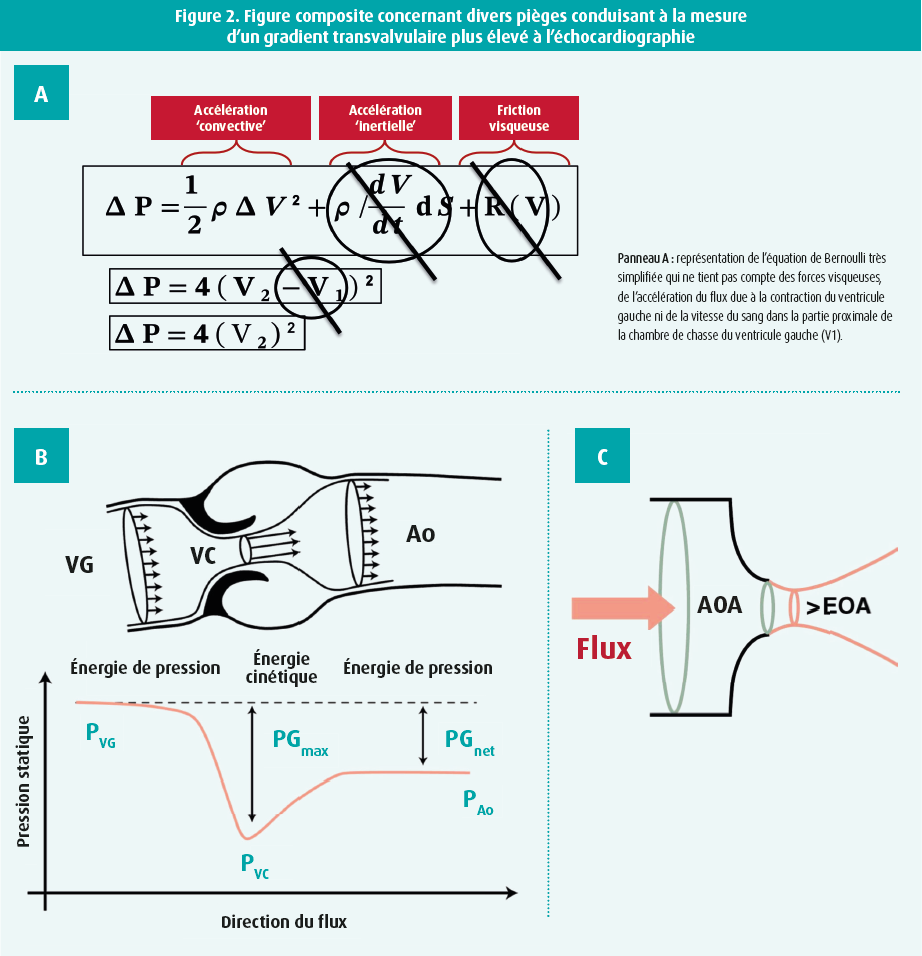

Ces pièges sont brièvement expliqués aux paragraphes ci-dessous. L'échocardiographie calcule le gradient transvalvulaire sur la base du pic de vitesse en utilisant une version très simplifiée de l'équation de Bernoulli (ΔP = 4xV22). Cette formule ne tient pas compte des forces visqueuses ni de l'accélération du flux sanguin due à la contraction du ventricule gauche, pas plus que de la vitesse du flux sanguin dans la LVOT proximale (= V1). Ce sont surtout ces deux derniers facteurs qui sont souvent plus importants que ce qu'on suppose généralement pour la constitution du gradient de pression global. Les ignorer peut donc conduire à une surestimation du gradient de pression sténotique à l'échocardiographie.5,6
En outre, via cette formule, le gradient de pression est calculé sur la base de la vitesse maximale au niveau de la vena contracta (= zone de contraction maximale du jet avec la pression la plus basse/ vitesse du flux sanguin la plus élevée). En aval de la vena contracta, dans l'aorte ascendante, l'énergie cinétique est toutefois reconvertie en énergie thermique (= turbulences) et en énergie potentielle (phénomène dit de rétablissement de la pression dans l'aorte ascendante). De ce fait, la différence de pression nette réelle entre la pression dans le ventricule gauche (avant la sténose) et la pression dans l'aorte ascendante (après la sténose) est inférieure au gradient de pression calculé et, en outre, elle semble plus représentative de l'impact hémodynamique.6,7
Enfin, on néglige souvent l'effet de la contraction du flux. Lorsque le flux sanguin franchit un rétrécissement anatomique (surface anatomique de l'orifice ou anatomical orifice area, AOA), il ne peut changer immédiatement de direction, de sorte que la contraction du flux (constriction des lignes de jet, flow contraction) se poursuit pendant un certain temps en aval du rétrécissement anatomique jusqu'au point de contraction maximale du flux (= la zone de vitesse maximale, pression minimale) au niveau de la vena contracta. La surface effective de l'orifice (EOA) est calculée à l'échocardiographie sur la base de la vitesse maximale au niveau de la vena contracta et elle est donc invariablement estimée plus petite que le rétrécissement anatomique.6,7
Le gradient transvalvulaire moyen dépend fortement du débit. Ainsi, le gradient transvalvulaire peut fortement augmenter, de manière directement proportionnelle au débit à travers la valve, comme dans des situations d'augmentation du débit cardiaque (p. ex. anémie, hyperthyroïdie, fièvre, effort, régurgitation valvulaire aortique ...). Selon le même raisonnement, une augmentation du gradient transvalvulaire en cas d'EOA stable pourrait éventuellement être liée à une amélioration de la fraction d'éjection ventriculaire gauche et du flux, plutôt qu'à une sténose acquise.5,6
Lors du calcul de l'EOA sur la base de l'équation de continuité, il est très important de mesurer le diamètre de la chambre de chasse du ventricule gauche (LVOT) et le signal au Doppler pulsé, au bon endroit. Idéalement, le diamètre de la LVOT doit être mesuré du bord externe au bord externe (outer edge to outer edge) juste en dessous du bord apical de l'armature du stent, en combinaison avec la mesure au Doppler pulsé à cet endroit. Il faut éviter de placer le signal Doppler pulsé trop profondément dans l'armature du stent car, à cet endroit, on se trouve déjà dans la zone d'accélération du flux à l'intérieur du stent.5,8
étape 2 : détection du mécanisme de dysfonction de la valve à l'aide d'autres modalités d'imagerie
Dès que la détérioration hémodynamique est effectivement confirmée à l'échocardiographie, l'étape suivante consiste logiquement à élucider l'étiologie de la dysfonction de la valve artificielle (dysfonction valvulaire non structurelle OU dysfonction valvulaire structurelle OU thrombose valvulaire/endocardite valvulaire pouvant entraîner une dysfonction valvulaire structurelle permanente, figure 1).5,9 Un gradient transvalvulaire élevé ou une diminution de l'EOA, l'index adimensionnel constituent des 'red flags', mais ils ne permettent pas d'identifier le mécanisme exact de la dysfonction valvulaire. Pour pouvoir établir une distinction entre les différentes causes de dysfonction de la valve artificielle, il est important d'étudier la morphologie et la mobilité de la valve artificielle à l'aide d'autres modalités d'imagerie. De par sa meilleure résolution spatiale, le MDCT est généralement plus sensible que l'échocardiographie transthoracique/transoesophagienne (ETT/ETO) pour détecter des anomalies morphologiques de l'armature du stent, des entretoises ou des feuillets valvulaires. Ci-dessous, nous décrirons son utilisation dans différentes situations.
Inadéquation patient-prothèse
La mobilité et la morphologie normales de la valve artificielle sont une des variables-clés (en plus d'une EOA indexée réduite en cas d'EOA préservée) pour faire la distinction entre une inadéquation patient-prothèse (IPP) isolée et une quelconque forme de sténose valvulaire acquise.5,6,10
Thrombose post-TAVR
En fait, depuis 2015, le MDCT est devenu la référence pour le diagnostic d'une thrombose post-TAVR, dont les caractéristiques typiques sont un épaississement des feuillets valvulaires avec hypo-atténuation (hypoattenuated leaflet thickening, HALT) et une réduction du mouvement des feuillets valvulaires (restricted leaflet motion, RLM).11,12 Le HALT est habituellement évalué après une reconstruction multiplanaire offline pendant la phase de coaptation des feuillets valvulaires en diastole. L'épaississement des feuillets valvulaires commence typiquement à leur base (point d'insertion au niveau de l'armature du stent) et il s'étend de manière variable jusqu'au bord central des feuillets valvulaires, leur donnant un aspect méniscoïde sur les projections grand axe.13 Le Valve Academic Research Consortium 3 (VARC3)9 propose d'utiliser une échelle d'évaluation semi-quantitative basée sur le pourcentage estimé de feuillet valvulaire affecté, en commençant au point d'insertion basal. Outre l'évaluation du degré d'épaississement des feuillets valvulaires, la plupart des centres proposent des images volumiques quadridimensionnelles (4D) (une vidéo animée en 4D) sur lesquelles on évalue la mobilité de chaque feuillet valvulaire pendant la systole. Sur ces images, les feuillets valvulaires non épaissis présentant une mobilité normale ne sont visibles que pendant la diastole. En revanche, les feuillets valvulaires présentant une mobilité restrictive se présentent comme une opacité en demi-lune, tant en systole qu'en diastole.12 Le consortium VARC39 recommande une échelle d'évaluation à 4 niveaux pour évaluer la mobilité de chaque feuillet valvulaire séparément. De plus amples études sur les facteurs de risque pour une thrombose (infra)clinique post-TAVR et sur les répercussions cliniques sont actuellement en cours.
Endocardite sur TAVR
Il n'existe pas de recommandations spécifiques concernant l'endocardite sur TAVR. Toutefois, les recommandations européennes et américaines relatives à l'endocardite sur valve artificielle3,14 affirment sans ambiguïté que l'échocardiographie reste l'imagerie de première ligne qui, parallèlement aux données cliniques et microbiologiques, est intégrée dans les 'critères de Duke modifiés'. Cependant, l'endocardite sur TAVR évolue souvent de manière insidieuse, sans fièvre, avec un épaississement hétérogène des feuillets valvulaires et une légère obstruction de la valve plutôt qu'une destruction complète de la valve.14,15,16 Par conséquent, la sensibilité de l'ETT et de l'ETO est limitée et typiquement plus faible dans le contexte d'une endocardite sur TAVR comparativement à une endocardite sur une valve artificielle ou une valve native. Ceci a été confirmé à nouveau dans une analyse récente du registre TAVR suisse17 où, dans environ 1 cas sur 2 d'endocardite sur TAVR, l'ETT et/ou l'ETO ont été considérées comme normales ou non concluantes.
Dès lors, d'autres modalités d'imagerie telles que le MDCT ou la tomographie par émission de positrons au fluorodésoxyglucose (FDG-PET) se révèlent extrêmement utiles pour augmenter la précision diagnostique dans ce contexte. Grâce à sa résolution spatiale élevée, le MDCT détecte facilement et avec une extrême précision les végétations de grande taille (pas trop mobiles) et les complications périvalvulaires.18 En revanche, sa résolution temporelle est légèrement inférieure, ce qui signifie que de petites végétations très mobiles ou des perforations valvulaires pourraient théoriquement passer inaperçues. En raison de ce profil spécifique et du manque de données, le MDCT n'est actuellement pas une modalité de première ligne, mais il s'avère donc extrêmement utile en cas d'échocardiographie négative malgré un degré élevé d'épaississement, ou pour évaluer l'étendue périvalvulaire de l'endocardite.
Le FDG-PET a une sensibilité élevée, mais une spécificité limitée pour détecter l'endocardite sur valve artificielle. D'une part, la migration des cellules immunitaires (qui expriment fortement les récepteurs au glucose et ont donc une captation élevée du FDG) a l'avantage de se produire tôt dans le processus de la maladie, avant les anomalies morphologiques. D'autre part, on observe parfois une augmentation de la captation 'physiologique' du FDG dans des zones non infectieuses d'inflammation chronique/aseptique comme, par exemple, autour de l'anneau de la valve artificielle au cours des trois premiers mois suivant la chirurgie cardiaque. Cependant, une étude récente d'un groupe québécois19 a pu démontrer qu'il n'y a pas de captation 'physiologique' du FDG dans les trois premiers mois suivant un TAVR, ce qui signifie qu'on peut vraisemblablement utiliser le FDG-PET précocement après un TAVR. D'autres études ont montré que l'ajout du FDG-PET aux 'critères de Duke modifiés' augmentait considérablement la spécificité, sans trop perdre en sensibilité. Le FDG-PET est donc extrêmement utile pour confirmer le diagnostic d'endocardite post-TAVR en cas de doute sur la base de l'échocardiographie.15,16,20 Par contre, la scintigraphie aux globules blancs marqués (WBC scintigraphy) a une spécificité élevée mais une sensibilité relativement limitée pour le diagnostic d'une endocardite sur valve artificielle, car la plupart des végétations contiennent relativement peu de granulocytes. Les recommandations européennes14 indiquent dès lors que la WBC scintigraphy peut être utilisée dans les situations cliniques nécessitant une augmentation de la spécificité, comme en cas de FDG-PET douteux.15,16
Imagerie multimodale après un TAVR dans le contexte d'une fuite paravalvulaire
Une fuite paravalvulaire modérée à sévère (régurgitation paravalvulaire [RPV]) après un TAVR est associée à une augmentation de 2,3 fois de la mortalité. Les études concernant l'impact pronostique d'une RPV légère ont jusqu'à présent donné des résultats contradictoires, bien qu'on admette généralement qu'un petit volume régurgitant peut déjà être hémodynamiquement significatif chez le patient 'TAVR typique' présentant un ventricule gauche rigide et restrictif.
Les recommandations actuelles subdivisent la RPV en légère/modérée/sévère sur la base d'une approche multiparamétrique intégrée.2,4 En première ligne, ce schéma de classification repose fortement sur l'échocardiographie Doppler couleur et spectrale, qui présentent toutes deux de nombreuses lacunes dans la gradation de la RPV.
En effet, on observe généralement de multiples jets dans l'espace paravalvulaire, avec un trajet excentrique ou aberrant. Les jets de RPV au niveau du far-field (postérieur à l'ETT, antérieur à l'ETO) sont souvent difficiles à visualiser en raison du cône d'ombre acoustique dû au calcium natif ou à l'armature du stent, ce qui complique évidemment leur classification. Ainsi, pour détecter tous les jets de RPV, il est essentiel d'avoir plusieurs vues d'écho (y compris parfois une imagerie hors axe). En outre, la vena contracta de chaque jet de RPV se situe également à un niveau différent et la plupart des jets s'élargissent presque immédiatement après avoir atteint la chambre de chasse du ventricule gauche.
Ces deux dernières caractéristiques peuvent compliquer l'évaluation de l'étendue circonférentielle de chaque jet de RPV sur une vue parasternale petit axe (qui est considérée comme une des pierres angulaires pour la gradation de la RPV).21,22 Il est important de savoir que l'étendue circonférentielle peut varier de manière significative en fonction du plan choisi pour la vue parasternale petit axe. à cet égard, la meilleure technique semble être de partir d'une vue parasternale grand axe et de scanner l'ensemble de l'armature du stent depuis la chambre de chasse du ventricule gauche jusqu'à l'extrémité distale dans la racine aortique. Tout d'abord, le jet doit atteindre la chambre de chasse du ventricule gauche pour être véritablement considéré comme une 'régurgitation'. Ensuite, il est indiqué de rechercher la vena contracta sur la vue parasternale grand axe pour chaque jet de RPV séparément, et de créer une image multiplan (biplan ou plan X) à travers cette vena contracta pour obtenir la vue parasternale petit axe correcte (et permettre ainsi une évaluation correcte de l'étendue circonférentielle pour chaque jet de RPV séparément).
La largeur de la vena contracta est souvent difficile à visualiser à l'ETT et elle est en outre peu fiable à l'ETO, en raison de la forme irrégulière de la zone de la vena contracta. Il semble donc plus approprié d'utiliser la surface de la vena contracta en 3D (3D VCA) pour supprimer ces limitations géométriques.23
Les mesures au Doppler spectral peuvent s'avérer complémentaires mais, d'un autre côté, elles peuvent aussi induire une confusion. La dysfonction diastolique est fréquente dans la population TAVR et elle peut conduire à un temps de demi-pression plus court, donnant ainsi une fausse impression de RPV sévère. La rigidité aortique entraîne une inversion du flux diastolique chez de nombreux patients âgés, même en l'absence de RPV significative.2,4,21
Si tous les paramètres échographiques indiquent une RPV légère ou sévère, il va de soi que le grade est clair. Cependant, on mesure souvent des valeurs intermédiaires, de sorte qu'une quantification supplémentaire est indiquée, par exemple en calculant le volume régurgitant à l'aide d'une méthode volumétrique ou du Doppler pulsé. Cependant, il subsiste encore trop souvent une discordance entre les différentes mesures échocardiographiques, de sorte que, dans ce cas, on peut recourir à la quantification au moyen de la RMC.24-26 La RMC permet de calculer le volume régurgitant directement par cartographie de vitesse en contraste de phase juste au-dessus de l'armature du stent, sans calculs complexes, indépendamment du nombre de jets, de leur morphologie et même du fait que le jet ait été visualisé auparavant ou non. En outre, la variabilité inter- et intra-observateur est nettement plus faible comparativement à l'ETT. En revanche, des arythmies et des artéfacts de mouvement peuvent parfois altérer la qualité des images. En outre, le flux coronaire diastolique est inclus dans l'évaluation finale du volume régurgitant, ce qui peut entraîner une légère surestimation de la RPV à la RMC. Des études à petite échelle portant sur un petit nombre de patients ont montré que la RMC tend à 'surclasser' la RPV de 1 grade, peut-être en raison d'une sous-estimation du grade de la RPV à l'ETT.27 Une étude multicentrique récente portant sur 135 patients a montré un lien possible entre la fraction régurgitante après un TAVR, calculée par RMC, et un critère d'évaluation combiné de mortalité et des hospitalisations pour insuffisance cardiaque.28
Conclusion
L'évolution de l'imagerie cardiaque a révolutionné la cardiologie, en affinant la planification préprocédurale et en permettant des interventions valvulaires percutanées de plus en plus complexes. Après la procédure, l'ETT reste la modalité d'imagerie de première ligne en raison de sa facilité d'utilisation, sans produit de contraste, et de sa grande disponibilité. Actuellement, il existe de plus en plus de preuves (en particulier après un TAVR) en faveur de l'utilisation d'autres modalités d'imagerie avancées telles que le MDCT, la RMC ou même l'imagerie nucléaire.
Références
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2021, 43 (7), 1-72.
- Zoghbi, W.A., Asch, F.M., Bruce, C., Gillam, L.D., Grayburn, P.A., Hahn, R.T. et al. Guidelines for the Evaluation of Valvular Regurgitation After Percutaneous Valve Repair or Replacement A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, J Am Soc Echocardiogr, 2019, 32 (4), 1-45.
- Otto, C.M., Nishimura, R.A., Bonow, R., Carabello, B.A., Erwin, J.P., Gentile, F. et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease. Circulation, 2021, 143 (5), e35-e71.
- Lancellotti, P., Pibarot, P., Chambers, J., Edvardsen, T., Delgado, V., Dulgheru, R. et al. Recommendations for the imaging assessment of prosthetic heart valves: a report from the European Association of Cardiovascular Imaging endorsed by the Chinese Society of Echocardiography, the Inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2016, 17 (6), 589-590.
- Pibarot, P., Herrmann, H.C., Wu, C., Hahn, R.T., Otto, C.M., Abbas, A.E. et al. Standardized Definitions for Bioprosthetic Valve Dysfunction Following Aortic or Mitral Valve Replacement. J Am Coll Cardiol, 2022, 80 (5), 545-561.
- Herrmann, H.C., Pibarot, P., Wu, C., Hahn, R.T., Tang, G.H.L., Abbas, A.E. et al. Bioprosthetic Aortic Valve Hemodynamics: Definitions, Outcomes, and Evidence Gaps. J Am Coll Cardiol, 2022, 80 (5), 527-544.
- Bach, D.S. Echo/Doppler Evaluation of Hemodynamics After Aortic Valve Replacement. JACC Cardiovasc Imaging, 2010, 3 (3), 296-304.
- Hahn, R.T., Leipsic, J., Douglas, P.S., Jaber, W.A., Weissman, N.J., Pibarot, P. et al. Comprehensive Echocardiographic Assessment of Normal Transcatheter Valve Function. JACC Cardiovasc Imaging, 2019, 12 (1), 25-34.
- Généreux, P., Piazza, N., Alu, M.C., Nazif, T., Hahn, R.T., Pibarot, P. et al. Valve Academic Research Consortium 3: Updated Endpoint Definitions for Aortic Valve Clinical Research. J Am Coll Cardiol, 2021, 77 (21), 2717-2746.
- Pibarot, P., Magne, J., Leipsic, J., Côté, N., Blanke, P., Thourani, V.H. et al. Imaging for Predicting and Assessing Prosthesis-Patient Mismatch After Aortic Valve Replacement. JACC Cardiovasc Imaging, 2019, 12 (1), 149-162.
- Makkar, R.R., Fontana, G., Jilaihawi, H., Chakravarty, T., Kofoed, K.F., De Backer, O. et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engl J Med, 2015, 373 (21), 2015-2024.
- Chakravarty, T., Søndergaard, L., Friedman, J., De Backer, O., Berman, D., Kofoed, K.F. et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. The Lancet, 2017, 389 (10087), 2383-2392.
- Blanke, P., Weir-McCall, J.R., Achenbach, S., Delgado, V., Hausleiter, J., Jilaihawi, H. et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR). JACC Cardiovasc Imaging, 2019, 12 (1), 1-24.
- Habib, G., Lancellotti, P., Antunes, M.J., Bongiorni, M.G., Casalta, J.P., Del Zotti, F. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J, 2015, 36 (44), 3075-3128.
- Del Val, D., Panagides, V., Mestres, C.A., Miró, J.M., Rodés-Cabau, J. Infective Endocarditis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2023, 81 (4), 394-412.
- Dilsizian, V., Budde, R.P.J., Chen, W., Mankad, S.V., Lindner, J.R., Nieman, K. Best Practices for Imaging Cardiac Device-Related Infections and Endocarditis. JACC Cardiovasc Imaging, 2022, 15 (5), 891-911.
- Stortecky, S., Heg, D., Tueller, D., Pilgrim, T., Muller, O., Noble, S. et al. Infective Endocarditis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2020, 75 (24), 3020-3030.
- Khalique, O.K., Veillet-Chowdhury, M., Choi, A.D., Feuchtner, G., Lopez-Mattei, J. Cardiac computed tomography in the contemporary evaluation of infective endocarditis. J Cardiovasc Comput Tomogr, 2021, 15 (4), 304-312.
- Del Val, D., Trottier, M., Alperi, A., Muntané- Carol, G., Faroux, L., Delarochellière, R. et al. 18 F-Fluorodeoxyglucose Uptake Pattern in Noninfected Transcatheter Aortic Valves. Circ Cardiovasc Imaging, 2020, 13 (11), e011749.
- Wahadat, A.R., Tanis, W., Swart, L.E., Scholtens, A., Krestin, G.P., Van Mieghem, N.M.D.A. et al. Added value of 18F-FDGPET/ CT and cardiac CTA in suspected transcatheter aortic valve endocarditis. J Nucl Cardiol, 2021, 28 (5), 2072-2082.
- Pibarot, P., Hahn, R.T., Weissman, N.J., Monaghan, M.J. Assessment of Paravalvular Regurgitation Following TAVR. JACC Cardiovasc Imaging, 2015, 8 (3), 340-360.
- Tuzcu, E.M., Kapadia, S.R., Svensson, L.G. Valve Design and Paravalvular Aortic Regurgitation: New Insights from the French Registry. Circulation, 2014, 129 (13), 1378-1380.
- Gonçalves, A., Almeria, C., Marcos-Alberca, P., Feltes, G., Hernández-Antolín, R., Rodríguez, E. et al. Three-Dimensional Echocardiography in Paravalvular Aortic Regurgitation Assessment after Transcatheter Aortic Valve Implantation. J Am Soc Echocardiogr, 2012, 25 (1), 47-55.
- Lee, J.C., Branch, K.R., Hamilton-Craig, C., Krieger, E.V. Evaluation of aortic regurgitation with cardiac magnetic resonance imaging: a systematic review. Heart, 2018, 104 (2), 103-110.
- Corrigan, F.E., Gleason, P.T., Condado, J.F., Lisko, J.C., Chen, J.H., Kamioka, N. et al. Imaging for Predicting, Detecting, and Managing Complications After Transcatheter Aortic Valve Replacement. JACC Cardiovasc Imaging, 2019, 12 (5), 904-920.
- Cavalcante, J.L., Lalude, O.O., Schoenhagen, P., Lerakis, S. Cardiovascular Magnetic Resonance Imaging for Structural and Valvular Heart Disease Interventions. JACC Cardiovasc Interv, 2016, 9 (5), 399-425.
- Hartlage, G.R., Babaliaros, V.C., Thourani, V.H., Hayek, S., Chrysohoou, C., Ghasemzadeh, N. et al. The role of cardiovascular magnetic resonance in stratifying paravalvular leak severity after transcatheter aortic valve replacement: an observational outcome study. J Cardiovasc Magn Reson, 2014, 16 (1), 93.
- Ribeiro, H.B., Orwat, S., Hayek, S.S., Larose, é., Babaliaros, V., Dahou, A. et al. Cardiovascular Magnetic Resonance to Evaluate Aortic Regurgitation After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2016, 68 (6), 577-585.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.