Het afgelopen decennium is de transitie van openhartchirurgie naar minimaal invasieve percutane procedures volop ingezet binnen de context van structureel hartlijden. Voor een veilige navigatie in de driedimensionale (3D)-ruimte is het van cruciaal belang om verschillende beeldvormingstechnieken zoals 2D/3D-echocardiografie, multidetector computertomografie (MDCT) en cardiale magnetische resonantiebeeldvorming (CMR) gecombineerd te gebruiken tijdens de pre-procedurele planning van dergelijke percutane interventies.
Daarnaast werd recentelijk duidelijk dat een multimodale beeldvormingsstrategie ook uitermate zinvol kan zijn in de post-procedurele setting, wat het specifieke focuspunt van dit artikel is. Hoewel doppler-echocardiografie steevast onze eerstelijns beeldvormingsmodaliteit blijft tijdens follow-up na percutane klepinterventies, maken we vandaag steeds vaker gebruik van andere geavanceerde beeldvormingstechnieken zoals MDCT, CMR of zelfs nucleaire beeldvorming. In de klinische praktijk wordt hiertoe overgegaan: 1) ter bevestiging van de echocardiografische bevindingen of om kamer-remodellering beter in kaart te brengen; 2) in geval van discrepantie tussen verschillende echometingen; of 3) wanneer een structureel probleem vermoed wordt op basis van echocardiografie.
In dit artikel wordt dieper ingegaan op de rol van een multimodale beeldvormingsstrategie na transfemorale aortaklepvervanging (TAVR) in geval van paravalvulaire lekkage of wanneer een verhoogde transvalvulaire gradiënt wordt gemeten bij routine-echocardiografie.
Multimodale beeldvorming na TAVR in de setting van een verhoogde transvalvulaire gradiënt
De huidige Europese en Amerikaanse richtlijnen1-4 adviseren een uitgebreide transthoracale echocardiografie (TTE) binnen de dertig dagen en één jaar na TAVR, gevolgd door jaarlijkse follow-up. Tijdens dit onderzoek beoordeelt men routinematig het myocard (linkerventrikelvolume/ massa, globale en regionale systolische functie, diastologie), concomitante cardiale pathologie en uiteraard de aortakunstklep-morfologie -en hemodynamiek (middels transvalvulaire pieksnelheid, gemiddelde gradiënt en berekening van het effectieve doorstroomoppervlak (effective orifice area, [EOA]). Te allen tijde is het belangrijk om uit te kijken voor bepaalde alarmtekenen (zogenaamde 'rode vlaggen', afgebeeld in figuur 1) die mogelijk wijzen op een disfunctie van de aortakunstklep. Vooral het meten van een gemiddelde transvalvulaire gradiënt groter dan of gelijk aan 20 mmHg is vrij frequent en de differentiële diagnose na TAVR is veel complexer ten opzichte van natieve aortaklepstenose. Bijgevolg is in dit geval een stapsgewijze aanpak nodig om klepdisfunctie uit te sluiten of te bevestigen. Stap 1 bestaat erin de hemodynamische achteruitgang te herbevestigen, terwijl in stap 2 op zoek wordt gegaan naar de etiologie van kunstklepdisfunctie.5
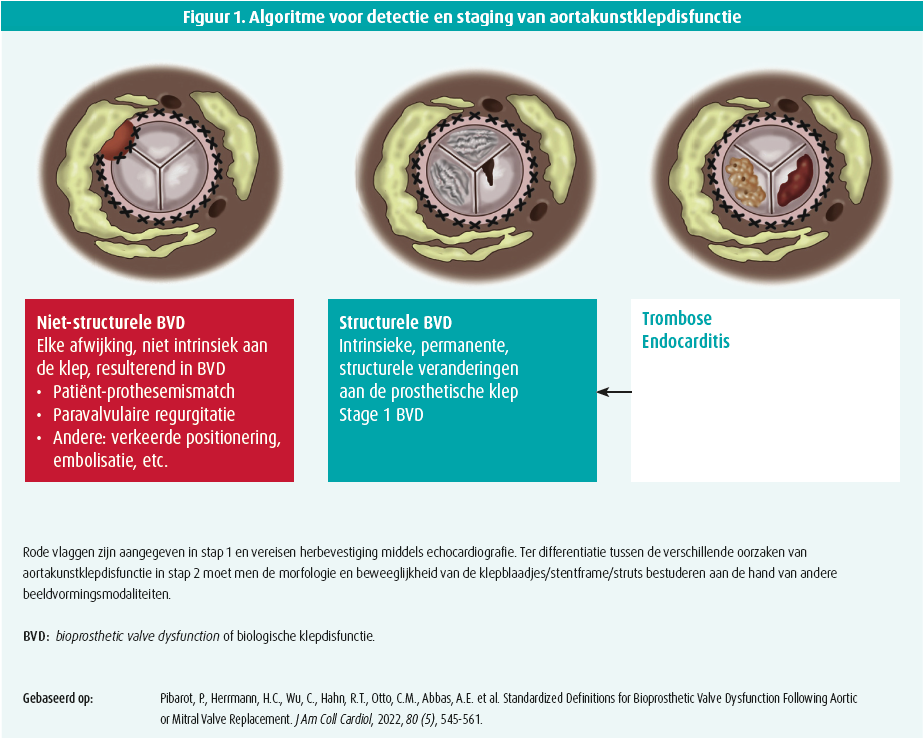
Stap 1: bevestiging van hemodynamische deterioratie middels TTE
Eerst en vooral lijkt het belangrijk om te bevestigen dat er wel degelijk sprake is van hemodynamische deterioratie van de aortakunstklep, rekening houdende met: 1) de valkuilen van de vereenvoudigde bernoulliformule, de beginselen van vloeistofdynamica en flowcontractie (figuur 2), 2) het tijdstip & hemodynamische condities ten tijde van TTE, en 3) mogelijke meetfouten (figuur 2). Een uitgebreide beschrijving kan u terugvinden in de companion-paper van het VARC3-Consortium.
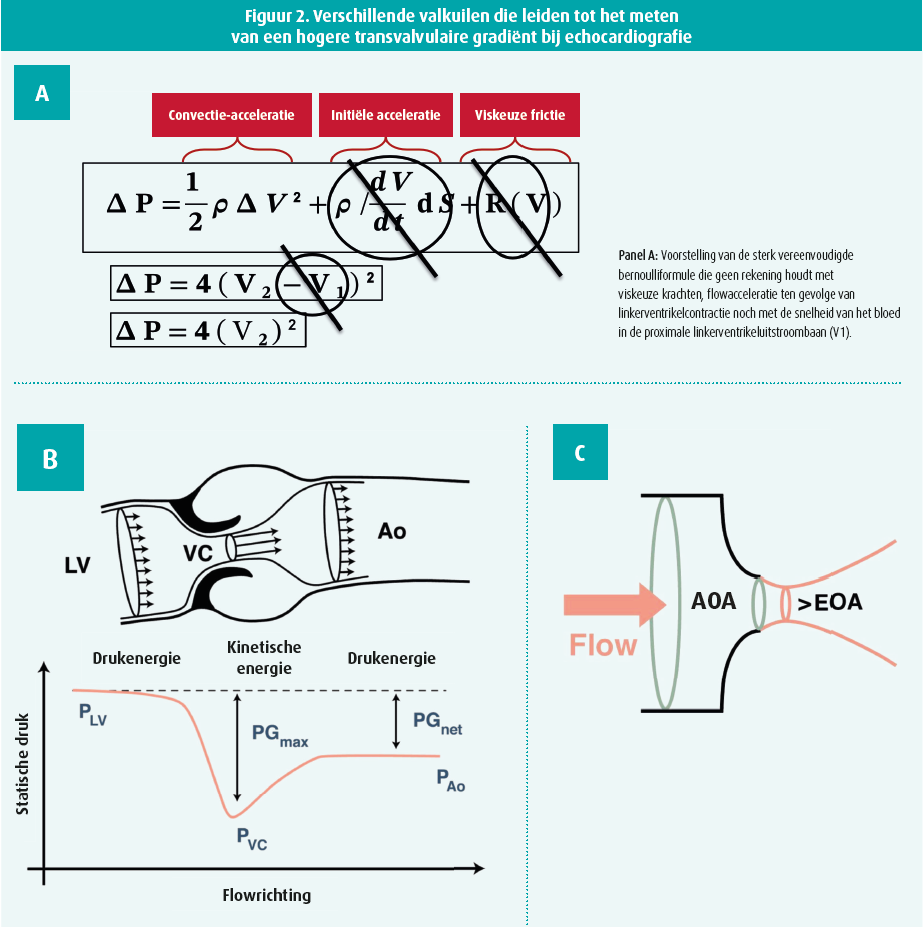

Dergelijke valkuilen worden in de alinea's hierna kort toegelicht. Echocardiografie berekent de transvalvulaire gradiënt op basis van de pieksnelheid aan de hand van een sterk vereenvoudigde versie van van de bernoulliformule (ΔP= 4xV22). Deze formule houdt geen rekening met viskeuze krachten noch met de acceleratie van de bloedstroom ten gevolge van linkerventrikelcontractie of met de bloedstroomsnelheid in de proximale LVOT (de zogenaamde V1). Vooral de twee laatstgenoemden zijn vaak belangrijker dan algemeen aangenomen voor de opbouw van algehele drukgradiënt. Het negeren ervan kan dan ook leiden tot een overschatting van de stenotische drukgradiënt middels echocardiografie.5,6
Bovendien wordt de drukgradiënt via deze formule berekend op geleide van de pieksnelheid op het niveau van de vena contracta (= zone van maximale fluid-jetcontractie met laagste druk/ hoogste bloedstroomsnelheid). Distaal van de vena contracta, in de aorta ascendens wordt kinetische energie echter opnieuw omgezet tot thermische energie (i.e. turbulentie) en potentiële energie (het zogenaamde fenomeen van het drukherstel in de aorta ascendens). Het reële netto drukverschil tussen de druk in het linkerventrikel (vóór de stenose) en de druk in de aorta ascendens (na de stenose) is hierdoor dus lager dan de berekende drukgradiënt en lijkt bovendien meer representatief voor de hemodynamische impact.6,7
Tot slot wordt vaak het effect van flowcontractie genegeerd. Wanneer de bloedstroom een anatomische vernauwing passeert (anatomisch doorstroomoppervlak of anatomical orifica area, [AOA]) kan deze niet onmiddellijk van richting veranderen zodat de flowcontractie (constrictie van de jetlijnen, flowcontractie) nog verder geschiedt voor een zekere lengte achter de anatomische vernauwing tot het punt van maximale flowcontractie (= de zone van maximale snelheid, minimale druk) op het niveau van de vena contracta. Het effectieve doorstroomoppervlak (EOA) wordt middels echocardiografie berekend op geleide van de pieksnelheid ter hoogte van de vena contracta en is derhalve steevast kleiner ingeschat dan de anatomische vernauwing.6,7
De gemiddelde transvalvulaire gradiënt is sterk flowafhankelijk. De transvalvulaire gradiënt kan dus sterk toenemen in directe verhouding tot de flow over de klep zoals in omstandigheden die de cardiale output verhogen (bv. anemie, hyperthyreoïdie, koorts, inspanning, aortaklepregurgitatie …). Een stijging van de transvalvulaire gradiënt bij stabiele EOA kan volgens dezelfde redenering mogelijk verband houden met een verbetering in linkerventrikelejectiefractie en uitstroom, in plaats van een verworven stenose.5,6
Bij de berekening van het EOA op basis van de continuïteitsvergelijking is het van groot belang om de linkerventrikeluitstroombaan (LVOT)-diameter en pulsed-wave dopplersignaal, op de juiste plaats op te meten. Idealiter wordt de LVOT-diameter gemeten van buitenrand tot buitenrand (outer edge to outer edge) net onder de apicale rand van het stentframe in combinatie met de pulsed-dopplermeting op deze locatie. Men moet vermijden om het pulsed-dopplersignaal te diep in het stentframe te plaatsen omdat men zich dan reeds in de zone van in-stent flowacceleratie bevindt.5,8
Stap 2: opsporing van het mechanisme van klepdisfunctie aan de hand van andere beeldvormingsmodaliteiten
Zodra de hemodynamische achteruitgang effectief bevestigd wordt bij echocardiografie, is de logische volgende stap om de etiologie van kunstklepdisfunctie uit te klaren (niet-structurele klepdisfunctie OF structurele klepdisfunctie OF kleptrombose/klependocarditis mogelijk leidend tot permanente structurele klepdisfunctie, figuur 1).5,9 Een verhoogde transvalvulaire gradiënt of gereduceerde EOA, dimensieloze index zijn louter 'rode vlaggen', maar ze laten niet toe om het exacte mechanisme van klepdisfunctie te achterhalen. Om te kunnen differentiëren tussen de verschillende oorzaken van kunstklepdisfunctie is het van belang de morfologie en beweeglijkheid van de kunstklep te bestuderen aan de hand van andere beeldvormingsmodaliteiten. MDCT is doorgaans sensitiever dan transthoracale/transoesofageale echocardiografie (TTE/TEE) om morfologische afwijkingen van het stentframe, struts of klepblaadjes op te sporen door zijn betere spatiale resolutie. Hieronder wordt de toepassing ervan besproken in verschillende situaties.
Patiënt-prothesemismatch
Een normale beweeglijkheid en morfologie van de kunstklep is een van de sleutelvariabelen (naast een gereduceerde geïndexeerde EOA bij bewaarde EOA) om het onderscheid te maken tussen geïsoleerde patiënt-prothesemismatch (PPM) en eender welke vorm van verworven klepstenose.5,6,10
TAVR-trombose
Sedert 2015 is MDCT zelfs de gouden standaard geworden voor de diagnose van TAVR-trombose met hypoattenuerende verdikking en restrictieve beweeglijkheid van de klepblaadjes als typische kenmerken (respectievelijk hypoattenuated leaflet thickening [HALT] en beperkte klepbladbeweging [restricted leaflet motion, RLM]).11,12 HALT wordt gewoonlijk beoordeeld na offline multiplanaire reconstructie tijdens de fase van klepbladcoaptatie in diastole. Klepbladverdikking start typisch aan de basis van het klepblad (insertiepunt aan het stentframe) en breidt in variabele mate uit naar de centrale rand van het klepblad waardoor het klepblad een soort meniscusachtige vorm krijgt op de lange-asprojecties.13 Het Valve Academic Research Consortium 3 (VARC3)9 stelt voor om een semi-kwantitatieve beoordelingsschaal te gebruiken gebaseerd op het geschatte percentage klepblad dat aangetast is, te beginnen aan het basale insertiepunt. Naast een beoordeling van de mate van klepbladverdikking, bieden de meeste centra vierdimensionale (4D) volume-rendered beelden (een zogenaamde 4D volume-rendered geanimeerde video) aan waarop de beweeglijkheid van elk klepblad tijdens de systole wordt beoordeeld. Niet-verdikte klepbladen met een normale beweeglijkheid zijn enkel te zien tijdens diastole op deze beelden. Klepbladen met een restrictieve beweeglijkheid daarentegen, zijn te zien als een halvemaanvormige opaciteit zowel tijdens systole als diastole.12 Het VARC3-consortium9 adviseert een beoordelingsschaal met vier niveaus om de beweeglijkheid van elk klepblad afzonderlijk in te schatten. Verder onderzoek naar de risicofactoren van (sub-) klinische TAVR-trombose en de klinische repercussies is momenteel volop aan de gang.
TAVR-endocarditis
Er bestaan geen specifieke richtlijnen voor TAVR-endocarditis. Zowel de Europese als Amerikaanse richtlijnen voor kunstklep-endocarditis3,14 stellen echter eenduidig dat echocardiografie de eerstelijns beeldvorming blijft die samen met klinische en microbiologische gegevens wordt geïntegreerd binnen de modified-Duke-criteria. TAVR-endocarditis kent echter vaak een insidieus verloop met afwezigheid van koorts, heterogene verdikking van de klepbladen en milde klepobstructie in plaats van complete klepdestructie.14,15,16 Hierdoor is de gevoeligheid van TTE & TEE beperkt en typisch lager in de context van TAVR-endocarditis ten opzichte van kunstklep-endocarditis of endocarditis van de natieve klep. Dit werd nogmaals bevestigd in een recente analyse van de Swiss TAVR-registry17 waarbij in ongeveer 1 op 2 gevallen met TAVR-endocarditis TTE en/of TEE ofwel als normaal ofwel als inconclusief beoordeeld werd.
Andere beeldvormingsmodaliteiten zoals MDCT of fluorodeoxyglucosepositronemissietomografie (FDG-PET) zijn dus uitermate nuttig om de diagnostische accuraatheid in deze setting te verhogen. MDCT kan dankzij zijn hoge spatiale resolutie met grote accuraatheid grote (niet al te mobiele) vegetaties en perivalvulaire complicaties makkelijk opsporen.18 Anderzijds ligt de temporele resolutie iets lager waardoor theoretisch kleine, zeer mobiele vegetaties of klepperforaties kunnen worden gemist. Vanwege dit specifieke profiel en mede gezien de schaarste aan data is MDCT momenteel geen eerstelijns modaliteit maar dus uitermate nuttig in geval van negatieve echocardiografie ondanks een hoge graad van verdikking, of ter beoordeling van de perivalvulaire uitgebreidheid van endocarditis.
FDG-PET biedt hoge sensitiviteit maar beperkte specificiteit om kunstklep-endocarditis op te sporen. Enerzijds bestaat het voordeel dat immuuncelmigratie (met hoge expressie glucose-receptors en dus hoge FDG-opname) vroegtijdig in het ziekteproces optreedt vóór morfologische afwijkingen. Anderzijds vindt soms verhoogde 'fysiologische' FDG-opname plaats in niet-infectieuze zones van chronische/ steriele inflammatie zoals bijvoorbeeld rondom de kunstklepring binnen de eerste drie maanden na cardiale heelkunde. Een recente studie van de groep van Quebec19 kon echter aantonen dat er geen 'fysiologische' FDG-opname plaatsvindt binnen de eerste drie maanden na TAVR, wat betekent dat we FDG-PET vermoedelijk vroegtijdig na TAVR reeds kunnen gebruiken. Andere studies toonden aan dat de toevoeging van FDG-PET bovenop de modified-Duke-criteria de sensitiviteit in belangrijke mate verhoogt, zonder al te veel in te boeten op sensitiviteit. FDG-PET is dus uitermate zinvol om de diagnose van TAVR-endocarditis te bevestigen in geval van twijfel op basis van echocardiografie.15,16,20 Wittebloedcellenscintigrafie (WBC-scintigrafie), daarentegen heeft een hoge specificiteit maar relatieve beperkte sensitiviteit voor de diagnose van kunstklep-endocarditis aangezien de meeste vegetaties relatief weinig granulocyten bevatten. De Europese richtlijnen14 stellen daarom dat WBC-scintigrafie kan worden gebruikt in klinische situaties die een verhoging van specificiteit vereisen, zoals in geval van een dubieuze FDG-PET.15,16
Multimodale beeldvorming na TAVR in de setting van paravalvulaire lekkage
Matige tot ernstige paravalvulaire lekkage (paravalvulaire regurgitatie [PVR]) na TAVR is geassocieerd met een 2,3-voudige verhoging van de mortaliteit. Studies omtrent de prognostische impact van mild PVR leverden tot dusver tegenstrijdige resultaten op, hoewel algemeen wordt aangenomen dat een klein regurgiterend volume reeds hemodynamisch significant kan zijn bij de typische TAVR-patiënt met een stijf restrictief linkerventrikel.
De huidige richtlijnen classificeren PVR als mild/matig/ernstig aan de hand van een geïntegreerde multiparametrische aanpak.2,4 In de eerste lijn is dit classificatieschema sterk afhankelijk van kleuren- en spectrale dopplerechocardiografie die beide vele tekortkomingen vertonen bij de gradering van PVR.
Doorgaans zijn er immers multipele jets in de paravalvulaire ruimte met een excentrisch of aberrant verloop. PVR-jets in the far-field (posterieur bij TTE, anterieur bij TEE) zijn vaak moeilijk te visualiseren door akoestische slagschaduw ten gevolge van natief calcium of het stentframe, wat uiteraard hun gradering bemoeilijkt. Om alle PVR-jets op te sporen is het dus essentieel om meerdere echo-views op te nemen (inclusief soms off-axis imaging). Bovendien ligt de vena contracta van elke PVR-jet ook nog eens op een verschillend niveau en verbreden de meeste jets quasi onmiddellijk na het bereiken van de linkerventrikeluitstroombaan.
Deze twee laatstgenoemde kenmerken kunnen de beoordeling van de circumferentiële omvang van elke PVR-jet op een parasternaal korte-asbeeld bemoeilijken (wat beschouwd wordt als een van de hoekstenen voor gradering van PVR).21,22 Het is belangrijk om zich ervan bewust te zijn dat de circumferentiële omvang in belangrijke mate kan variëren afhankelijk van het gekozen vlak voor het parasternale korte-asbeeld. De beste techniek lijkt hierbij om te starten vanaf een parasternaal lange-asbeeld en het gehele stentframe te scannen gaande van de linkerventrikeluitstroombaan tot en met het distale einde in de aortawortel. Eerst en vooral moet de jet wel degelijk de linkerventrikeluitstroombaan bereiken om werkelijk als 'regurgitatie' beschouwd te worden. Vervolgens is het aangewezen om voor elke PVR-jet afzonderlijk op zoek te gaan naar de vena contracta in het parasternale lange-asbeeld en een multi-plane (biplane of X-plane) beeld in te stellen doorheen deze vena contracta om het correcte parasternale korte-asbeeld te bereiken (en dus een correcte beoordeling van de circumferentiële omvang voor elke PVR-jet afzonderlijk toe te laten).
De breedte van de vena contracta is vaak moeilijk te visualiseren op TTE en bovendien weinig betrouwbaar op TEE door de onregelmatige vorm van de vena contracta-zone. In plaats daarvan lijkt het daarom eerder aangewezen de 3D vena contracta-area (3D VCA) om deze geometrische beperkingen te elimineren.23
Spectrale dopplermetingen kunnen complementair zijn, maar anderzijds ook verwarring in de hand werken. Diastolische disfunctie is frequent binnen de TAVR-populatie en kan leiden tot een kortere pressure half-time en geeft dus de valse indruk dat PVR ernstig is. Stijfheid van de aorta leidt bij veel oudere patiënten tot diastolische flow reversal zelfs in afwezigheid van significante PVR.2,4,21
Als alle echo-parameters wijzen op mild of ernstig PVR is de gradering uiteraard duidelijk. Vaak meet men echter intermediaire waarden waardoor aanvullende kwantificatie is aangewezen, bijvoorbeeld door het regurgiterende volume met een volumetrische of pulsed-dopplermethode te berekenen. Al te vaak bestaat echter hierna nog steeds een discrepantie tussen de verschillende echocardiografische metingen, zodat in dit geval kan worden overgegaan tot kwantificatie middels CMR.24-26 CMR laat toe om het regurgiterende volume rechtstreeks te berekenen door phase-contrast velocity mapping net boven het stentframe zonder complexe berekeningen, onafhankelijk van het aantal jets, de jetmorfologie en zelfs of de jet al dan niet eerder werd gevisualiseerd. Bovendien is de inter- als intra-observer-variabiliteit beduidend lager ten opzichte van TTE. Anderzijds kunnen aritmie en bewegingsartefacten soms de scankwaliteit reduceren. Daarnaast is de coronaire diastolische flow inbegrepen in de finale beoordeling van het regurgiterende volume, wat mogelijk leidt tot een lichte overschatting van PVR via CMR. Kleinschalige studies in een gering aantal patiënten toonden dat CMR de neiging heeft om PVR te reclassificeren met +1-graad, mogelijk door een onderschatting van de PVR-graad op TTE.27 Een recente multicenter-studie in 135 patiënten toonde een mogelijke link tussen de regurgiterende fractie na TAVR berekend door CMR en een gecombineerd eindpunt van mortaliteit/hartfalenhospitalisaties.28
Besluit
De evolutie van cardiale beeldvorming heeft een revolutie teweeggebracht door de pre-procedurele planning te verfijnen en steeds complexere percutane klepinterventies te begeleiden. Post-procedureel blijft TTE de eerstelijns beeldvormingsmodaliteit vanwege zijn gebruiksgemak, de ruime beschikbaarheid zonder de noodzaak tot toediening van contrast. Tegenwoordig bestaat er (vooral na TAVR) meer en meer evidentie voor het gebruik van andere geavanceerde beeldvormingsmodaliteiten zoals MDCT, CMR of zelfs nucleaire beeldvorming.
Referenties
- Vahanian, A., Beyersdorf, F., Praz, F., Milojevic, M., Baldus, S., Bauersachs, J. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2021, 43 (7), 1-72.
- Zoghbi, W.A., Asch, F.M., Bruce, C., Gillam, L.D., Grayburn, P.A., Hahn, R.T. et al. Guidelines for the Evaluation of Valvular Regurgitation After Percutaneous Valve Repair or Replacement A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, J Am Soc Echocardiogr, 2019, 32 (4), 1-45.
- Otto, C.M., Nishimura, R.A., Bonow, R., Carabello, B.A., Erwin, J.P., Gentile, F. et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease. Circulation, 2021, 143 (5), e35-e71.
- Lancellotti, P., Pibarot, P., Chambers, J., Edvardsen, T., Delgado, V., Dulgheru, R. et al. Recommendations for the imaging assessment of prosthetic heart valves: a report from the European Association of Cardiovascular Imaging endorsed by the Chinese Society of Echocardiography, the Inter-American Society of Echocardiography, and the Brazilian Department of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging, 2016, 17 (6), 589-590.
- Pibarot, P., Herrmann, H.C., Wu, C., Hahn, R.T., Otto, C.M., Abbas, A.E. et al. Standardized Definitions for Bioprosthetic Valve Dysfunction Following Aortic or Mitral Valve Replacement. J Am Coll Cardiol, 2022, 80 (5), 545-561.
- Herrmann, H.C., Pibarot, P., Wu, C., Hahn, R.T., Tang, G.H.L., Abbas, A.E. et al. Bioprosthetic Aortic Valve Hemodynamics: Definitions, Outcomes, and Evidence Gaps. J Am Coll Cardiol, 2022, 80 (5), 527-544.
- Bach, D.S. Echo/Doppler Evaluation of Hemodynamics After Aortic Valve Replacement. JACC Cardiovasc Imaging, 2010, 3 (3), 296-304.
- Hahn, R.T., Leipsic, J., Douglas, P.S., Jaber, W.A., Weissman, N.J., Pibarot, P. et al. Comprehensive Echocardiographic Assessment of Normal Transcatheter Valve Function. JACC Cardiovasc Imaging, 2019, 12 (1), 25-34.
- Généreux, P., Piazza, N., Alu, M.C., Nazif, T., Hahn, R.T., Pibarot, P. et al. Valve Academic Research Consortium 3: Updated Endpoint Definitions for Aortic Valve Clinical Research. J Am Coll Cardiol, 2021, 77 (21), 2717-2746.
- Pibarot, P., Magne, J., Leipsic, J., Côté, N., Blanke, P., Thourani, V.H. et al. Imaging for Predicting and Assessing Prosthesis-Patient Mismatch After Aortic Valve Replacement. JACC Cardiovasc Imaging, 2019, 12 (1), 149-162.
- Makkar, R.R., Fontana, G., Jilaihawi, H., Chakravarty, T., Kofoed, K.F., De Backer, O. et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engl J Med, 2015, 373 (21), 2015-2024.
- Chakravarty, T., Søndergaard, L., Friedman, J., De Backer, O., Berman, D., Kofoed, K.F. et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. The Lancet, 2017, 389 (10087), 2383-2392.
- Blanke, P., Weir-McCall, J.R., Achenbach, S., Delgado, V., Hausleiter, J., Jilaihawi, H. et al. Computed Tomography Imaging in the Context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR). JACC Cardiovasc Imaging, 2019, 12 (1), 1-24.
- Habib, G., Lancellotti, P., Antunes, M.J., Bongiorni, M.G., Casalta, J.P., Del Zotti, F. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J, 2015, 36 (44), 3075-3128.
- Del Val, D., Panagides, V., Mestres, C.A., Miró, J.M., Rodés-Cabau, J. Infective Endocarditis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2023, 81 (4), 394-412.
- Dilsizian, V., Budde, R.P.J., Chen, W., Mankad, S.V., Lindner, J.R., Nieman, K. Best Practices for Imaging Cardiac Device-Related Infections and Endocarditis. JACC Cardiovasc Imaging, 2022, 15 (5), 891-911.
- Stortecky, S., Heg, D., Tueller, D., Pilgrim, T., Muller, O., Noble, S. et al. Infective Endocarditis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2020, 75 (24), 3020-3030.
- Khalique, O.K., Veillet-Chowdhury, M., Choi, A.D., Feuchtner, G., Lopez-Mattei, J. Cardiac computed tomography in the contemporary evaluation of infective endocarditis. J Cardiovasc Comput Tomogr, 2021, 15 (4), 304-312.
- Del Val, D., Trottier, M., Alperi, A., Muntané- Carol, G., Faroux, L., Delarochellière, R. et al. 18 F-Fluorodeoxyglucose Uptake Pattern in Noninfected Transcatheter Aortic Valves. Circ Cardiovasc Imaging, 2020, 13 (11), e011749.
- Wahadat, A.R., Tanis, W., Swart, L.E., Scholtens, A., Krestin, G.P., Van Mieghem, N.M.D.A. et al. Added value of 18F-FDGPET/ CT and cardiac CTA in suspected transcatheter aortic valve endocarditis. J Nucl Cardiol, 2021, 28 (5), 2072-2082.
- Pibarot, P., Hahn, R.T., Weissman, N.J., Monaghan, M.J. Assessment of Paravalvular Regurgitation Following TAVR. JACC Cardiovasc Imaging, 2015, 8 (3), 340-360.
- Tuzcu, E.M., Kapadia, S.R., Svensson, L.G. Valve Design and Paravalvular Aortic Regurgitation: New Insights from the French Registry. Circulation, 2014, 129 (13), 1378-1380.
- Gonçalves, A., Almeria, C., Marcos-Alberca, P., Feltes, G., Hernández-Antolín, R., Rodríguez, E. et al. Three-Dimensional Echocardiography in Paravalvular Aortic Regurgitation Assessment after Transcatheter Aortic Valve Implantation. J Am Soc Echocardiogr, 2012, 25 (1), 47-55.
- Lee, J.C., Branch, K.R., Hamilton-Craig, C., Krieger, E.V. Evaluation of aortic regurgitation with cardiac magnetic resonance imaging: a systematic review. Heart, 2018, 104 (2), 103-110.
- Corrigan, F.E., Gleason, P.T., Condado, J.F., Lisko, J.C., Chen, J.H., Kamioka, N. et al. Imaging for Predicting, Detecting, and Managing Complications After Transcatheter Aortic Valve Replacement. JACC Cardiovasc Imaging, 2019, 12 (5), 904-920.
- Cavalcante, J.L., Lalude, O.O., Schoenhagen, P., Lerakis, S. Cardiovascular Magnetic Resonance Imaging for Structural and Valvular Heart Disease Interventions. JACC Cardiovasc Interv, 2016, 9 (5), 399-425.
- Hartlage, G.R., Babaliaros, V.C., Thourani, V.H., Hayek, S., Chrysohoou, C., Ghasemzadeh, N. et al. The role of cardiovascular magnetic resonance in stratifying paravalvular leak severity after transcatheter aortic valve replacement: an observational outcome study. J Cardiovasc Magn Reson, 2014, 16 (1), 93.
- Ribeiro, H.B., Orwat, S., Hayek, S.S., Larose, é., Babaliaros, V., Dahou, A. et al. Cardiovascular Magnetic Resonance to Evaluate Aortic Regurgitation After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol, 2016, 68 (6), 577-585.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.