Compte rendu du symposium de l'HFA
Cette année, le congrès annuel européen de l'ESC sur l'insuffisance cardiaque a été organisé à Prague, et a connu un franc succès. Des experts internationaux ont traité de plusieurs sujets intéressants et il y a eu beaucoup d'interactions avec les nombreux participants. Ce compte rendu résume une session consacrée aux innovations dans le domaine des cardiomyopathies. Un sujet très actuel, surtout au vu des nouvelles recommandations européennes. Les orateurs étaient James Januzzi (Boston, états-Unis), Iacopo Olivotto (Florence, Italie), Arsen Ristic (Belgrade, Serbie), Stephane Heymans (Maastricht, Pays-Bas) et Damien Logeart (Paris, France).
Nouvelles approches pour la cardiomyopathie diabétique
James Januzzi - Boston, états-Unis
Bien que cette entité constitue une nouveauté pour certains, elle n'en est pas moins importante, compte tenu de sa prévalence croissante et des progrès thérapeutiques. L'exposé s'est concentré sur 3 questions : qu'est-ce que la cardiomyopathie diabétique et quelle est sa prévalence ? Comment pose-t-on le diagnostic ? Et enfin, quels sont les traitements possibles ?
Quand on évoque le risque cardiovasculaire chez les diabétiques, on pense principalement à l'athérosclérose et auxmaladies coronariennes. Toutefois, quand on examine les études portant sur les résultats cardiovasculaires produits par les antidiabétiques, c'est l'insuffisance cardiaque qui l'emporte. Une vaste étude multinationale portant sur > 750 000 diabétiques indemnes de maladie cardiovasculaire ou rénale préalable a montré qu'après une durée médiane de suivi de 4,5 ans, environ un quart des patients avaient développé une insuffisance cardiaque (et 11 % un infarctus myocardique aigu) et que la survenue d'une insuffisance cardiaque dans cette population était indépendamment associée à un risque de mortalité accru.1 La cardiomyopathie (CMP) diabétique est une des raisons pour lesquelles l'insuffisance cardiaque est si prévalente dans cette population. L'affection peut survenir chez les diabétiques de type 1 et de type 2. L'hyperglycémie et l'insulinorésistance sont au coeur de sa physiopathologie. Elles entraînent divers changements métaboliques, e. a. une oxydation accrue des acides gras provoquant une lipotoxicité, une inflammation et une accumulation de produits finaux de glycation avancée (protéines irrémédiablement endommagées par des groupes de sucres qui y sont attachés), ce qui induit un remodelage myocardique et une modification de l'homéostasie calcique dans les cellules myocardiques.2 Il en résulte une apoptose, une fibrose et une hypertrophie myocardique. Initialement, ceci va provoquer une dysfonction diastolique due à une augmentation de la rigidité ventriculaire mais, au fil du temps, on assistera à l'apparition d'une dysfonction systolique.2 La prévalence chez les diabétiques varie selon les études, mais elle se situe entre 17 et 24 %.3-5 Les facteurs de risque connus de développement de ce tableau clinique sont l'âge, la durée du diabète, une clairance rénale réduite (< 60 ml/min) et la présence d'autres complications diabétiques micro- et macrovasculaires. En ce qui concerne le diagnostic, il est important de savoir que bon nombre de patients sont pauci- ou asymptomatiques, surtout aux premiers stades. Cependant, lors d'une épreuve d'effort, on constate souvent une diminution marquée de la capacité à l'effort et, en outre, une dysfonction est également visible à l'imagerie. On observe le plus souvent une hypertrophie ventriculaire gauche, une dilatation auriculaire gauche, une augmentation de la pression auriculaire gauche (sur la base d'un rapport E/e' accru) et une diminution de la déformation longitudinale globale. Une combinaison des paramètres échocardiographiques précédents a montré, dans le cadre d'une étude, un risque accru de développer un événement d'insuffisance cardiaque chez des diabétiques asymptomatiques ayant une fraction d'éjection normale et ne présentant pas de signes de maladie coronarienne.6 De plus, les biomarqueurs cardiaques (peptides natriurétiques et troponines) sont souvent élevés lorsqu'il n'y a pas d'autre cause d'insuffisance cardiaque (comme p. ex. une maladie coronarienne). Compte tenu de la nature endémique du diabète et de la prévalence élevée de la CMP diabétique, l'American Diabetes Association a récemment publié un document de consensus sur cette entité pathologique.7 à cet égard, les diabétiques sont classés en 3 catégories de risque (A : avec des facteurs de risque concomitants d'HF; B : avec des anomalies structurelles à l'échographie; C : avec des symptômes d'HF - figure 1). Chez les patients des classes de risque A et B, les recommandations préconisent de doser les biomarqueurs cardiaques au moins 1 fois par an et de réaliser une imagerie en cas d'élévation des biomarqueurs, afin de diagnostiquer précocement l'HFpEF/HFrEF.7
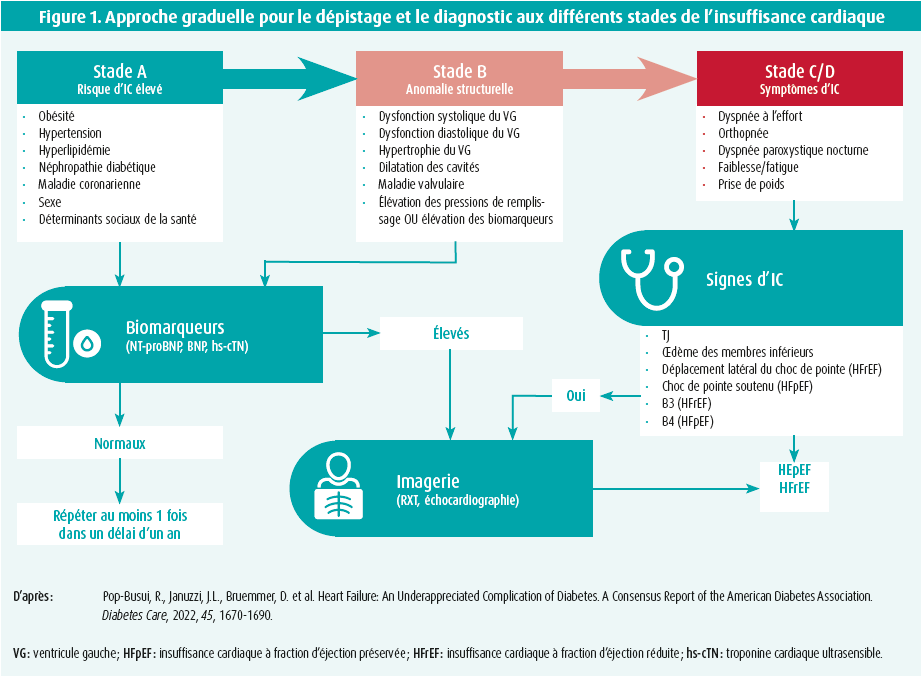
Au cours de la discussion qui a suivi les exposés, on s'est demandé si cette entité diffère substantiellement de l'HFpEF. L'orateur a répondu que la CMP diabétique est une des causes possibles de l'HFpEF dans cette population de patients, et qu'un diagnostic spécifique est important, étant donné les progrès enregistrés ces dernières années sur le plan de la thérapie ciblée. Cette approche repose globalement sur trois piliers : la prise en charge des autres facteurs de risque (comme l'obésité, l'hypertension artérielle et l'hypercholestérolémie), la poursuite d'un contrôle glycémique correct, notamment avec des inhibiteurs du SGLT2 et des agonistes du GLP (les inhibiteurs de la DPP4 et les dérivés de la thiazolidinedione sont à éviter) et, enfin, la thérapie ciblée. En ce qui concerne la thérapie ciblée pour la CMP diabétique, de nombreuses options sont en vue : thérapie génique, neuréguline-1, traitement anti-inflammatoire, mitotropes et inhibiteurs de l'aldose réductase. L'orateur s'est surtout attardé sur ces deux dernières options. Le ninerafaxstat (un mitotrope) vise à améliorer la fonction mitochondriale, ce qui réduit le déficit énergétique du myocarde (déficit en ATP), de sorte qu'on obtient également une diminution de la stéatose cardiaque (et donc de la lipotoxicité) et une amélioration de la fonction diastolique. Tout ceci a été confirmé par les résultats d'une récente étude de phase 2A (étude IMPROVE-DiCE).8 Les inhibiteurs de l'aldose réductase avaient déjà été développés pour lutter contre les complications microvasculaires du diabète. Leur action repose sur l'inhibition de la voie des polyols. En effet, chez les patients souffrant d'hyperglycémie, cette voie entraîne la conversion du glucose intracellulaire en fructose et en sorbitol, ce qui consomme les antioxydants naturels (p. ex. le glutathion) et rend la cellule vulnérable au stress oxydatif.9 Cependant, la première génération de ces médicaments provoquait de nombreuses complications off-target, et ces produits ont été retirés du marché. Actuellement, on étudie de nouvelles molécules - notamment 'AT-001' - qui sont plus puissantes et entraînent moins de complications. Dans une étude à petite échelle, on a constaté qu'AT-001 induisait des concentrations de sorbitol nettement plus faibles ainsi qu'une diminution du NT-proBNP.10 Entre-temps, une étude randomisée contrôlée par placebo (ARISE-HF) est en cours pour évaluer la sécurité et l'efficacité de cette molécule dans une population de patients souffrant de CMP diabétique. Les premiers résultats sont attendus l'an prochain.
Cardiomyopathie hypertrophique : traitement médicamenteux ou intervention
Iacopo Olivotto - Florence, Italie
L'orateur a commencé son exposé par une brève énumération des recommandations actuelles concernant le traitement de la cardiomyopathie hypertrophique obstructive : médicaments (bêtabloquants, vérapamil, disopyramide) et options invasives (myomectomie chirurgicale et alcoolisation du septum). Tous ces traitements sont puissants et leur effet sur la symptomatologie est prouvé, mais ils comportent également des limitations. Ainsi, il ne s'agit pas d'une panacée pour tous les patients dans toutes les situations, et les options invasives impliquent toujours des risques (p. ex., la mise en place d'un pacemaker est nécessaire dans 5-7 % des cas, principalement après une alcoolisation du septum), les résultats dépendent fortement de l'opérateur et une réintervention est souvent nécessaire (principalement en cas d'ablation du septum). En outre, on ne modifie pas la physiopathologie sous-jacente, et donc la progression de la maladie. Pour y remédier, le concept de modulation de la myosine par de petites molécules ciblées a émergé ces dernières années. Celles-ci sont administrées par voie orale et se lient de manière très sélective à la myosine cardiaque, avec une normalisation de la contractilité, une meilleure compliance, une diminution de l'hypertrophie, de la fibrose et de la consommation d'énergie dans des modèles murins. Chez l'homme, les données sont plus limitées. L'étude EXPLORER-HCM, une étude de phase 3, randomisée, en double aveugle et contrôlée par placebo, a déjà montré qu'un traitement par mavacamten entraînait une amélioration de la capacité à l'effort, une diminution de l'obstruction de la chambre de chasse du ventricule gauche (LVOT) et une amélioration de la classe NYHA chez les patients souffrant d'une cardiomyopathie hypertrophique obstructive.11 Une étude similaire de phase 3 (SEQUOIA-HCM) est en cours avec une molécule différente, l'aficamten, et les résultats sont attendus sous peu. On ne dispose pas encore de données à long terme.
Lors de la suite de son exposé, l'orateur a précisé la place de ce nouveau traitement dans le paysage de la cardiomyopathie hypertrophique, en le situant entre le traitement médical de première ligne (bêtabloquants, vérapamil, disopyramide) et les procédures interventionnelles. Il reste à savoir si ce traitement médicamenteux additionnel permettra de réduire considérablement la nécessité d'une intervention invasive à l'avenir. Une étude a déjà été conduite à ce sujet.12 Dans cette ECR, 112 patients souffrant d'une cardiomyopathie hypertrophique obstructive avec un gradient LVOT > 50 mmHg et entrant en ligne de compte pour un traitement de réduction septale ont été randomisés vers un traitement par mavacamten ou un placebo et ont été suivis pendant 16 semaines. Le critère d'évaluation primaire était la proportion de patients qui, malgré le traitement médicamenteux, entraient toujours en ligne de compte pour la réduction septale ou avaient été réorientés pour ce traitement. On a constaté que c'était le cas chez 76,8 % des patients traités par placebo contre 17,9 % des patients ayant reçu du mavacamten. Les critères d'évaluation secondaires (classe NYHA, gradient LVOT, qualité de vie et biomarqueurs cardiaques) plaidaient également en faveur du mavacamten.12 Ici aussi, on ne connaît pas encore les effets à long terme. L'orateur a également noté qu'après la publication de ces résultats, plusieurs éditoriaux sont parus, lesquels ont débattu de l'importance résiduelle de la chirurgie. Il a conclu que l'intervention chirurgicale doit rester possible dans cette population de patients, mais qu'une majorité de patients pourront éviter la chirurgie grâce au traitement médical. Cependant, de plus amples données sont encore nécessaires, y compris des données à long terme, pour consolider davantage la place des inhibiteurs oraux de la myosine dans le traitement de la CMH et pour évaluer leur rapport coût-efficacité comparativement aux autres options thérapeutiques.
Le rôle de la biopsie
Arsen Ristic - Belgrade, Serbie
La session suivante a consisté en un bref exposé portant sur le rôle de la biopsie endomyocardique chez les personnes souffrant d'une cardiomyopathie. Lors de cet exposé, on a essentiellement fait référence à un document de consensus concernant l'utilisation de la biopsie endomyocardique, rédigé par les organisations européenne, américaine et japonaise de lutte contre l'insuffisance cardiaque.13 L'orateur a souligné que la réalisation d'une biopsie a certainement sa place dans le diagnostic de la cardiomyopathie, étant donné que diverses découvertes pathognomoniques sont possibles : myocardite, affection néoplasique, syndrome de Loeffler, accumulation de fer, amyloïde, etc. Cependant, il faut savoir que le rendement diagnostique dépend fortement de l'opérateur, qu'il s'agisse du cardiologue (interventionnel) ou du pathologiste qui examine l'échantillon. Il faut également être bien conscient des contre-indications absolues à la réalisation de la procédure, et connaître et pouvoir traiter les complications potentielles. L'orateur a dès lors plaidé pour la centralisation de cette procédure dans des centres expérimentés, tant pour l'exécution de la procédure que pour l'examen pathologique de l'échantillon. De cette manière, l'orateur estime qu'il s'agit d'une procédure à faible risque qui, dans de nombreux cas, apporte une plus-value diagnostique qui ne peut être égalée par l'imagerie, comme la résonance magnétique nucléaire (RMN).
Le rôle de la génétique
Stephane Heymans - Maastricht, Pays-Bas
Souvent, les patients sont adressés au service de Génétique en raison d'une insuffisance cardiaque inexpliquée et/ou d'une mort subite réanimée avec, à l'imagerie, des signes de cardiomyopathie hypertrophique, dilatée ou arythmogène. Le service de Génétique procède alors à un bilan complet, avec intégration de l'anamnèse, de la clinique et de l'imagerie, sans oublier les tests génétiques. Sur ce dernier plan, un premier variant génétique pathogène a été découvert dans le gène de la chaîne lourde de la myosine14 en 1990, mais les possibilités se sont depuis lors considérablement élargies, notamment grâce au séquençage pangénomique, qui permet d'analyser l'ensemble du génome en un seul test. Cependant, il est important de savoir que la présence d'un variant génétique est insuffisante pour poser un diagnostic. En effet, la présence d'un génotype pathogène ne donnera pas toujours le même phénotype. Par contre, elle détermine la susceptibilité d'un individu à développer un phénotype, mais l'âge, l'épigénétique et des facteurs environnementaux (p. ex. virus, auto-immunité, chimio, alcool, comorbidités, etc.) jouent également un rôle important (interaction gène-environnement). Ainsi, on sait qu'une exposition supplémentaire à des facteurs environnementaux détermine largement le phénotype final et le pronostic des patients souffrant d'une cardiomyopathie dilatée (CMD).15 Par conséquent, un programme pluridisciplinaire de cardiomyopathie combinant les caractéristiques cliniques, biochimiques, pathologiques, immunologiques, radiologiques et génétiques est nécessaire.
Ensuite, on a traité plus en détail des variants monogénétiques. Jusqu'à 70 % des patients souffrant d'une cardiomyopathie hypertrophique (CMH) présentent un tel variant, le plus souvent dans les gènes du sarcomère (tels que MYH7, MYBPC3, TNNT2 et TNNI3). Dans la CMD, il existe une prédisposition génétique chez environ 35 % des patients ayant des antécédents familiaux positifs et environ 15 % des patients n'ayant pas d'antécédents familiaux, 7 gènes étant responsables de 95 % des cas. Dans la CMP arythmogène, ce sont principalement des variants dans les gènes qui codent pour les protéines desmosomales qui sont responsables et on observe un variant pathogène dans près de 70 % des cas. Dans l'ensemble, il convient toutefois de noter que les différents phénotypes de cardiomyopathie (CMH, CMD et CMP arythmogène) présentent souvent un chevauchement au niveau des variations génétiques sousjacentes.
L'accent a également été mis sur la titine, la plus grande protéine humaine. Les variants dits 'tronqués' (TTNtv) de la bande A de cette protéine sont responsables d'un tiers de tous les cas de CMD avec prédisposition génétique. Aujourd'hui, on sait également que ces variants sont plus prévalents chez les patients souffrant d'une cardiomyopathie 'acquise' (p. ex. CMD alcoolique, CMD péripartum, CMD induite par la chimiothérapie et même en cas de myocardite aiguë). Ceci suggère une deuxième hypothèse, selon laquelle les patients présentant un variant sont plus susceptibles de développer un tableau clinique (comme une CMP chimio-induite) après avoir été exposés à un agent causal. Ainsi, la présence d'un TTNtv revêt une importance clinique croissante.
How to put the pieces of the puzzle together
Damien Logeart - Paris, France
Pour terminer, Damien Logeart a résumé les informations précédentes et a discuté d'une approche graduelle en vue d'une prise en charge intégrée des patients souffrant d'une cardiomyopathie, en resoulignant l'importance d'une anamnèse personnelle et familiale détaillée et de l'exclusion des phénocopies, étant donné que des traitements spécifiques sont disponibles pour ces groupes. Ainsi, il a rappelé qu'il est notamment important d'exclure e. a. une amyloïdose, une maladie de Fabry, une sténose aortique, une CMP hypertensive et un coeur d'athlète, en cas de suspicion de CMH. Par ailleurs, en cas de CMD, il faut exclure une hypertension sévère et une cardiopathie valvulaire ou ischémique, ainsi que d'autres causes telles qu'une toxicité, une carence en nutriments, une tachycardie, etc.
Références
- Birkeland, K.I., Bodegard, J., Eriksson, J.W. et al. Heart failure and chronic kidney disease manifestation and mortality risk associations in type 2 diabetes: A large multinational cohort study. Diabetes Obes Metab, 2020, 22 (9), 1607-1618.
- Jia, G., Hill, M.A., Sowers, J.R. Diabetic Cardiomyopathy: An Update of Mechanisms Contributing to This Clinical Entity. Circ Res, 2018, 122 (4), 624-638.
- Segar, M.W., Khan, M.S., Patel, K.V. et al. Prevalence and Prognostic Implications of Diabetes With Cardiomyopathy in Community-Dwelling Adults. J Am Coll Cardiol, 2021, 78 (16), 1587-1598.
- Pham, I., Cosson, E., Nguyen, M.T. et al. Evidence for a Specific Diabetic Cardiomyopathy: An Observational Retrospective Echocardiographic Study in 656 Asymptomatic Type 2 Diabetic Patients. Int J Endocrinol, 2015, 2015, 743503.
- Dandamudi, S., Slusser, J., Mahoney, D.W. et al. The prevalence of diabetic cardiomyopathy: a population-based study in Olmsted County, Minnesota. J Card Fail, 2014, 20 (5), 304-309.
- Wang, Y., Yang, H., Huynh, Q. et al. Diagnosis of Nonischemic Stage B Heart Failure in Type 2 Diabetes Mellitus: Optimal Parameters for Prediction of Heart Failure. JACC Cardiovasc Imaging, 2018, 11 (10), 1390-1400.
- Pop-Busui, R., Januzzi, J.L., Bruemmer, D. et al. Heart Failure: An Underappreciated Complication of Diabetes. A Consensus Report of the American Diabetes Association. Diabetes Care, 2022, 45 (7), 1670-1690.
- Hundertmark, M., Siu, A.G., Matthews, V. et al. A phase 2a trial investigating ninerafaxstat - a novel cardiac mitotrope for the treatment of diabetic cardiomyopathy (IMPROVE-DiCE). Eur Heart J, 43, Epub ahead of print 2022. DOI: 10.1093/eurheartj/ ehac544.246.
- Brownlee, M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes, 2005, 54 (6), 1615-1625.
- Perfetti, R., Shendelman, S. Abstract 13475: Clinical Assessment of AT-001, an Aldose Reductase Inhibitor in Development for Diabetic Cardiomyopathy: A 28-Day Proof of Concept Study. Circulation, 2019, 140, A13475-A13475.
- Olivotto, I., Oreziak, A., Barriales-Villa, R. et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebocontrolled, phase 3 trial. The Lancet, 2020, 396 (10253), 759-769.
- Desai, M.Y., Owens, A., Geske, J.B. et al. Myosin Inhibition in Patients With Obstructive Hypertrophic Cardiomyopathy Referred for Septal Reduction Therapy. J Am Coll Cardiol, 2022, 80 (2), 95-108.
- Seferović, P.M., Tsutsui, H., McNamara, D.M. et al. Heart Failure Association of the ESC, Heart Failure Society of America and Japanese Heart Failure Society Position statement on endomyocardial biopsy. Eur J Heart Fail, 2021, 23 (6), 854-871.
- Geisterfer-Lowrance, A.A., Kass, S., Tanigawa, G. et al. A molecular basis for familial hypertrophic cardiomyopathy: a beta cardiac myosin heavy chain gene missense mutation. Cell, 1990, 62 (5), 999-1006.
- Hazebroek, M.R., Moors, S., Dennert, R. et al. Prognostic Relevance of Gene-Environment Interactions in Patients With Dilated Cardiomyopathy: Applying the MOGE(S) Classification. J Am Coll Cardiol, 2015, 66 (12), 1313-1323.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.