Compte rendu du congrès de l'ESC
Cette session traite des nouveautés dans le domaine des dispositifs cardiaques.
Modern transvenous implantable cardioverter defibrillator (ICD) and cardiac resynchronization therapies (CRT): what is new?
Carsten Israel - Bielefeld, Allemagne
Nouvelle sonde de DAI Une nouvelle sonde a été
Une nouvelle sonde a été développée sur la base de la sonde 3830, qui est utilisée pour la stimulation du système de conduction. Cette sonde n'a qu'un diamètre de 4,7 French, ce qui devrait éviter la survenue d'un subclavian crush syndrome. La sécurité et la durabilité de cette nouvelle sonde sont en cours d'évaluation dans l'étude LEADR.1
étude AdaptResponse
L'étude AdaptResponse est un essai de grande envergure (avec > 3 600 patients) dont l'objectif est de comparer l'algorithme AdaptivCRT® à la stimulation TRC conventionnelle chez des patients présentant une insuffisance cardiaque (IC) sous traitement médicamenteux optimal, une conduction auriculo-ventriculaire intacte et un bloc de branche gauche (BBG). Avec cet logaritme, la stimulation apicale ventriculaire droite (VD) est limitée et la stimulation ventriculaire gauche (VG) sera fusionnée avec la conduction intrinsèque via la branche droite pour obtenir une resynchronisation.2 à première vue, il semble s'agir d'une étude négative, étant donné que l'utilisation de l'algorithme AdaptivCRT® n'a pas produit de réduction statistiquement significative au niveau du critère d'évaluation combiné primaire (mortalité et intervention pour décompensation cardiaque), mais l'étude a été arrêtée prématurément et 43 critères d'évaluation primaires ont encore été signalés par la suite. Si ces derniers avaient été rapportés plus tôt, l'étude n'aurait pas été arrêtée prématurément et les actuels résultats à la limite de la significativité (p = 0,07) seraient peut-être devenus significatifs. Par ailleurs, la réduction du critère d'évaluation primaire devient aussi statistiquement significative (p = 0,0037) si on limite l'analyse aux patients ayant un pourcentage de stimulation ≥ 85 %. Enfin, la durée de vie de la batterie semble s'allonger en limitant la stimulation VD.
Mais, au fait, a-t-on encore besoin de DAI ?
Aujourd'hui, les patients IC sont très bien traités par les 'quatres fantastiques' (inhibiteur de l'ECA/inhibiteur du récepteur de l'angiotensine-néprilysine, bêtabloquant, antagoniste du récepteur minéralocorticoïde et inhibiteur de SGLT2) et la revascularisation. La mortalité baisse de 61 % sous cette quadrithérapie.3 La mort subite cardiaque (MSC) dans la population IC semble, elle aussi, s'en trouver améliorée, affichant une diminution de 1,2 % par décennie.4 La question se pose dès lors de savoir si, à l'avenir, nous aurons encore besoin de DAI en prévention primaire. Cependant, ce constat semble reposer essentiellement sur deux études : l'étude RALES5, qui n'a inclus que des patients présentant une IC de classe NYHA 3-4, et l'étude PARADIGM6, menée des années plus tard parmi une majorité de patients présentant une IC de classe NYHA 2, qui a forcément donné un taux de mortalité différent. Cette dernière étude démontre aussi que les patients IC traités par énalapril ou sacubitril couraient un plus grand risque de MSC après trois ans (8-10 %) que de décès par IC terminale (4-6 %).6 De plus, lorsque les patients ayant une indication de classe 1 pour un DAI ne recevaient qu'un traitement pour l'IC, leur risque de MSC s'élevait à 3,11 %, et pouvait être ramené à ± 1 % avec un DAI.7 Le risque accru de MCS persiste donc, y compris sous un très bon traitement de l'IC. Mieux encore : mieux vous traitez l'IC, plus le risque relatif de MSC est élevé, qu'elle soit de nature ischémique ou non. En effet, le risque de mort subite est cumulatif : les traitements actuels de l'IC allongent la survie, mais chaque jour supplémentaire sous IC grave augmente le risque de MSC si bien qu'au final, un DAI aurait pu protéger le patient pendant un plus grand nombre de jours. Dans l'étude RALES,5 la MSC représentait 29 % de tous les décès, alors que ce pourcentage avait grimpé à 39 % dans l'étude PARADIGM-HF.6 C'est la théorie de la conversion : on convertit une mort cardiaque non subite en mort subite dans une étude récente, l'étude DAPA-HF8, le taux de mortalité par MSC est de 2,7 % dans le groupe d'intervention (traité par dapagliflozine). Les esprits chagrins diront encore que cela signifie que, chaque année, 97,3 % des patients reçoivent un DAI pour rien, avec le risque de développer une endocardite. D'autre part, les recommandations indiquent qu'un risque annuel de MCS de ≥ 0,8 % est considéré comme modéré et qu'un risque annuel de ≥ 1,2 % est considéré comme élevé (données extraites des recommandations sur la cardiomyopathie hypertrophique9), alors que le risque de décéder d'une endocardite (ou de l'extraction de DAI qui s'ensuit) n'est que de ≤ 0,1 %.
Un dernier mythe à déconstruire est que les DAI ne sont pas nécessaires en cas de cardiomyopathie non ischémique. Cette idée fausse repose sur les résultats de l'étude DANISH10, dans laquelle le risque de MSC était très faible et n'était pas différent entre les patients ayant reçu un DAI et ceux du groupe témoin. Le problème de cette étude est toutefois que les patients étaient déjà sous traitement médicamenteux optimal à l'inclusion, mais que la majorité d'entre eux avaient aussi une indication de TRC, qu'ils n'ont reçue qu'au cours de l'étude, ce qui peut avoir influencé les résultats.
Extravascular-ICD (EV-ICD) implantation procedure: step-by-step
Nicolas Clémenty - Montpellier, France
Cette présentation s'est attachée à expliquer, étape par étape, la procédure d'implantation d'un DAI-EV (figure 1). La première étape, qui est très importante, est d'indiquer les points de repère anatomiques (figure 1). Pour vous y aider, vous devez préalablement faire réaliser une radio thoracique (RX) en position antéro-postérieure (AP) et latérale.
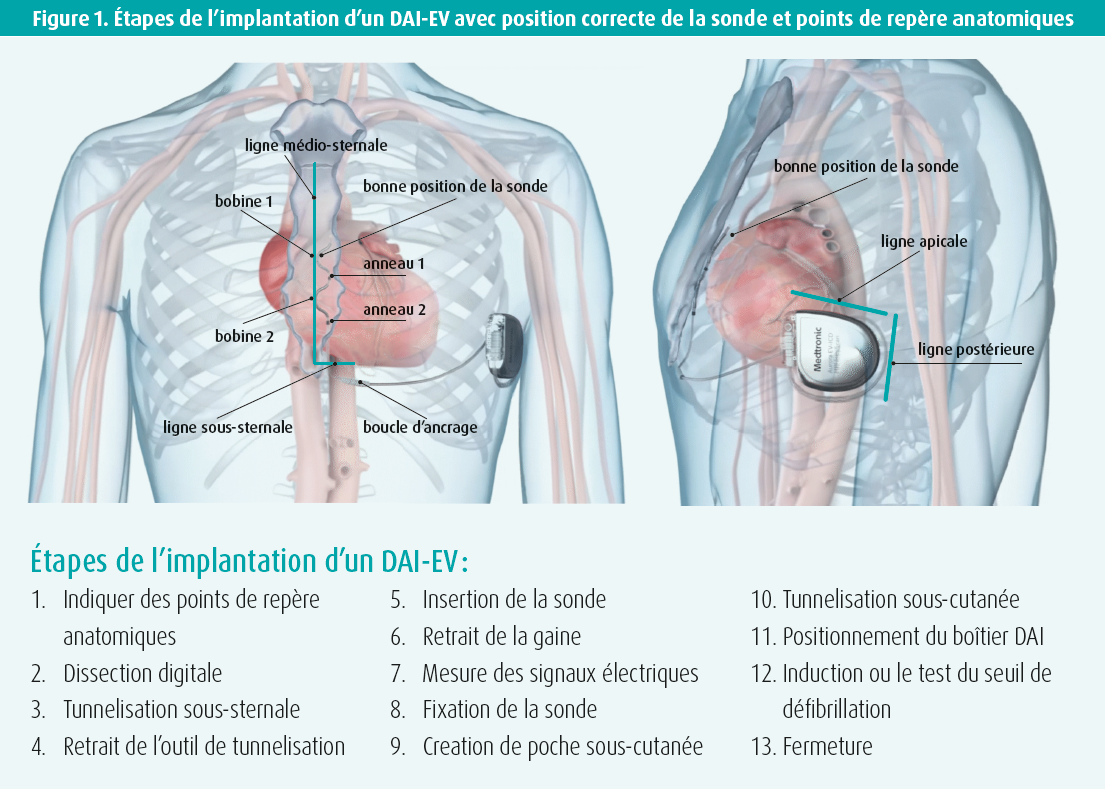
Les points de repère sont les suivants :
- ligne médio-sternale ;
- ligne d'incision sous-sternale, assez similaire au DAI sous-cutané (DAI-SC) ;
- ligne apicale (au niveau de l'apex du coeur, à visualiser sur la RX AP), sous laquelle le DAI sera positionné ;
- ligne postérieure (à visualiser sur la RX latérale), qui indique le bord latéral du DAI et qui se situe en position légèrement antérieure par rapport au DAI-SC.
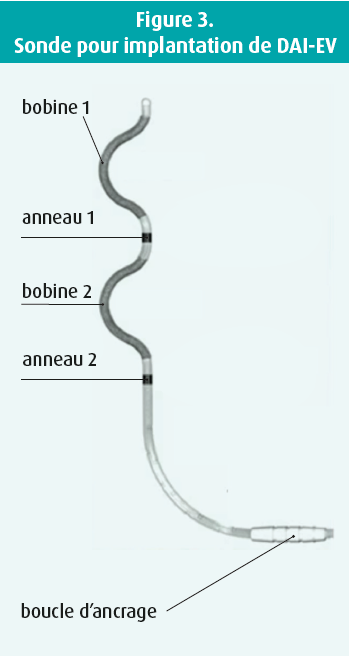
Via la ligne d'incision sous-sternale, vous pénétrez l'espace sous-sternal du doigt en direction du processus xiphoïde et vous y brisez les adhérences par dissection mousse. Il est très important de le faire avec le doigt, il n'y a pas besoin d'instruments. Pour la tunnelisation, par contre, vous avez besoin d'un instrument : l'outil de tunnelisation sternale (figure 2). Cet instrument contient une tige métallique sur laquelle se trouvent la gaine ainsi qu'un guide visuel qui reste à la surface de la peau, indiquant ainsi la position et l'orientation de la tige pendant la tunnelisation. Vous introduisez cette tige par l'espace que vous avez libéré du doigt. Puis vous vérifiez l'orientation de la tige en position AP. Ensuite, vous passez en vue latérale et vous continuez à avancer la tige juste sous le sternum, contre lequel vous pouvez parfois buter. à chaque centimètre de progression, vous devez repasser en vue AP pour contrôler la position de la tige. Vous alternez donc constamment entre les vues AP et latérale pendant la tunnelisation. Une fois la bonne position atteinte (± 1 cm sous l'éperon), vous retirez la tige afin que la gaine seule reste en place. Vous pouvez insérer la sonde selon la bonne orientation à travers la gaine. La sonde a une forme spéciale : en epsilon avec deux bobines, qui doivent être placées du côté droit du patient, et deux anneaux avec des électrodes, qui doivent se situer du côté gauche (figure 3). Vous pouvez ensuite retirer la gaine et vérifier la bonne position de la sonde par RX. Ensuite, les signaux électriques doivent être mesurés, notamment l'onde R, en s'assurant qu'il n'y a pas d'onde P. Ces signaux ressemblent plus aux signaux observés avec le DAI conventionnel qu'avec le DAI-SC. Vous devez par ailleurs mesurer le seuil de stimulation. Une fois que les mesures électriques sont également correctes, vous pouvez fixer la sonde en suturant la boucle d'ancrage.
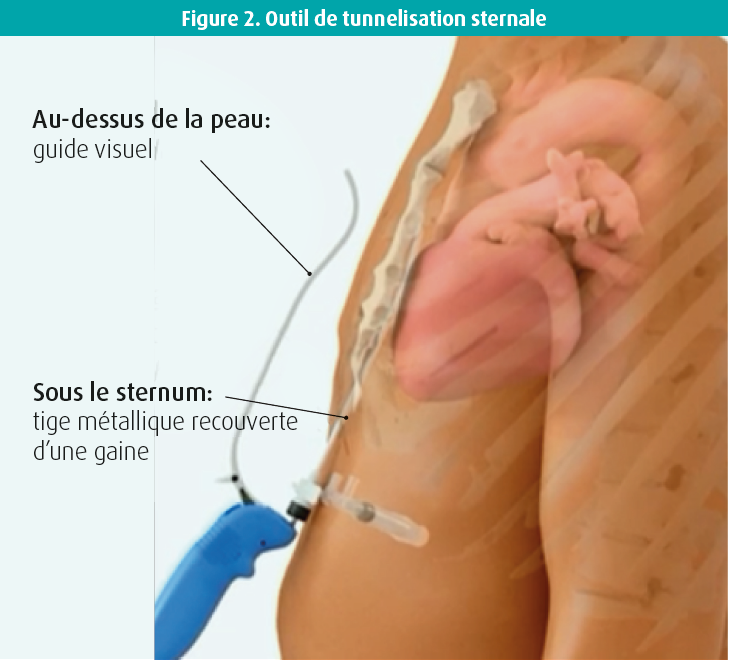
Vous préparez ensuite la poche axillaire, délimitée par la ligne apicale et la ligne postérieure. Puis vous devez à nouveau tunneliser mais, cette fois, avec un autre instrument avec lequel vous pouvez coincer la sonde. Pour ce faire, vous partez du site d'insertion de la sonde, en position sous-xiphoïdienne, et vous faites un tunnel en direction axillaire. Là, vous attachez la sonde et vous retirez à nouveau l'outil de tunnelisation. La sonde est ensuite connectée au DAI et le boîtier DAI est placé et fixé dans la poche. Après cela, la position de la sonde est à nouveau vérifiée et vous contrôlez le vecteur de choc sur le ventricule gauche en vue AP. Vient ensuite le test du seuil de défibrillation, où on induit une fibrillation ventriculaire (FV) pour voir si cette FV est, d'une part, bien détectée par le dispositif et, d'autre part, terminée efficacement par le choc. Après quoi vous pouvez refermer.
Avec un peu d'entraînement et d'expérience, il devrait être possible de boucler la procédure en 35 à 40 minutes. étant donné que cette zone sous-sternale est nouvelle pour la plupart des électrophysiologistes, il est obligatoire d'avoir un chirurgien cardiaque à bord pendant les trois à cinq premières interventions. Par la suite, vous devriez vous sentir suffisamment familiarisé, en tant que cardiologue, avec cette procédure relativement simple de l'avis de l'orateur. Il est toutefois important que cette procédure soit pratiquée régulièrement.
Dans l'étude Extravascular ICD Pivotal Study,11 tous les patients étaient soumis à un CT-scan avant la procédure afin d'obtenir une image détaillée de leur anatomie. Entre la ligne médio-sternale et les artères mammaires, vous avez un centimètre de marge des deux côtés, ce qui devrait permettre d'éviter toute lésion dans ces artères. Cette procédure est actuellement contre-indiquée après une sternotomie, car on ne dispose encore d'aucune donnée pour ce groupe de patients. Si un patient a besoin d'une sternotomie après l'implantation d'un DAI extravasculaire, le dispositif devra vraisemblablement être retiré. Mais, là non plus, il n'y a encore aucune expérience en la matière.
Extravascular ICD therapy: latest developments and clinical results
Lucas Boersma - Nieuwegein, Pays-Bas
La sonde est et reste le talon d'Achille du DAI transveineux. Bien que les sondes soient devenues presque incassables, elles doivent être placées dans les vaisseaux sanguins où elles peuvent s'accompagner de complications (p. ex. infection). De même, l'extraction de la sonde d'un vaisseau sanguin n'est pas sans danger. C'est ainsi qu'est né le DAI-SC, dont la sonde est placée en position extravasculaire. Mais ces dispositifs ont aussi leurs limites :
- Stimulation post-choc de courte durée ;
- Aucune possibilité de stimulation antitachycardique (SAT) ;
- Seuil de défibrillation élevé, qui nécessite donc un grand boîtier, ce qui entraîne un certain inconfort pour le patient ;
- Durée de vie limitée de la batterie.
L'idée d'un DAI-EV a germé dans l'optique de surmonter ces limites, la sonde étant placée sous le sternum plutôt que sous la peau en parallèle au sternum. L'énergie nécessaire pour défibriller est moindre (40 J par défaut), moyennant un boîtier plus petit et une batterie à la longévité augmentée (± 12 ans). Ce système permet non seulement la stimulation postchoc, mais aussi la SAT et la prévention des pauses.
Le DAI-EV sera bientôt disponible pour un lancement commercial. Pour l'heure, les résultats sont d'ores et déjà prometteurs :
- L'efficacité de la défibrillation à l'implantation est de 99 %, et ce, avec 30 J voire moins. Dans la moitié des cas, la défibrillation était déjà efficace à 15 J.11 Cela signifie qu'il reste une réserve d'au moins 10 J dans l'appareil.
- La fonctionnalité de SAT a permis d'éviter des chocs dans près de la moitié des épisodes. Qui plus est, la SAT est généralement bien supportée par les patients, 3,6 % d'entre eux seulement ayant fait désactiver la SAT en raison d'une sensation gênante sous la peau.12
- Un déclenchement de chocs inopportuns était initialement présent chez 11,5 % des patients, ce qui est relativement beaucoup, mais il semble heureusement diminuer au fil de l'expérience acquise en matière d'implantation et de programmation des dispositifs. Le plus souvent, ces chocs inopportuns étaient la conséquence d'une surdétection cardiaque, et plus particulièrement d'une surdétection de l'onde P. Ce problème a depuis lors été résolu par l'algorithme de surdétection de l'onde P (PWOS), qui intègre la morphologie des ondes.13 L'appareil peut examiner les amplitudes et sait que, en cas d'amplitudes alternées (ondes R élevées et ondes P faibles), il ne s'agit pas de TV/FV et que, dès lors, il ne doit pas déclencher. Cet algorithme PWOS a réduit de 42 % les épisodes de surdétection sans effet sur la détection des arythmies auriculaires, TV ou FV.13
- Les complications majeures liées à la procédure ou au système (après 18 mois) étaient peu fréquentes, d'un ordre plus ou moins similaire à celles associées au DAI-SC. Après six mois, on notait quelques ruptures dans les sondes, toutes au même endroit (juste avant la première électrode). Cette faiblesse a déjà été corrigée au niveau de la fabrication et les nouvelles sondes sont plus solides. Il y a par ailleurs eu des infections, ce qui peut arriver avec n'importe quel dispositif, mais les DAIEV ont l'avantage que les sondes et le boîtier peuvent être retirés sans risque d'endommager les vaisseaux sanguins.
Conduction system pacing (CSP): why and how?
Harran Burri - Genève, Suisse
La quête d'un pacing plus physiologique a abouti, ces dernières années, au développement de la stimulation du système de conduction (SSC) en Europe occidentale. La SSC existe sous deux formes (tableau 1). Et les deux techniques sont de plus en plus souvent utilisées.14 On s'attend même à une future domination de la SSC sur la stimulation (ventriculaire droite ou biventriculaire) conventionnelle. Le rôle de la stimulation du faisceau de His (SFH) n'est pas encore totalement élucidé, mais la stimulation de la branche gauche (SBG) semble en pleine progression.

Quelles sont les indications de SSC à l'heure actuelle ?
SSC plutôt que stimulation ventriculaire droite (SVD)
Par le passé, des études ont démontré que 1 patient sur 5 développera une cardiomyopathie induite par la stimulation après cinq ans en cas de pourcentage de stimulation VD > 20 %.16 Des études observationnelles non randomisées révèlent que la SBH17 ou la SBG18 est associée à de meilleurs résultats cliniques (mortalité, hospitalisations pour IC ou upgrade vers une stimulation biventriculaire) que la SVD mais, encore une fois, uniquement en cas de stimulation ventriculaire > 20 %.
SSC plutôt que stimulation biventriculaire (SBiV)
Contrairement à ce qu'on croit souvent, un BBG n'est pas toujours une affection diffuse qui touche également le système de conduction périphérique, mais le bloc se situe généralement (dans > 50 % des cas) en position très proximale dans le faisceau de His même. Et il en va parfois de même pour un bloc de branche droit. Si la sonde peut être placée en position distale du bloc, dans le faisceau de His ou dans la région de la branche gauche, nous pouvons déjà y recruter les fibres de conduction et obtenir un complexe QRS étroit. à ce jour, sept RCT (certes d'envergure relativement petite) ont été publiées, toutes démontrant que la SSC est au moins aussi efficace que la SBiV et qu'elle donne même, selon certaines études, de meilleurs résultats cliniques. Les recommandations européennes de 2021 pour la stimulation cardiaque et la thérapie de resynchronisation20 ne reprennent toutefois pas encore la SBG, car les preuves étaient encore insuffisantes à l'époque. C'est la raison pour laquelle les recommandations américaines19 ont été actualisées il y a quelques mois : chez les patients présentant une fraction d'éjection réduite qui ont une indication de stimulation, la SSC bénéficie désormais d'une recommandation similaire (classe 2a, niveau B) à la stimulation biventriculaire. Actuellement, il n'existe encore nulle part (ni dans les recommandations européennes, ni dans les américaines) d'indication de première intention pour la SSC plutôt que pour la SBiV, simplement parce que les preuves concernant la SBiV sont beaucoup plus nombreuses. En revanche, la SBG est une solution recommandée dans les recommandations européennes en cas d'échec de la SBiV.20
Bien que les preuves en faveur de la SSC soient prometteuses et croissantes, quelques points doivent encore être optimisés.
- Pour le moment, le principal problème de la SBH reste le nombre de révisions de sonde et les seuils élevés. On essaie de standardiser de plus en plus la technique d'implantation d'une SSC21 dans l'espoir d'améliorer le pourcentage de réussite et la sécurité.
- Aucune sonde n'a encore été conçue pour la SBG. La sonde 3830 a déjà affiché de bons résultats, mais le temps devra faire la clarté sur la manière dont ces sondes vont s'en tirer dans le septum.
- D'aucuns présument aussi que l'extraction de sonde peut être difficile en cas de SBG, surtout après quelques années, étant donné que ces sondes sont implantées profondément dans le septum et que l'anneau métallique forme des adhérences avec le myocarde. Nous avons besoin d'instruments pour assister cette extraction.
- Comme il reste parfois compliqué de reconnaître une capture de SSC, l'intelligence artificielle pourrait apporter une aide précieuse.
Messages-clés
Dispositifs transveineux
- Une nouvelle sonde a été développée, d'un diamètre d'à peine 4,7 French, qui devrait éviter la survenue d'un subclavian crush syndrome.
- Chez les patients présentant une insuffisance cardiaque sous traitement médicamenteux optimal, une conduction auriculo-ventriculaire intacte et un BBG, la TRC adaptative n'entraîne pas de réduction statistiquement significative du critère d'évaluation primaire combiné par rapport à la TRC conventionnelle, même si la valeur p était à la limite de la significativité (p = 0,07) et que l'étude ait été interrompue prématurément.
- La MSC reste un problème dans la population IC, peut-être même encore plus que jamais à cause des 'quatres fantastiques' : le risque relatif et cumulé de mort subite cardiaque augmente au fur et à mesure de l'allongement de la survie du patient atteint d'une IC grave. Dans l'IC, le traitement médicamenteux optimal et le DAI sont donc complémentaires, plutôt que concurrents.
DAI extravasculaire (DAI-EV)
- Une thérapie par DAI-EV offre des solutions aux défauts des DAI sous-cutanés : la possibilité de stimulation antitachycardique (SAT) et de prévention des pauses en plus de la stimulation post-choc, une défibrillation à moindre consommation d'énergie, avec un boîtier plus petit et une batterie qui dure plus longtemps.
- Le DAI-EV a traité efficacement les épisodes de TV/FV pendant un suivi moyen de 18 mois.
- La fonctionnalité de SAT a permis d'éviter des chocs dans près de la moitié des épisodes.
- Le nombre de chocs inopportuns va diminuer grâce au nouvel algorithme de surdétection de l'onde P (PWOS).
- Les complications majeures liées à la procédure ou au système (après 18 mois) étaient peu fréquentes.
- La procédure d'implantation d'un DAIEV est relativement simple à apprendre et est expliquée étape par étape.
- Un DAI-EV est contre-indiqué après une sternotomie, car on ne dispose encore d'aucune donnée pour ce groupe de patients.
Stimulation du système de conduction (SSC)
- Il existe deux formes de SSC : la stimulation du faisceau de His et la stimulation de la branche gauche.
- Les résultats cliniques de la SSC, qui offre une stimulation plus physiologique, sont prometteurs par rapport aux modalités conventionnelles de stimulation.
Références
- Crossley, G.H., Sanders, P., De Filippo, P., Tarakji, K.G., Hansky, B., Shah, M. et al. Rationale and design of the Lead Evaluation for Defibrillation and Reliability study: Safety and efficacy of a novel ICD lead design. J Cardiovasc Electrophysiol, 2023, 34 (2), 257-267.
- Wilkoff, B.L., Filippatos, G., Leclercq, C., Gold, M.R., Hersi, A.S., Kusano, K. et al. Adaptive versus conventional cardiac resynchronisation therapy in patients with heart failure (AdaptResponse): a global, prospective, randomised controlled trial. The Lancet, 2023, 402 (10408), 1147-1157.
- Tromp, J., Ouwerkerk, W., van Veldhuisen, D.J., Hillege, H.L., Richards, A.M., van der Meer, P. et al. A Systematic Review and Network Meta-Analysis of Pharmacological Treatment of Heart Failure With Reduced Ejection Fraction. JACC: Heart Failure, 2022, 10 (2), 73-84.
- Shen, L., Jhund, P.S., Petrie, M.C., Claggett, B.L., Barlera, S., Cleland, J.G.F. et al. Declining Risk of Sudden Death in Heart Failure. N Engl J Med, 2017, 377 (1), 41-51.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341 (10), 709-717.
- McMurray, J.J., Packer, M., Desai, A.S., Gong, J., Lefkowitz, M.P., Rizkala, A.R. et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med, 2014, 371 (11), 993-1004.
- Rohde, L.E., Chatterjee, N.A., Vaduganathan, M., Claggett, B., Packer, M., Desai, A.S. et al. Sacubitril/Valsartan and Sudden Cardiac Death According to Implantable Cardioverter-Defibrillator Use and Heart Failure Cause: A PARADIGM-HF Analysis. JACC: Heart Failure, 2020, 8 (10), 844-855.
- Curtain, J.P., Docherty, K.F., Jhund, P.S., Petrie, M.C., Inzucchi, S.E., Køber, L. et al. Effect of dapagliflozin on ventricular arrhythmias, resuscitated cardiac arrest, or sudden death in DAPA-HF. Eur Heart J, 2021, 42 (36), 3727-3738.
- Authors/Task Force members, Elliott, P.M., Anastasakis, A., Borger, M.A., Borggrefe, M., Cecchi, F. et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 2014, 35 (39), 2733-2779.
- Køber, L., Thune, J.J., Nielsen, J.C., Haarbo, J., Videbæk, L., Korup, E. et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med, 2016, 375 (13), 1221-1230.
- Friedman, P., Murgatroyd, F., Boersma, L.V.A., Manlucu, J., O'Donnell, D., Knight, B.P. et al. Efficacy and Safety of an Extravascular Implantable Cardioverter-Defibrillator. N Engl J Med, 2022, 387 (14), 1292-1302.
- Friedman et al. LBCT HRS, 2023.
- Swerdlow et al. HRS, 2023.
- Kircanski, B., Boveda, S., Prinzen, F., Sorgente, A., Anic, A., Conte, G. et al. Conduction system pacing in everyday clinical practice: EHRA physician survey. Europace, 2023, 25 (2), 682-687.
- Jastrzebski, M., Kielbasa, G., Cano, O., Curila, K., Heckman, L., De Pooter, J. et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J, 2022, 43 (40), 4161-4173.
- Kiehl, E.L., Makki, T., Kumar, R., Gumber, D., Kwon, D.H., Rickard, J.W. et al. Incidence and predictors of right ventricular pacinginduced cardiomyopathy in patients with complete atrioventricular block and preserved left ventricular systolic function. Heart Rhythm, 2016, 13 (12), 2272-2278.
- Abdelrahman, M., Subzposh, F.A., Beer, D., Durr, B., Naperkowski, A., Sun, H. et al. Clinical Outcomes of His Bundle Pacing Compared to Right Ventricular Pacing. J Am Coll Cardiol, 2018, 71 (20), 2319-2330.
- Sharma, P.S., Patel, N.R., Ravi, V., Zalavadia, D.V., Dommaraju, S., Garg, V. et al. Clinical outcomes of left bundle branch area pacing compared to right ventricular pacing: Results from the Geisinger-Rush Conduction System Pacing Registry. Heart Rhythm, 2022, 19 (1), 3-11.
- Chung, M.K., Patton, K.K., Lau, C.P., Dal Forno, A.R.J., Al-Khatib, S.M., Arora, V. et al. 2023 HRS/APHRS/LAHRS guideline on cardiac physiologic pacing for the avoidance and mitigation of heart failure. Heart Rhythm, 2023, 20 (9), e17-e91.
- Glikson, M., Nielsen, J.C., Kronborg, M.B., Michowitz, Y., Auricchio, A., Barbash, I.M. et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J, 2021, 42 (35), 3427-3520.
- Burri, H., Jastrzebski, M., Cano, O., Curila, K., de Pooter, J., Huang, W. et al. EHRA clinical consensus statement on conduction system pacing implantation: endorsed by the Asia Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS), and Latin American Heart Rhythm Society (LAHRS). Europace, 2023, 25 (4), 1208-1236.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.