ESC-congresverslag
In deze sessie worden de nieuwigheden in de cardiale devices behandeld.
Modern transvenous implantable cardioverter defibrillator (ICD) and cardiac resynchronization therapies (CRT): what is new?
Carsten Israel - Bielefeld, Duitsland
Nieuwe ICD-lead
Er werd een nieuwe lead ontwikkeld, gebaseerd op de 3830 lead die voor conductiesysteempacing gebruikt wordt. Deze lead heeft slechts een diameter van 4,7 French waardoor er geen subclavian crush meer zou mogen optreden. De veiligheid en duurzaamheid van deze nieuwe lead worden nu getest in de LEADR-studie.1
AdaptResponse-studie
De AdaptResponse-studie is een grote trial (met > 3 600 patiënten) met als doel het AdaptivCRT®-algoritme te vergelijken met conventionele CRT-pacing bij patiënten met medicamenteus optimaal behandeld hartfalen (HF), een intacte atrioventriculaire geleiding en een linkerbundeltakblok (LBTB). Met dit logaritme wordt rechterventrikel (RV) apex pacing beperkt en zal linkerventrikel (LV) only pacing worden gefuseerd met de intrinsieke rechterbundelgeleiding om zo resynchronisatie te bekomen.2 Op het eerste gezicht lijkt dit een negatieve studie, aangezien er met AdaptivCRT® geen statistisch significante reductie was in het primair gecombineerde eindpunt (mortaliteit en interventie voor cordecompensatie), maar de studie werd vroegtijdig stopgezet en nadien werden er echter nog laattijdig 43 primaire eindpunten gemeld. Indien deze eerder gerapporteerd waren, was de studie niet vroegtijdig beëindigd en waren de huidige borderline significante resultaten (p = 0,07) mogelijk wel significant geworden. Daarnaast wordt de reductie in het primaire eindpunt ook statistisch significant (p = 0,0037) als je enkel de patiënten met ≥ 85 % pacingpercentage meeneemt in de analyse. En tot slot lijkt de batterijduur te verlengen door RV-pacing te beperken.
Is er eigenlijk nog wel nood aan ICD's?
Tegenwoordig worden patiënten met HF heel goed behandeld met de fantastic four (ACE-inhibitor/angiotensineblokkerneprilysin- inhibitor, bètablokker, mineralocorticoïdereceptorantagonist en SGLT2-inhibitor) en revascularisatie. Onder behandeling met deze vier geneesmiddelen daalt de mortaliteit met 61 %.3 Daarmee lijkt ook plotse cardiale dood (PCD) in de hartfalenpopulatie af te nemen, namelijk met 1,2 % per decennium.4 De vraag stelt zich dan of er in de toekomst nog nood is aan ICD's in primaire preventie. Nochtans lijkt deze bevinding vooral gebaseerd op twee studies: RALES5, waarbij enkel patiënten met New York Heart Association (NYHA)-klasse 3-4 werden geïncludeerd en jaren later de PARADIGM-HF-studie6, waarbij de meerderheid van de patiënten slechts NYHA-klasse 2 en dus sowieso een verschillende mortaliteit had. Deze laatste studie toont ook aan dat HF-patiënten behandeld met enalapril of sacubitril meer risico hadden op PCD na drie jaar (8-10 %) dan te overlijden aan terminaal HF (4-6 %).6 Bovendien, als patiënten met een klasse 1-indicatie voor een ICD enkel HF-therapie kregen was hun risico op PCD 3,11 %, wat teruggebracht kon worden naar ± 1 % met een ICD.7 Ook onder een heel goede HF-behandeling is er dus nog steeds een verhoogd risico op PCD. Sterker nog, hoe beter je het HF behandelt, hoe hoger het relatieve risico dat de patiënt sterft aan PCD, al dan niet van ischemische aard. Het risico op plotse dood is namelijk cumulatief: met de huidige HF-therapie wordt de overleving langer, maar elke dag dat je ernstig HF overleeft, loop je meer risico op PCD en dat zijn dus meer dagen waarop je beschermd had kunnen zijn met een ICD. In de RALES-studie5 bedroeg PCD 29 % van de totale sterfte, terwijl dit in PARADIGM-HF-studie6 naar 39 % opgelopen was. Dat is de conversietheorie: je zet dus niet-plotse cardiale dood om naar plotse dood. In een recente studie, de DAPA-HF-studie8, bedraagt het sterftecijfer aan PCD in de interventiegroep (behandeld met dapagliflozine) 2,7 %. Critici zullen alsnog zeggen dat dit betekent dat per jaar 97,3 % van de patiënten een ICD krijgt voor niets, met het risico om endocarditis op te lopen. Anderzijds geven de richtlijnen aan dat je vanaf ≥ 0,8 % risico op PCD per jaar valt onder matig en vanaf ≥ 1,2 % per jaar onder hoog risico (data vanuit richtlijnen over hypertrofe cardiomyopathie9), en bedraagt het risico om te sterven aan endocarditis (of de ICD-extractie die erop volgt) slechts ≤ 0,1 %.
Nog een laatste mythe die ontkracht moet worden is dat ICD's niet nodig zijn bij een niet-ischemische cardiomyopathie. Dat idee komt voort uit de resultaten van de DANISH-studie10, waarbij het risico op PCD heel laag was en niet verschilde tussen patiënten die een ICD kregen en de controlegroep. Het probleem bij deze studie is echter dat de patiënten bij aanvang reeds optimaal behandeld werden met medicatie, maar de meerderheid ook een indicatie had voor CRT en deze CRT pas tijdens de studie gekregen hebben, wat de resultaten beïnvloed kan hebben.
Extravascular-ICD (EV-ICD) implantation procedure: step-by-step
Nicolas Clementy - Montpellier, Frankrijk
In deze presentatie werd stap per stap uitgelegd hoe een EV-ICD geplaatst moet worden (figuur 1). De allereerste en meteen heel belangrijke stap is het aanduiden van anatomische oriëntatiepunten (figuur 1). Om je hierbij te helpen, moet je op voorhand een thoraxfoto (RX) in anteropostior (AP) en laterale positie uitvoeren.
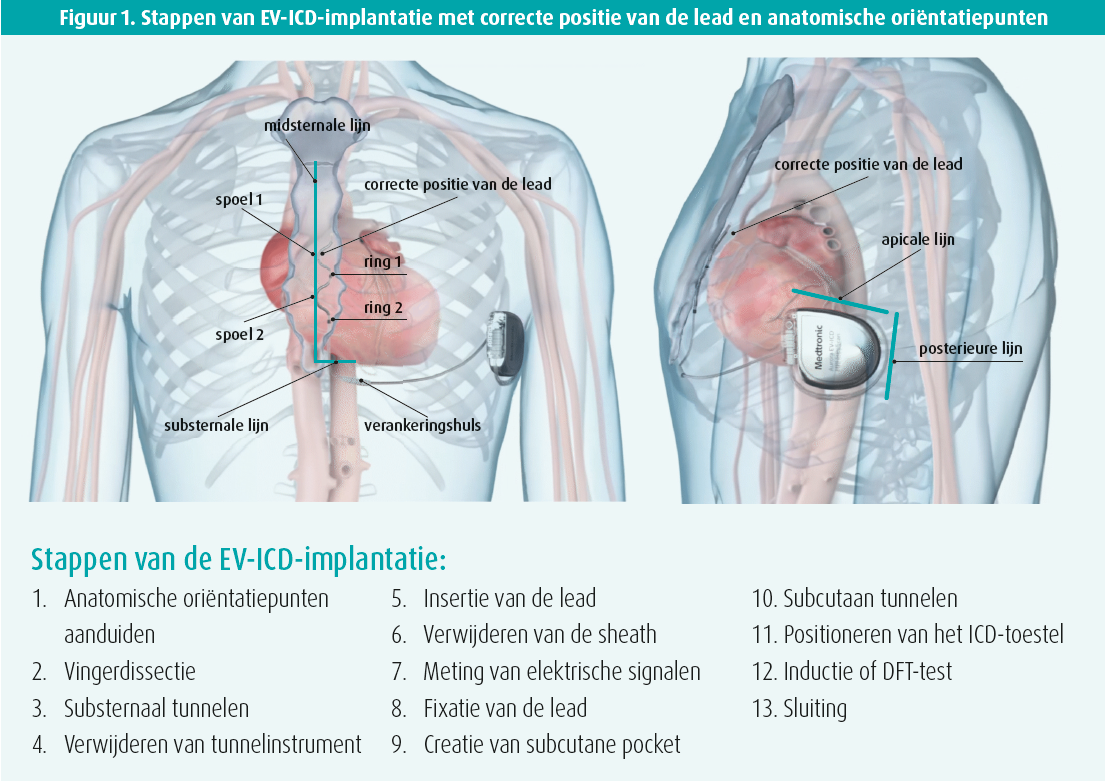
De oriëntatiepunten zijn:
- de midsternale lijn;
- de substernale inicisielijn, vrij gelijkaardig als bij de subcutane ICD (sICD);
- de apicale lijn (ter hoogte van de apex van het hart, te zien op AP RX), waaronder de ICD gepositioneerd zal worden;
- de posterieure lijn (te zien op de laterale RX), die de laterale rand van de ICD aangeeft en qua positie iets meer anterieur ligt dan bij de sICD.
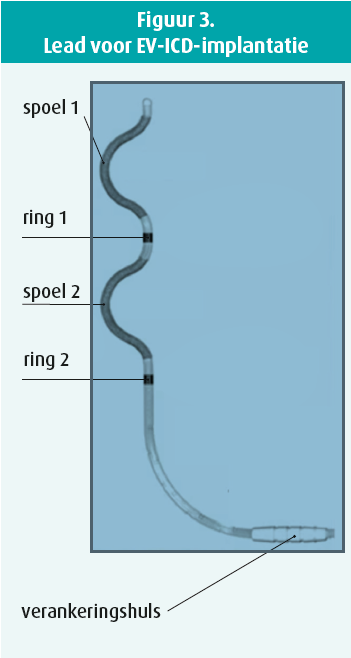
Via de substernale incisielijn ga je met je vinger richting de processus xiphoideus de substernale ruimte binnen en verbreek je daar met stompe dissectie de aanhechtingen. Het is heel belangrijk dat je dit met je vinger doet, hier zijn geen instrumenten voor nodig. Om te tunnelen heb je wel een instrument nodig, het sternale tunnelinstrument (figuur 2). Dat instrument bevat een metalen staaf waarop de sheath zit en een visuele leidraad die boven de huid blijft en zo de positie en oriëntatie van de staaf tijdens het tunnelen aangeeft. Die staaf breng je in via de ruimte die je met je vinger hebt vrijgemaakt. Daarna controleer je de oriëntatie van de staaf in AP positie. Vervolgens wissel je naar het laterale aanzicht waaronder je de staaf verder schuift net onder het sternum, waar je soms tegenaan kan botsen. Bij elke centimeter die je vooruitgeschoven bent moet je terug naar de AP positie gaan om van daaruit de positie van de staaf te verifiëren. Je alterneert dus de hele tijd tussen het AP en laterale aanzicht tijdens het tunnelen. Wanneer je de correcte positie (± 1 cm onder de carina) bereikt hebt, verwijder je de staaf zodat enkel de sheath ter plaatse overblijft. Door de sheath kan je de lead inbrengen met de juiste oriëntatie. De lead heeft een speciaal ontwerp: epsilon-vormig met twee spoelen, die aan de rechterkant van de patiënt geplaatst moeten worden, en twee ringen met elektrodes, die aan de linkerkant van de patiënt moeten uitkomen (figuur 3). Nadien kan je dan de sheath verwijderen en moet je met RX de correcte positie van de lead verifiëren. Nadien moeten de elektrische signalen worden gemeten, namelijk de R-golf en moet er worden nagegaan dat er geen p-golf is. Deze signalen lijken meer op de signalen bij de conventionele ICD dan bij de sICD. Verder moet je ook de pacingdrempel meten. Als ook de elektrische metingen in orde zijn, kan je de lead vastmaken door de verankeringshuls vast te hechten.
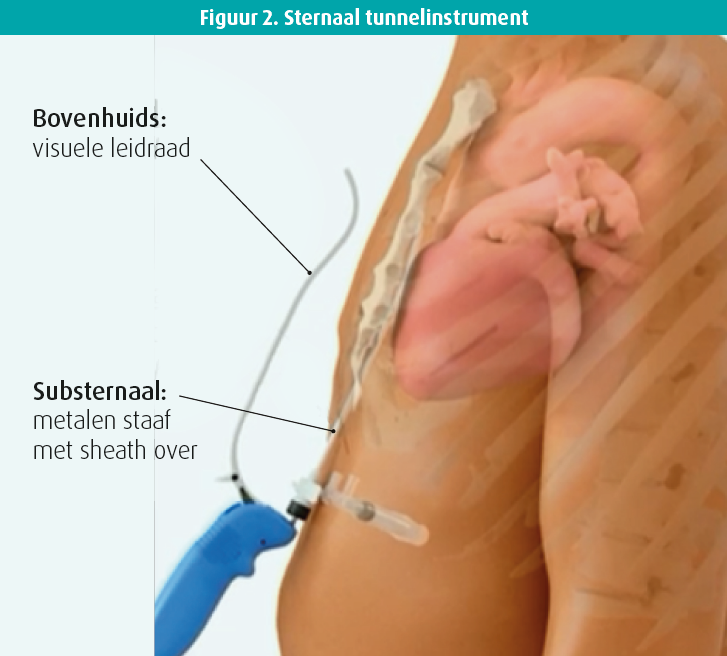
Vervolgens prepareer je de pocket axillair, afgebakend door de apicale en posterieure lijn. Nadien moet je opnieuw tunnelen, maar deze keer met een ander instrument waarmee je de lead kan klemmen. Je vertrekt dan vanuit de insertieplaats van de lead subxifoïdaal en maakt een tunnel richting axillair. Daar houd je de lead vast en verwijder je het tunnelinstrument opnieuw. Vervolgens wordt de lead aan de ICD geconnecteerd en wordt het ICD-toestel in de pocket geplaatst en vastgehecht. Nadien wordt opnieuw de positie van de lead geverifieerd en controleer je de shocking vector over het LV in AP aanzicht. Daarna is het tijd voor de DFT-test waarbij ventrikelfibrillatie (VF) wordt geïnduceerd om te bekijken of deze VF enerzijds goed gedetecteerd wordt door het toestel en anderzijds efficiënt getermineerd wordt door de shock. Nadien kan je sluiten.
Mits wat training en ervaring zou het mogelijk moeten zijn om de procedure binnen 35 à 40 minuten af te ronden. Aangezien dit substernale werkgebied nieuw is voor de meeste elektrofysiologen, is het verplicht dat er de eerste drie tot vijf keer een hartchirurg mee aan tafel staat. Daarna zou je je als cardioloog vertrouwd moeten voelen bij deze procedure, die volgens de spreker vrij eenvoudig is. Wel is het belangrijk dat deze procedure op regelmatige basis uitgevoerd wordt.
In de Extravascular ICD Pivotal-studie11 werd bij alle patiënten systematisch een CT-scan afgenomen voor de procedure om de anatomie uitgebreid in kaart te brengen. Tussen de midsternale lijn en de arteriae mammaria heb je beiderzijds een centimeter marge waardoor een letsel in deze slagaders niet zou mogen voorkomen. Momenteel is er een contra-indicatie om deze procedure uit te voeren bij post-sternotomie patiënten, aangezien er nog geen data beschikbaar zijn bij deze groep patiënten. Als patiënten na plaatsing van de EV-ICD een sternotomie nodig hebben, zal het toestel vermoedelijk opnieuw verwijderd moeten worden, maar ook hier is momenteel nog geen ervaring mee.
Extravascular ICD therapy: latest developments and clinical results
Lucas Boersma - Nieuwegein, Nederland
De lead is en blijft de achilleshiel van de transveneuze ICD. Hoewel de leads tegenwoordig bijna onbreekbaar geworden zijn, moeten ze in de bloedvaten worden geplaatst waar ze gepaard kunnen gaan met complicaties (bv. infectie). Ook het extraheren van de lead uit een bloedvat is niet zonder gevaar. Zo is de sICD ontstaan, waarbij de lead extravasculair geplaatst wordt, maar ook deze toestellen hebben hun beperkingen:
- Slechts een korte tijd post-shock- pacing;
- Geen mogelijkheid tot antitachycardiepacing (ATP);
- Hoge defibrillatiedrempel waardoor je dus een groot toestel nodig hebt, wat gepaard gaat met discomfort voor de patiënt;
- Beperkte batterijduur.
Om deze beperkingen te overwinnen is het idee van een EV-ICD ontstaan, waarbij de lead onder het sternum geplaatst wordt in plaats van onderhuids parallel aan het borstbeen. De energie nodig om te defibrilleren is lager (standaard 40J) met een kleiner toestel en een batterij die langer meegaat (± 12 jaar). Naast post-shockpacing, zijn ook ATP en pauzepreventie mogelijk.
Binnenkort zal EV-ICD beschikbaar zijn voor commerciële lancering. De resultaten tot nu toe zijn alvast veelbelovend:
- De werkzaamheid van defibrillatie bij implantatie bedraagt 99 % en dit met 30J of minder. In de helft van de gevallen was de defibrillatie aan 15J zelfs al succesvol.11 Dat betekent dat er een reserve van minstens 10J in het device zit.
- Vanwege de mogelijkheid tot ATP werden schokken in bijna de helft van alle episoden vermeden. ATP wordt over het algemeen ook goed verdragen door de patiënten, slechts 3,6 % heeft de ATP laten afzetten door een vervelend gevoel onderhuids.12
- Ongepaste schokken waren initieel aanwezig bij 11,5 % van de patiënten, wat vrij veel is. Dit percentage lijkt gelukkig af te nemen naarmate men meer ervaring kreeg met het implanteren en programmeren van de toestellen. Meestal waren deze ongepaste schokken het gevolg van cardiale overdetectie en meer bepaald vooral p-golf-overdetectie. Ondertussen werd dit opgelost met het p-golf-overdetectiealgoritme (PWOS) waarin de morfologie van de golven mee opgenomen wordt.13 Het toestel kan naar amplitudes kijken en weet dat het bij alternerende amplitudes (hoge R-golven en lage P-golven) niet om VT/VF gaat en dus ook geen therapie moet afleveren. Dit PWOS heeft geleid tot 42 % reductie van alle overdetectie-episodes zonder een effect op de detectie van atriale aritmieën, VT of VF.13
- Belangrijke systeem- of proceduregerelateerde complicaties (na 18 maanden) kwamen weinig voor, ongeveer in dezelfde mate als bij de sICD. Na zes maanden waren er enkele breuken in de leads, allemaal op dezelfde locatie (net voor de eerste elektrode). Dit werd reeds aangepakt in de productie en de nieuwe leads zijn nu sterker. Daarnaast waren er ook infecties, wat bij elk device kan voorkomen, maar bij EV-ICD's is er het voordeel dat de leads en het toestel verwijderbaar zijn zonder risico op schade aan de bloedvaten.
Conduction system pacing (CSP): why and how?
Harran Burri - Genève, Zwitserland
In de zoektocht naar een meer fysiologische manier om te pacen, heeft CSP zich de afgelopen jaren ontwikkeld in West-Europa. CSP heeft twee vormen (tabel 1). Beide technieken worden steeds meer en meer aangewend.14 Er wordt zelfs verwacht dat conventionele (RV- of biventriculaire) pacing in de toekomst zal worden overgenomen door CSP. De rol van hisbundelpacing (HBP) hierin is nog niet helemaal duidelijk, maar vooral linkerbundeltakgebiedpacing (LBP) lijkt in opmars.

Wat zijn momenteel de indicaties voor CSP?
CSP in plaats van rechterventrikelpacing (RVP)
Studies in het verleden hebben aangetoond dat 1 op 5 patiënten pacinggeïnduceerde cardiomyopathie zal ontwikkelen na vijf jaar bij > 20 % RV-pacingpercentage.16 Niet-gerandomiseerde observationele studies tonen aan dat HBP17 of LBP18 gepaard gaat met betere klinische uitkomsten (mortaliteit, hartfalenhospitalisaties of een upgrade naar biventriculaire pacing) dan RVP, maar opnieuw enkel bij ventriculaire pacing > 20 %.
CSP in plaats van biventriculaire pacing (BiVP)
In tegenstelling tot wat vaak geloofd wordt, is een LBTB niet steeds een diffuse aandoening die ook het perifere geleidingsysteem aantast, maar bevindt het blok zich meestal (in > 50 %) heel proximaal in de hisbundel zelf. Hetzelfde geldt soms ook voor een rechterbundeltakblok. Als de lead dan distaal van het blok geplaatst kan worden in de hisbundel of de linkerbundeltakregio, kunnen we de geleidingsvezels daar reeds rekruteren en een smal QRS bekomen. Tot nu toe zijn er zeven (weliswaar relatief kleine) RCT's gepubliceerd die allen aantonen dat CSP op zijn minst even goed is als BiVP en in sommige studies zelfs resulteert in betere klinische uitkomsten. Om deze reden werden de Amerikaanse richtlijnen19 enkele maanden geleden geüpdatet: bij patienten met een verminderde ejectiefractie die een pacingindicatie hebben, wordt CSP nu evenzeer aanbevolen (klasse 2a, level B) als biventriculaire pacing. In de Europese richtlijnen over cardiale pacing en resynchronisatietherapie van 202120 is LBP echter nog niet opgenomen aangezien er toen nog te weinig evidentie voor was. Momenteel is er ook nog nergens (noch in de Europese, noch in de Amerikaanse richtlijnen) een eerstelijnsindicatie voor CSP in plaats van BiVP, simpelweg omdat de evidentie rond BiVP momenteel veel groter is. HBP wordt in de Europese richtlijnen wel al aanbevolen als oplossing bij falen van BiVP.20
Hoewel de evidentie voor CSP veelbelovend en aan het toenemen is, moeten er nog enkele zaken worden geoptimaliseerd:
- Voorlopig blijft voor HBP het aantal leadrevisies en hoge drempels het grootste probleem. Men probeert de techniek voor CSP-implantatie meer en meer te standaardiseren21 in de hoop het succespercentage en de veiligheid te verbeteren.
- Voor LBP is nog geen specifieke lead ontworpen. De 3830 lead heeft reeds goede resultaten laten zien in preklinische testing, maar de tijd zal meer duidelijkheid moeten geven over hoe het deze lead zal afgaan in het septum.
- Sommigen verwachten ook dat de leadextractie bij LBP moeilijk kan worden, zeker na een aantal jaren, aangezien deze diep in het septum wordt geïmplanteerd en de metalen ring adhesies vormt met het myocard. Er is nood aan instrumenten om bij deze extractie te helpen.
- Aangezien het soms een uitdaging blijft om CSP-capture te herkennen, zou artificiële intelligentie daarbij kunnen helpen.
Kernboodschappen
Transveneuze devices
Er werd een nieuwe lead ontwikkeld, met een diameter van slechts 4,7 French, waardoor er geen subclavian crush syndrome meer zou mogen optreden.
Bij patiënten met medicamenteus optimaal behandeld HF met een intacte atrioventriculaire geleiding en een LBTB leidt adaptieve CRT niet tot een statistisch significante reductie in primair gecombineerd eindpunt in vergelijking met conventionele CRT, al was de p-waarde borderline significant (p = 0,07) en werd de studie vroegtijdig stopgezet.
PCD is nog steeds een probleem in de hartfalenpopulatie, misschien zelfs meer dan ooit door de fantastic four: het relatieve en cumulatieve risico op PCD neemt toe hoe langer de patiënt overleeft met ernstig hartfalen. Een optimaal medicamenteuze behandeling en ICD in HF zijn dus complementair in plaats van competitief.
Extravasculaire ICD (EV-ICD)
- EV-ICD-therapie biedt oplossingen voor de tekortkomingen van subcutane ICD's: naast post-shockpacing ook de mogelijkheid tot antitachycardiepacing (ATP) en pauzepreventie, lagere energienood om te defibrilleren met een kleiner toestel en een batterij die langer meegaat.
- De EV-ICD behandelde VT/VF-episodes effectief gedurende een gemiddelde follow-up van 18 maanden.
- Schokken werden in bijna de helft van alle episoden vermeden vanwege ATP.
- Het aantal ongepaste schokken zal afnemen door het nieuwe PWOS-algoritme.
- Belangrijke systeem- of proceduregerelateerde complicaties kwamen weinig voor na 18 maanden.
- De procedure om een EV-ICD te implanteren is vrij simpel aan te leren en wordt stap voor stap uitgelegd.
- Een EV-ICD is gecontra-indiceerd bij post-sternotomiepatiënten aangezien er nog geen data beschikbaar zijn bij deze patiënten.
Conductiesysteempacing (CSP)
- Er zijn twee vormen CSP: hisbundelpacing en LBP.
- De klinische uitkomsten van CSP, een meer fysiologische manier om te pacen, zijn beloftevol in vergelijking met conventionele pacingmodaliteiten.
Referenties
- Crossley, G.H., Sanders, P., De Filippo, P., Tarakji, K.G., Hansky, B., Shah, M. et al. Rationale and design of the Lead Evaluation for Defibrillation and Reliability study: Safety and efficacy of a novel ICD lead design. J Cardiovasc Electrophysiol, 2023, 34 (2), 257-267.
- Wilkoff, B.L., Filippatos, G., Leclercq, C., Gold, M.R., Hersi, A.S., Kusano, K. et al. Adaptive versus conventional cardiac resynchronisation therapy in patients with heart failure (AdaptResponse): a global, prospective, randomised controlled trial. The Lancet, 2023, 402 (10408), 1147-1157.
- Tromp, J., Ouwerkerk, W., van Veldhuisen, D.J., Hillege, H.L., Richards, A.M., van der Meer, P. et al. A Systematic Review and Network Meta-Analysis of Pharmacological Treatment of Heart Failure With Reduced Ejection Fraction. JACC: Heart Failure, 2022, 10 (2), 73-84.
- Shen, L., Jhund, P.S., Petrie, M.C., Claggett, B.L., Barlera, S., Cleland, J.G.F. et al. Declining Risk of Sudden Death in Heart Failure. N Engl J Med, 2017, 377 (1), 41-51.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341 (10), 709-717.
- McMurray, J.J., Packer, M., Desai, A.S., Gong, J., Lefkowitz, M.P., Rizkala, A.R. et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med, 2014, 371 (11), 993-1004.
- Rohde, L.E., Chatterjee, N.A., Vaduganathan, M., Claggett, B., Packer, M., Desai, A.S. et al. Sacubitril/Valsartan and Sudden Cardiac Death According to Implantable Cardioverter-Defibrillator Use and Heart Failure Cause: A PARADIGM-HF Analysis. JACC: Heart Failure, 2020, 8 (10), 844-855.
- Curtain, J.P., Docherty, K.F., Jhund, P.S., Petrie, M.C., Inzucchi, S.E., Køber, L. et al. Effect of dapagliflozin on ventricular arrhythmias, resuscitated cardiac arrest, or sudden death in DAPA-HF. Eur Heart J, 2021, 42 (36), 3727-3738.
- Authors/Task Force members, Elliott, P.M., Anastasakis, A., Borger, M.A., Borggrefe, M., Cecchi, F. et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 2014, 35 (39), 2733-2779.
- Køber, L., Thune, J.J., Nielsen, J.C., Haarbo, J., Videbæk, L., Korup, E. et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med, 2016, 375 (13), 1221-1230.
- Friedman, P., Murgatroyd, F., Boersma, L.V.A., Manlucu, J., O'Donnell, D., Knight, B.P. et al. Efficacy and Safety of an Extravascular Implantable Cardioverter-Defibrillator. N Engl J Med, 2022, 387 (14), 1292-1302.
- Friedman et al. LBCT HRS, 2023.
- Swerdlow et al. HRS, 2023.
- Kircanski, B., Boveda, S., Prinzen, F., Sorgente, A., Anic, A., Conte, G. et al. Conduction system pacing in everyday clinical practice: EHRA physician survey. Europace, 2023, 25 (2), 682-687.
- Jastrzebski, M., Kielbasa, G., Cano, O., Curila, K., Heckman, L., De Pooter, J. et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J, 2022, 43 (40), 4161-4173.
- Kiehl, E.L., Makki, T., Kumar, R., Gumber, D., Kwon, D.H., Rickard, J.W. et al. Incidence and predictors of right ventricular pacinginduced cardiomyopathy in patients with complete atrioventricular block and preserved left ventricular systolic function. Heart Rhythm, 2016, 13 (12), 2272-2278.
- Abdelrahman, M., Subzposh, F.A., Beer, D., Durr, B., Naperkowski, A., Sun, H. et al. Clinical Outcomes of His Bundle Pacing Compared to Right Ventricular Pacing. J Am Coll Cardiol, 2018, 71 (20), 2319-2330.
- Sharma, P.S., Patel, N.R., Ravi, V., Zalavadia, D.V., Dommaraju, S., Garg, V. et al. Clinical outcomes of left bundle branch area pacing compared to right ventricular pacing: Results from the Geisinger-Rush Conduction System Pacing Registry. Heart Rhythm, 2022, 19 (1), 3-11.
- Chung, M.K., Patton, K.K., Lau, C.P., Dal Forno, A.R.J., Al-Khatib, S.M., Arora, V. et al. 2023 HRS/APHRS/LAHRS guideline on cardiac physiologic pacing for the avoidance and mitigation of heart failure. Heart Rhythm, 2023, 20 (9), e17-e91.
- Glikson, M., Nielsen, J.C., Kronborg, M.B., Michowitz, Y., Auricchio, A., Barbash, I.M. et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J, 2021, 42 (35), 3427-3520.
- Burri, H., Jastrzebski, M., Cano, O., Curila, K., de Pooter, J., Huang, W. et al. EHRA clinical consensus statement on conduction system pacing implantation: endorsed by the Asia Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS), and Latin American Heart Rhythm Society (LAHRS). Europace, 2023, 25 (4), 1208-1236.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.