Compte rendu du congrès de la BSC - session 25
Lors de cette session, on a évoqué comment l'imagerie cardiaque peut aider au diagnostic, au traitement et au suivi des patients souffrant d'amylose cardiaque. L'amylose cardiaque est une forme de cardiomyopathie infiltrative résultant de l'accumulation extracellulaire de protéines mal repliées dans le myocarde, consistant en immunoglobulines à chaînes légères (amylose AL) ou en protéine transthyrétine mal repliée (amylose ATTR).1 L'amylose ATTR est de plus en plus souvent identifiée ces dernières années, avec une prévalence estimée à près de 1:1 000.2 L'accumulation de la protéine transthyrétine augmente progressivement avec l'âge. Chez les patients souffrant d'une amylose ATTR génétiquement normale (de type sauvage, ATTRwt), on parlait autrefois d'amylose ATTR 'sénile'. La physiopathologie exacte de cette amylose est encore inconnue.3 Il existe également une variante héréditaire (ATTRv) qui est moins prévalente.
Le rôle de l'échocardiographie
Echocardiography in amyloidosis: solving enigma's in cardiac hypertrophy
Philippe Debonnaire - AZ Sint Jan, Bruges
Lors du premier exposé, Philippe Debonnaire a abordé le rôle actuel de l'échocardiographie dans l'amylose cardiaque. Outre les red flags cliniques, tels que la sténose rachidienne et le syndrome du canal carpien bilatéral, il existe également un certain nombre de caractéristiques échocardiographiques qui peuvent nous faire penser à une amylose cardiaque. L'accumulation de fibrilles amyloïdes dans le myocarde peut se manifester par un épaississement du ventricule gauche (≥ 12 mm).1 Une hypertrophie concentrique mais aussi asymétrique du ventricule gauche, un léger épanchement péricardique, une dilatation biauriculaire, un remplissage restrictif et une valvulopathie (sténose aortique à bas débit et bas gradient) figurent parmi les caractéristiques de l'amylose cardiaque qui peuvent être détectées à l'échocardiographie.4, 5 En outre, un aspect brillant granuleux, peut également être observé à l'échocardiographie, bien qu'il s'agisse plutôt d'une observation aspécifique.1 Parfois, l'échographie ne révèle que des anomalies subtiles. Un marqueur sensible de l'amylose cardiaque est l'anomalie du strain (déformation) longitudinal du ventricule gauche et du ventricule droit. Les anomalies structurelles à l'échocardiographie dépendent de la quantité de fibrilles amyloïdes accumulées (charge amyloïde). On observe tout d'abord des anomalies fonctionnelles, par exemple dans le type de déformation longitudinale ou à des pressions de remplissage élevées basées sur E/e'. Ce n'est qu'en cas de charge amyloïde significative que d'autres paramètres tels que la fraction d'éjection et le TAPSE seront anormaux6, 7 (figure 1). Une autre caractéristique typique de l'amylose cardiaque est l'image 'd'épargne apicale' à l'analyse du GLS, indiquant une fonction longitudinale relativement préservée de l'apex comparativement aux segments basal et médian. Toutefois, une récente étude a montré que l'épargne apicale n'est pas spécifique à 100 % de l'amylose cardiaque.1
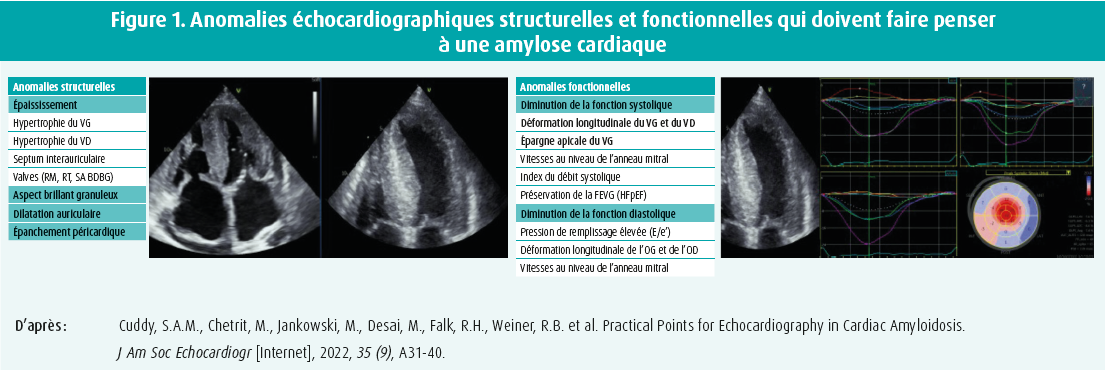
L'échocardiographie peut également être utilisée pour évaluer la progression de la maladie et la réponse au traitement. Le pronostic de l'amylose cardiaque est lié au degré de dépôts amyloïdes, qui se reflète également dans la valeur de divers biomarqueurs (comme le NT-pro-BNP, la troponine T/I et le DFGe) ainsi que dans certains paramètres échographiques, tels que la déformation longitudinale des ventricules gauche et droit et de l'oreillette gauche. Les maladies valvulaires telles que la sténose aortique sévère et l'insuffisance mitrale progressive sont également des marqueurs pronostiques de l'amylose cardiaque.4,8 Dans quelques études plus petites, l'amélioration de la déformation longitudinale globale a été corrélée à une réduction de la charge amyloïde chez les patients traités par tafamidis/patisiran.9,10 Pour l'instant, ces paramètres échocardiographiques ne sont pas suffisamment validés pour l'évaluation thérapeutique.
Le rôle de l'imagerie nucléaire
Nuclear imaging: do's and don'ts in amyloidosis diagnosis and follow-up
Oliver Gheysens - Médecine nucléaire, UCL
L'échocardiographie et l'IRM cardiaque peuvent révéler des anomalies structurelles compatibles avec un diagnostic d'amylose cardiaque, mais elles ne permettent pas de différencier l'amylose ATTR de l'amylose AL. Selon l'algorithme diagnostique du groupe de travail de l'ESC sur les maladies myocardiques et péricardiques, il convient, en cas de suspicion d'amylose cardiaque, de procéder à un bilan complémentaire pour diagnostiquer et différencier le sous-type sousjacent d'amylose cardiaque11 (figure 2). L'amylose AL peut être démontrée ou exclue en déterminant la monoclonalité à l'électrophorèse des protéines sériques et l'immunofixation urinaire et sérique. En outre, il faut réaliser une scintigraphie cardiaque (acide diphosphonopropranodicarboxylique [DPD], pyrophosphate [PYP] ou hydroxyméthylène diphosphonate [HMDP] marqués au technétium 99m) avec SPECT/CT (tomographie par émission monophotonique combinée à la tomodensitométrie). Ici, le degré de captation du traceur dans le myocarde est utilisé pour établir le grade de Perugini.11 Un grade de Perugini 2 ou 3 à la scintigraphie cardiaque a une spécificité élevée pour l'ATTR-CA (valeur prédictive positive de 98,5 %).12, 13 Le diagnostic d'ATTR-CM ne peut être posé que si l'amylose AL est exclue. Un grade 1 de Perugini est spécifique de l'amylose, mais cela nécessite un diagnostic plus approfondi avec éventuellement une biopsie, de même que dans certains cas de captation de grade 0 (p. ex. dans l'amylose AL, certaines formes héréditaires d'ATTR-CM, l'ATTR-CM précoce).13 Toutefois, un diagnostic invasif comme une biopsie implique un risque de complications plus élevé. Grâce à l'utilisation de la scintigraphie cardiaque, le diagnostic de l'ATTR est donc posé plus fréquemment, et aussi à un stade plus précoce de la maladie.14 à l'avenir, le SPECT/CT quantitatif et le PET amyloïde (avec des traceurs spécifiques de l'amyloïde : 11c-PiB, traceurs marqués au 18F, 124 I-evuzamitide) pourraient être utilisés pour mesurer quantitativement les changements dans la captation myocardique et les corréler à la progression de la maladie ou à la réponse au traitement de l'ATTR-CA.15-17

Le rôle de l'IRM cardiaque
Cardiac MRI: first-line of second-line use in amyloidosis?
Thomas Treibel - University College of London, Institute of Cardiovascular Science, Royaume-Uni
Outre l'échographie, l'IRM cardiaque est un des outils diagnostiques majeurs pour l'amylose cardiaque. Outre les dimensions et la fonction du ventricule gauche, nous pouvons également visualiser le tissu cicatriciel à l'IRM, grâce au rehaussement tardif du gadolinium (LGE). Nous pouvons estimer la charge amyloïde sur la base de la mesure du volume extracellulaire (VEC) par mapping T1 avant et après contraste.18
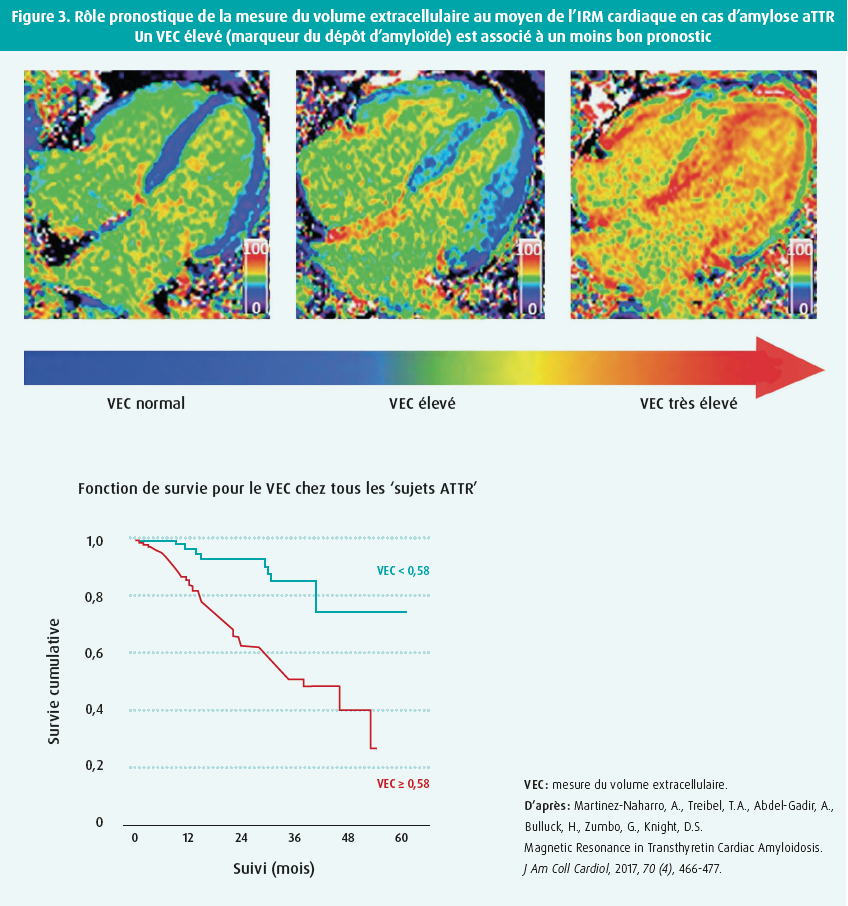
L'IRM peut également jouer un rôle dans l'estimation du pronostic et de la réponse au traitement en cas d'amylose cardiaque. L'étendue du LGE et la quantification du volume extracellulaire jouent un rôle dans l'estimation du pronostic, tant dans l'amylose ATTR que dans l'amylose AL (figure 3).5, 19, 20 Cependant, l'IRM ne peut faire la distinction entre les deux sous-types. On a publié un certain nombre d'études plus petites qui ont pu démontrer la réponse au traitement grâce à l'IRM, p. ex. avec la réduction du VEC après une chimiothérapie dans l'amylose AL ou après un traitement par patisiran+diflunisal en cas d'amylose ATTR.5, 19 L'IRM nous permet également de mieux évaluer la réponse au traitement dans d'autres systèmes d'organes (comme la rate et le foie), p. ex. chez les patients souffrant d'amylose AL.21
Les premières études montrent qu'un CT scan déclenché par l'ecg sera à terme également utilisé pour estimer la charge amyloïde comme alternative à l'IRM. Ceci peut être utile chez les patients qui ne peuvent subir d'IRM ou lorsqu'un CT scan est déjà indiqué pour une autre pathologie (p. ex. avant un TAVI, avant la pose d'un mitraclip).22, 23
Conclusion
L'échocardiographie et l'IRM ne permettent pas de poser un diagnostic définitif, mais elles peuvent nous donner une suspicion clinique conduisant à effectuer des examens complémentaires comme une scintigraphie cardiaque avec SPECT/CT et des tests monoclonaux pour différencier l'amylose ATTR de l'amylose AL. Compte tenu de l'évolution des nouveaux traitements de l'amylose cardiaque, il est important de pouvoir évaluer la progression de la maladie et la réponse au traitement. Outre l'échographie, d'autres modalités d'imagerie telles que la scintigraphie, le PET/CT à l'amyloïde, l'IRM et le CT scan cardiaque joueront également un rôle à cet égard. De plus amples études doivent encore être menées pour valider ces valeurs.
Références
- Cuddy, S.A.M., Chetrit, M., Jankowski, M., Desai, M., Falk, R.H., Weiner, R.B. et al. Practical Points for Echocardiography in Cardiac Amyloidosis. J Am Soc Echocardiogr [Internet], 2022, 35 (9), A31-40.
- Kittleson, M.M., Ruberg, F.L., Ambardekar, A.V., Brannagan, T.H., Cheng, R.K., Clarke, J.O. et al. 2023 ACC Expert Consensus Decision Pathway on Comprehensive Multidisciplinary Care for the Patient With Cardiac Amyloidosis: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol, 2023, 81 (11), 1076-1126.
- Ruberg, F.L., Grogan, M., Hanna, M., Kelly, J.W., Maurer, M.S. Transthyretin Amyloid Cardiomyopathy: JACC State-of-the-Art Review. J Am Coll Cardiol, 2019, 73 (22), 2872-2891.
- Chacko, L., Martone, R., Bandera, F., Lane, T., Martinez-Naharro, A., Boldrini, M. et al. Echocardiographic phenotype and prognosis in transthyretin cardiac amyloidosis. Eur Heart J, 2020, 41 (14), 1439-1447a.
- Martinez-Naharro, A., Treibel, T.A., Abdel- Gadir, A., Bulluck, H., Zumbo, G., Knight, D.S. et al. Magnetic Resonance in Transthyretin Cardiac Amyloidosis. J Am Coll Cardiol, 2017, 70 (4), 466-477.
- Knight, D.S., Zumbo, G., Barcella, W., Steeden, J.A., Muthurangu, V., Martinez-Naharro, A. et al. Cardiac Structural and Functional Consequences of Amyloid Deposition by Cardiac Magnetic Resonance and Echocardiography and Their Prognostic Roles. JACC Cardiovasc Imaging, 2019, 12 (5), 823-833.
- Boldrini, M., Cappelli, F., Chacko, L., Restrepo- Cordoba, M.A., Lopez-Sainz, A., Giannoni, A. et al. Multiparametric Echocardiography Scores for the Diagnosis of Cardiac Amyloidosis. JACC Cardiovasc Imaging, 2020, 13 (4), 909-920.
- Antonelli, J., Neveu, A., Kosmala, W., L'Official, G., Curtis, E., Oger, E. et al. Evolution and prognostic value of left ventricular deformation and myocardial work parameters in transthyretin amyloid cardiomyopathy. Eur Heart J Cardiovasc Imaging [Internet], 2023, jead318.
- Giblin, G.T., Cuddy, S.A.M., Gonza, E., Sewell, A., Murphy, A., Dorbala, S. et al. Effect of tafamidis on global longitudinal strain and myocardial work in transthyretin cardiac amyloidosis. Eur Heart J Cardiovasc Imaging, 2022, 23 (8), 1029-1039.
- Solomon, S.D., Adams, D., Grogan, M., González-Duarte, A., Maurer, M.S. et al. Effects of Patisiran, an RNA Interference Therapeutic, on Cardiac Parameters in Patients With Hereditary Transthyretin-Mediated Amyloidosis. Circulation, 2019, 139 (4), 431-443.
- Garcia-Pavia, P., Rapezzi, C., Adler, Y., Arad, M., Basso, C., Brucato, A. et al. Diagnosis and treatment of cardiac amyloidosis: A position statement of the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J, 2021, 42 (16), 1554-1568.
- Gillmore, J.D., Maurer, M.S., Falk, R.H., Merlini, G., Damy, T., Dispenzieri, A. et al. Heart Failure Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation, 2016, 133 (24), 2404-2412.
- Rauf, M.U., Hawkins, P.N., Cappelli, F., Perfetto, F., Zampieri, M., Argiro, A. et al. Tc-99m labelled bone scintigraphy in suspected cardiac amyloidosis. Eur Heart J [Internet], 2023, 44 (24), 2187-2198.
- Ioannou, A., Patel, R.K., Razvi, Y., Porcari, A., Massa, P., Knight, D. et al. Impact of Earlier Diagnosis in Cardiac ATTR Amyloidosis Over the Course of 20 Years. Circulation, 2022, 146 (22), 1657-1670.
- Pemberton, H.G., Collij, L.E., Heeman, F., Bollack, A., Shekari, M. Quantification of amyloid PET for future clinical use: a state-of-the-art review. Eur J Nucl Med Mol Imaging [Internet], 2022, 3508-3528.
- Gheysens, O., Treglia, G., Masri, A., Hyafil, F., Dorbala, S., Gheysens, O. Treatment response assessment in transthyretin - related cardiac amyloidosis : an emerging clinical indication of bone - seeking radiopharmaceuticals? Eur J Nucl Med Mol Imaging [Internet], 2024, 51 (3), 691-694.
- Kessler, L., Costa, F., Kersting, D., Jentzen, W., Weber, M., Lu, P. et al. Quantitative 99m Tc-DPD-SPECT / CT assessment of cardiac amyloidosis. J Nucl Cardiol, 2023, 30 (1), 101-111.
- Fontana, M., Pica, S., Reant, P., Abdelgadir, A., Treibel, T.A., Banypersad, S.M. et al. Prognostic Value of Late Gadolinium Enhancement Cardiovascular Magnetic Resonance in Cardiac Amyloidosis. Circulation, 2015, 132 (16), 16-18.
- Fontana, M., Martinez-Naharro, A., Chacko, L., Rowczenio, D., Gilbertson, J.A., Whelan, C.J. et al. Reduction in CMR Derived Extracellular Volume With Patisiran Indicates Cardiac Amyloid Regression. JACC Cardiovasc Imaging, 2021, 14 (1), 189-199.
- Banypersad, S.M., Fontana, M., Maestrini, V., Sado, D.M., Captur, G., Petrie, A. et al. T1 mapping and survival in systemic light-chain amyloidosis. Eur Heart J, 2015, 36 (4), 244-251.
- Wisniowski, B., Lachmann, H., Wechelakar, A., Whelan, C., Kellman, P. Multi-Imaging Characterization of Cardiac Phenotype in Different Types of Amyloidosis. Jacc Cardiovasc Imaging, 2023, 16 (4), 464-477.
- Gama, F., Rosmini, S., Bandula, S., Patel, K.P., Massa, P., Tobon-Gomez, C. et al. Extracellular Volume Fraction by Computed Tomography Predicts Long-Term Prognosis Among Patients With Cardiac Amyloidosis. JACC Cardiovasc Imaging [Internet], 2022, 15 (12), 2082-2094.
- Scully, P.R., Patel, K.P., Saberwal, B., Klotz, E., Augusto, J.B., Thornton, G.D. et al. Identifying Cardiac Amyloid in Aortic Stenosis: ECV Quantification by CT in TAVR Patients. JACC Cardiovasc Imaging [Internet], 2020, 13 (10), 2177-2189.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.