Compte rendu du congrès de la BSC - session 32
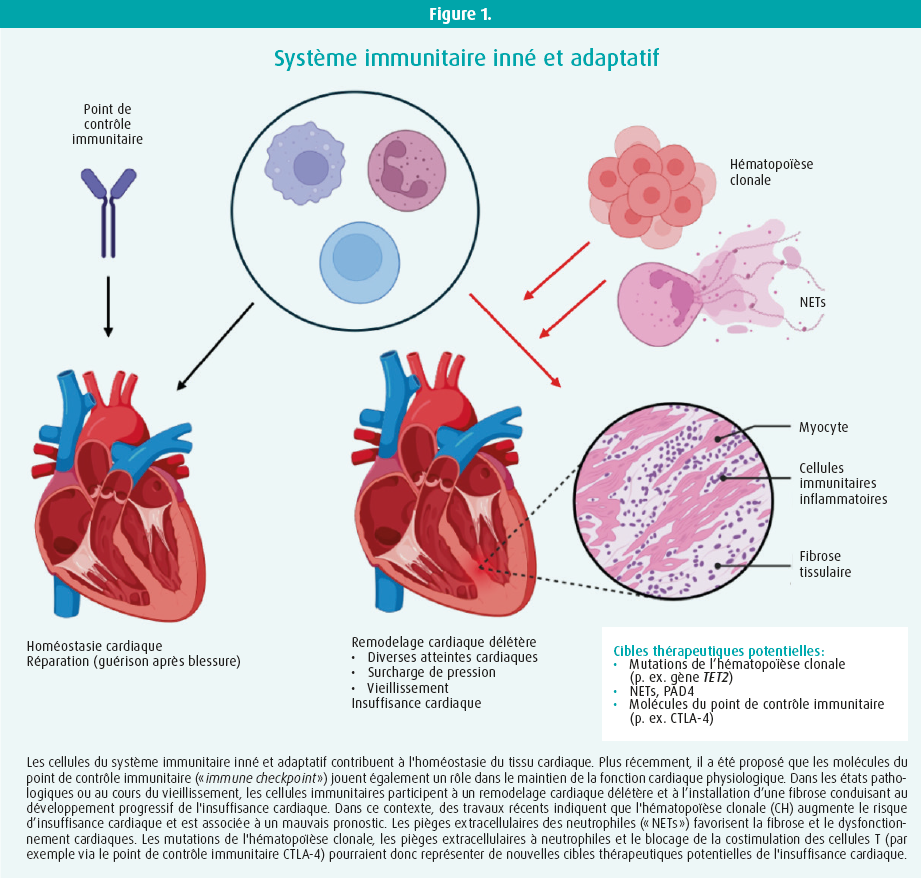
Le système immunitaire joue un rôle central pour combattre et limiter la propagation des microbes. Une réponse immunitaire coordonnée est nécessaire pour distinguer l'étranger du soi, pour éliminer les débris cellulaires et pour promouvoir la réparation des tissus en réponse à une blessure stérile. Plusieurs types de cellules immunitaires (immunité innée et adaptative) infiltrent le tissu cardiaque où elles communiquent avec les cardiomyocytes pour assurer l'homéostasie tissulaire. Leur nombre change en réponse aux agressions via leur recrutement à partir de la circulation sanguine ou une expansion locale. Si ces cellules sont nécessaires à la réparation des tissus dans la phase aiguë qui suit la blessure, elles peuvent également être responsables d'un remodelage cardiaque défavorable, conduisant à une insuffisance cardiaque, lorsque les réponses aiguës ne se résorbent pas spontanément. Les cellules immunitaires sont également impliquées dans le remodelage cardiaque qui se développe avec l'âge dans un contexte inflammatoire de bas grade. Le remodelage cardiaque délétère est associé à l'installation d'une fibrose tissulaire due à une production et un dépôt anormaux de matrice extracellulaire qui remplace le tissu normal.
Lors d'une excellente session organisée par le groupe de travail BSC en science fondamentale, des concepts novateurs du rôle du système immunitaire dans les maladies cardiovasculaires et, en particulier, dans l'insuffisance cardiaque ont été présentés par trois experts de renommée internationale du domaine.
T cells in cardiac disease, from principles to therapy
Marinos - Kallikourdis - Humanitas Clinical and Research, Milan Italië
Marinos Kallikourdis a parlé du rôle du système immunitaire adaptatif dans l'insuffisance cardiaque. Les inhibiteurs de points de contrôle immunitaire (« immune checkpoint inhibitors », ICI ) sont devenus des modalités de traitement standard pour une variété de cancers. Les ICI sont des anticorps monoclonaux qui bloquent les points de contrôle immunitaires et revitalisent l'activité des cellules T, produisant ainsi une réponse antitumorale. Actuellement, neuf ICI ont été approuvés par la Food and Drug Administration. Malgré une efficacité anticancéreuse avérée, des effets indésirables liés au système immunitaire ont été associés à l'utilisation des ICI. Au niveau cardiovasculaire, il s'agit notamment de la myocardite aiguë fulminante, de l'athérosclérose accélérée et de l'insuffisance cardiaque non liée à la myocardite. Un rôle potentiel des molécules de contrôle immunitaire dans le maintien de l'homéostasie cardiaque et en tant que cibles immunothérapeutiques de l'insuffisance cardiaque a donc été proposé.1 Dans une étude menée sur des souris, l'équipe de Maronis Kallikourdis a identifié les différents sous-ensembles de cellules immunitaires dans le coeur à différents stades du développement de l'insuffisance cardiaque.2 L'équipe a également utilisé un modèle murin de vieillissement pour évaluer l'effet du blocage de la costimulation des lymphocytes T sur l'insuffisance cardiaque liée à l'âge. L'abatacept, une fusion protéine-immunoglobuline du point de contrôle immunitaire CTLA-4 (« cytotoxic T lymphocyte antigen 4 »), a permis d'atténuer l'insuffisance cardiaque, en rétablissant la fonction cardiaque, en réduisant l'infiltration de cellules immunitaires dans le coeur et en diminuant la fibrose cardiaque.3, 4 Kallikourdis a ensuite présenté les données d'une étude récente menée en collaboration avec Gianluigi Condorelli (Hôpital de recherche Humanitas, Milan) sur une petite cohorte de patients atteints de la maladie COVID-19.5 Cette étude a révélé que les cellules B étaient activées et produisaient des anticorps contre deux antigènes cardiaques uniquement chez les patients présentant une imagerie par résonance magnétique cardiaque anormale lors du suivi six mois après la sortie de l'hôpital. Fait impressionnant, ces antigènes cardiaques ont induit un dysfonctionnement cardiaque lorsqu'ils ont été utilisés pour stimuler des réponses auto-immunes chez la souris.
Extracellular traps and cardiac aging
Kim Martinod - KU Leuven
Le deuxième orateur invité était Kim Martinod. Ses recherches portent sur l'interaction entre la thrombose et l'inflammation dans les maladies cardiaques, et plus particulièrement sur le rôle des pièges extracellulaires des neutrophiles (« neutrophil extracellular traps », NETs) dans le développement de l'insuffisance cardiaque. Bien que les NETs aient d'abord été décrits comme un mécanisme de défense antibactérien, la NETose (le processus de formation des NET) peut également se produire lors d'une inflammation stérile, comme c'est le cas au cours du vieillissement. La formation des NET dépend de l'activation de la peptidylarginine déiminase 4 (PAD4), une enzyme impliquée dans la citrullination des protéines. Les études menées par Kim Martinod sur des modèles murins ont montré un effet protecteur de la déficience en PAD4 dans des contextes inflammatoires aigus ainsi que dans des contextes plus chroniques liés à l'installation d'une fibrose cardiaque. L'équipe a montré que l'absence de PAD4 chez la souris protège le coeur, avec une fonction systolique et diastolique préservée au cours du vieillissement et une réduction de la fibrose cardiaque interstitielle.6 Dans une étude récente, l'équipe du Kim Martinod a mis en évidence le rôle clé de PAD4 exprimé par les neutrophiles dans ce processus.7 Elle a donc proposé que PAD4 serait une cible thérapeutique potentielle dans l'insuffisance cardiaque liée au vieillissement.
Clonal hematopoiesis and cardiovascular disease: from humans to mice and back
José Javier Fuster Ortuño - Centre National Espagnol de Recherche Cardiovasculaire, Madrid, Espagne
Le troisième orateur était José Fuster, associé au Centre national espagnol de recherche cardiovasculaire (CNIC) à Madrid, en Espagne. Les recherches du José Fuster sont depuis longtemps consacrées au rôle de l'hématopoïèse clonale liée à l'âge dans les maladies cardiovasculaires. L'hématopoïèse clonale à potentiel indéterminé (CHIP) correspond à l'apparition de mutations somatiques dans les progéniteurs des cellules sanguines, conférant un avantage concurrentiel aux cellules mutées, ce qui entraîne l'apparition de sous-populations de cellules immunitaires génétiquement distinctes. L'incidence de ce phénomène augmente avec l'âge. Des études indiquent que la CHIP représente un nouveau facteur de risque des maladies cardiovasculaires, indépendant des facteurs de risque conventionnels tels que l'hypercholestérolémie. L'équipe de José Fuster a démontré que les mutations du gène TET28, les plus fréquentes dans la CHIP, augmentent l'inflammation et accélèrent le développement de l'athérosclérose, ce qui pourrait expliquer le lien entre la CHIP et le risque cardiovasculaire.9 L'équipe a également montré que les mutations du gène TET2 étaient associées à un risque accru d'insuffisance cardiaque et à sa progression accélérée chez les patients présentant une fraction d'éjection réduite, quelle que soit l'étiologie.10 Bien que des recherches supplémentaires soient nécessaires pour comprendre pleinement comment la CHIP, et les mutations spécifiques, provoque ces maladies, les études du José Fuster ouvrent la voie à de grandes perspectives. En effet, alors que les approches anti-inflammatoires se sont avérées bénéfiques dans le traitement des maladies cardiovasculaires, on pourrait considérer les patients atteints de CHIP comme une population cible particulièrement intéressante pour le développement de nouvelles approches liées aux mutations spécifiques de la CHIP.11
Références
- Gergely, T.G., Drobni, Z.D., Kallikourdis, M., Zhu, H., Meijers, W.C., Neilan, T.G. et al. Immune checkpoints in cardiac physiology and pathology: therapeutic targets for heart failure. Nat Rev Cardiol, 2024.
- Martini, E., Kunderfranco, P., Peano, C., Carullo, P., Cremonesi, M., Schorn, T. et al. Single- Cell Sequencing of Mouse Heart Immune Infiltrate in Pressure Overload-Driven Heart Failure Reveals Extent of Immune Activation. Circulation, 2019, 140 (25), 2089-2107.
- Martini, E., Cremonesi, M., Panico, C., Carullo, P. Bonfiglio, C.A., Serio, QS. et al. T Cell Costimulation Blockade Blunts Age-Related Heart Failure. Circ Res, 2020, 127 (8), 1115-1117.
- Kallikourdis, M., Martini, E., Carullo, P., Sardi, C., Roselli, G., Greco, C. et al. T cell costimulation blockade blunts pressure overload-induced heart failure. Nat Commun, 2017, 8, 14680.
- Cremonesi, M., Felicetta, A., Cannata, F., Serio, S., van Beek, J.J.P., Bombace, S. et al. Long COVID-19 Cardiac Complications Are Associated With Autoimmunity to Cardiac Self-Antigens Sufficient to Cause Cardiac Dysfunction. Circulation, 2023, 148 (6), 504-507.
- Martinod, K., Witsch, T., Erpenbeck, L., Savchenko, A., Hayashi, H., Cherpokova, D. et al. Peptidylarginine deiminase 4 promotes age-related organ fibrosis. J Exp Med, 2017, 214 (2), 439-458.
- Van Bruggen, S., Kraisin, S., Van Wauwe, J., Bomhals, K., Stroobants, M., Carai, P. et al. Neutrophil peptidylarginine deiminase 4 is essential for detrimental age-related cardiac remodelling and dysfunction in mice. Philos Trans R Soc B Biol Sci, 2023, 378 (1890), 20220475.
- Fuster, J.J., MacLauchlan, S., Zuriaga, M.A., Polackal, M.N., Ostriker, A.C., Chakraborty, R. et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science, 2017, 355 (6327), 842-847.
- Fuster, J.J. Clonal Hematopoiesis and Coronary Artery Disease—A Deep Connection. JAMA Cardiol, 2024.
- Pascual-Figal, D.A., Bayes-Genis, A., Díez- Díez, M., Hernández-Vicente, Á., Vázquer- Andrés, D., de la Barrera, J. et al. Clonal Hematopoiesis and Risk of Progression of Heart Failure With Reduced Left Ventricular Ejection Fraction. J Am Coll Cardiol, 2021, 77 (14), 1747-1759.
- Tall, A.R., Fuster, J.J. Clonal hematopoiesis in cardiovascular disease and therapeutic implications. Nat Cardiovasc Res, 2022, 1 (2), 116-124.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.