BSC-congresverslag - sessie 32
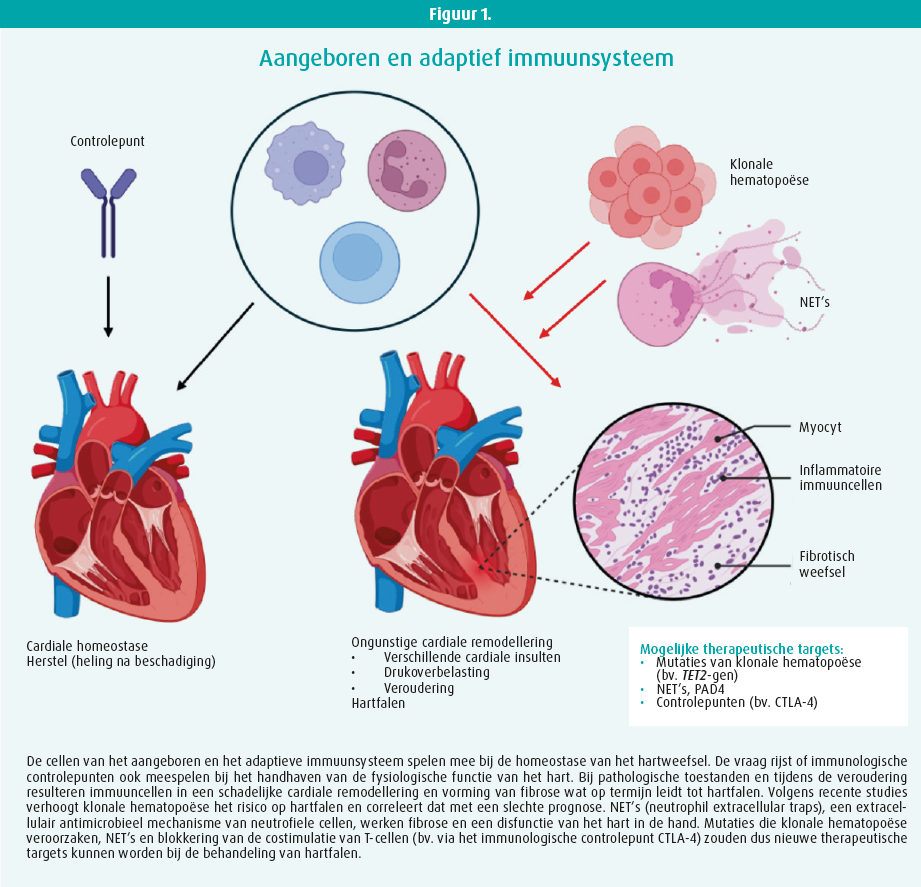
Het immuunsysteem speelt een centrale rol in de strijd tegen microben en uitbreiding van de infectie. Een gecoördineerde immuunrespons is noodzakelijk om lichaamsvreemd te onderscheiden van lichaamseigen, om celafval op te ruimen en om het herstel van de weefsels na een steriele blessure te bevorderen. Meerdere immuuncellen (aangeboren en adaptieve immuniteit) dringen in het hartweefsel en communiceren daar met de cardiomyocyten om de weefselhomeostase te verzekeren. Hun aantal verandert in reactie op agressie via rekrutering uit de bloedbaan of lokale expansie. Die cellen zijn nodig voor het herstel van de weefsels tijdens de acute fase na een blessure, maar kunnen ook een ongunstige remodellering van het hart veroorzaken wat leidt tot hartfalen als de acute respons niet spontaan resorbeert. Immuuncellen spelen ook mee bij de remodellering van het hart bij het verouderen in een context van laaggradige ontsteking. Schadelijke remodellering van het hart gaat samen met weefselfibrose door productie en abnormale afzetting van extracellulaire matrix, die het normale weefsel vervangt.
De werkgroep fundamentele wetenschap van de BSC heeft een uitstekende sessie gehouden waarop drie internationaal vermaarde experts ter zake nieuwe concepten over de rol van het immuunsysteem bij harten vaataandoeningen en vooral bij hartfalen hebben gepresenteerd.
T cells in cardiac disease, from principles to therapy
Marinos Kallikourdis - Humanitas Clinical and Research Center, Milaan, Italië
Marinos Kallikourdis heeft gesproken over de rol van het adaptieve immuunsysteem bij hartfalen. Checkpointremmers zijn een standaardbehandeling geworden bij verschillende kankers. Checkpointremmers zijn monoklonale antistoffen die de immunologische controlepunten blokkeren en de T-cellen weer nieuw leven inblazen zodat die de tumorcellen gaan aanvallen. De Food and Drug Administration heeft momenteel negen checkpointremmers goedgekeurd. Het is een doeltreffende kankertherapie, maar kan immunologisch gemedieerde bijwerkingen veroorzaken zoals een fulminante acute myocarditis, versnelde atherosclerose en niet door myocarditis veroorzaakt hartfalen. Daarom wordt vermoed dat die controlepunten een rol zouden kunnen spelen bij het handhaven van de cardiale homeostase en therapeutische targets zouden kunnen worden bij de behandeling van hartfalen.1 In een studie bij muizen heeft de groep van professor Kallikourdis de verschillende subgroepen van immuuncellen in het hart in verschillende fasen van de ontwikkeling van hartfalen geanalyseerd.2 Daarnaast heeft de groep het effect van blokkering van de costimulatie van de T-lymfocyten op leeftijdsgebonden hartfalen geëvalueerd. Abatacept, een fusie-eiwit waarbij CTLA-4 (cytotoxic T lymphocyte antigen 4) gekoppeld is aan een immunoglobuline, ging het hartfalen tegen via een herstel van de hartfunctie, minder infiltratie van immuuncellen in het hart en minder cardiale fibrose.3, 4 Kallikourdis heeft vervolgens de resultaten gepresenteerd van een recente studie uitgevoerd in samenwerking met Gianluigi Condorelli (Researchziekenhuis Humanitas, Milaan) bij een klein aantal patiënten met COVID-19.5 Bij de patiënten met een abnormale MRI van het hart tijdens de follow-up van zes maanden na ontslag uit het ziekenhuis waren de B-cellen geactiveerd en produceerden ze antilichamen tegen slechts twee antigenen van het hart. Indrukwekkend is dat die cardiale antigenen een disfunctie van het hart veroorzaakten als ze werden gebruikt om een auto-immuunrespons bij muizen op te wekken.
Extracellular traps and cardiac aging
Kim Martinod - KU Leuven
De tweede uitgenodigde spreker was Kim Martinod. Zij onderzoekt de interactie tussen trombose en ontsteking bij hartziekten en met name de rol van NET's (neutrophil extracellular traps) bij de pathogenese van hartfalen. NET's zijn een extracellulair antimicrobieel verdedigingsmechaisme, maar er kan ook NETose (het proces van vorming van NET's) plaatsvinden tijdens een steriele ontsteking zoals bij het verouderen. De vorming van NET's hangt af van activering van peptidylargininedeïminase 4 (PAD4), een enzym dat meespeelt bij de citrullinering van proteïnen. Bij muizen blijkt PAD4-deficiëntie een beschermende werking te hebben tijdens een acute ontsteking én bij een meer chronische ontsteking met fibrose van het hart. De groep van Kim Martinod heeft aangetoond dat het hart van muizen die geen PAD4 hebben, beschermd is: de systolische en diastolische functie blijven gevrijwaard bij het verouderen en er is minder interstitiële cardiale fibrose.6 In een recente studie heeft de groep van Kim Martinod aangetoond dat het PAD4 dat bij dat proces door neutrofiele cellen tot expressie wordt gebracht, een sleutelrol speelt.7 PAD4 zou volgens haar dan ook een mogelijk target kunnen worden bij de behandeling van hartfalen als gevolg van veroudering.
Clonal hematopoiesis and cardiovascular disease: from humans to mice and back
José Javier Fuster Ortuño - Centre National Espagnol de Recherche Cardiovasculaire, Madrid, Spanje
De derde spreker was José Fuster, die verbonden is aan het centrum voor cardiovasculair onderzoek (CNIC) in Madrid, Spanje. José Fuster voert al lang onderzoek uit naar de rol van leeftijdsgeboden klonale hematopoëse bij hart- en vaataandoeningen. Klonale hematopoëse met een onbepaald potentieel (CHIP) is het gevolg van somatische mutaties in de progenitorcellen van de bloedcellen.
De gemuteerde cellen hebben een concurrentieel voordeel waardoor er subpopulaties van genetisch onderscheiden immuuncellen ontstaan. De incidentie van dat verschijnsel stijgt met de leeftijd. CHIP zou een nieuwe cardiovasculaire risicofactor zijn los van de klassieke risicofactoren zoals hypercholesterolemie. De groep van José Fuster heeft aangetoond dat mutaties van het TET2-gen,8 de frequentste mutaties bij CHIP, de ontsteking verergeren en de atherosclerose versnellen. Dat zou het verband tussen CHIP en hart- en vaataandoeningen kunnen verklaren.9 De groep heeft ook aangetoond dat mutaties van het TET2-gen correleren met een hoger risico op hartfalen en een snellere verergering van het hartfalen bij patiënten met een gedaalde linkerventrikelejectiefractie, ongeacht de etiologie.10 Verder onderzoek is nodig om na te gaan via welk mechanisme CHIP en specifieke mutaties die ziekten veroorzaken. De studies van José Fuster openen alvast veel perspectieven. Ontstekingsremmende strategieën zijn doeltreffend gebleken bij de behandeling van hart- en vaataandoeningen, maar patiënten met CHIP vormen misschien een bijzonder interessante populatie voor de ontwikkeling van nieuwe strategieën gericht tegen de specifieke mutaties bij CHIP.1
Referenties
- Gergely, T.G., Drobni, Z.D., Kallikourdis, M., Zhu, H., Meijers, W.C., Neilan, T.G. et al. Immune checkpoints in cardiac physiology and pathology: therapeutic targets for heart failure. Nat Rev Cardiol, 2024.
- Martini, E., Kunderfranco, P., Peano, C., Carullo, P., Cremonesi, M., Schorn, T. et al. Single-Cell Sequencing of Mouse Heart Immune Infiltrate in Pressure Overload-Driven Heart Failure Reveals Extent of Immune Activation. Circulation, 2019, 140 (25), 2089-2107.
- Martini, E., Cremonesi, M., Panico, C., Carullo, P. Bonfiglio, C.A., Serio, QS. et al. T Cell Costimulation Blockade Blunts Age-Related Heart Failure. Circ Res, 2020, 127 (8), 1115-1117.
- Kallikourdis, M., Martini, E., Carullo, P., Sardi, C., Roselli, G., Greco, C. et al. T cell costimulation blockade blunts pressure overload-induced heart failure. Nat Commun, 2017, 8, 14680.
- Cremonesi, M., Felicetta, A., Cannata, F., Serio, S., van Beek, J.J.P., Bombace, S. et al. Long COVID-19 Cardiac Complications Are Associated With Autoimmunity to Cardiac Self-Antigens Sufficient to Cause Cardiac Dysfunction. Circulation, 2023, 148 (6), 504-507.
- Martinod, K., Witsch, T., Erpenbeck, L., Savchenko, A., Hayashi, H., Cherpokova, D. et al. Peptidylarginine deiminase 4 promotes age-related organ fibrosis. J Exp Med, 2017, 214 (2), 439-458.
- Van Bruggen, S., Kraisin, S., Van Wauwe, J., Bomhals, K., Stroobants, M., Carai, P. et al. Neutrophil peptidylarginine deiminase 4 is essential for detrimental age-related cardiac remodelling and dysfunction in mice. Philos Trans R Soc B Biol Sci, 2023, 378 (1890), 20220475.
- Fuster, J.J., MacLauchlan, S., Zuriaga, M.A., Polackal, M.N., Ostriker, A.C., Chakraborty, R. et al. Clonal hematopoiesis associated with TET2 deficiency accelerates atherosclerosis development in mice. Science, 2017, 355 (6327), 842-847.
- Fuster, J.J. Clonal Hematopoiesis and Coronary Artery Disease—A Deep Connection. JAMA Cardiol, 2024.
- Pascual-Figal, D.A., Bayes-Genis, A., Díez-Díez, M., Hernández-Vicente, Á., Vázquer-Andrés, D., de la Barrera, J. et al. Clonal Hematopoiesis and Risk of Progression of Heart Failure With Reduced Left Ventricular Ejection Fraction. J Am Coll Cardiol, 2021, 77 (14), 1747-1759.
- Tall, A.R., Fuster, J.J. Clonal hematopoiesis in cardiovascular disease and therapeutic implications. Nat Cardiovasc Res, 2022, 1 (2), 116124.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.