Introduction
Les dernières décennies ont été marquées par une diminution de l'incidence de l'insuffisance cardiaque, et ce, grâce à une importante progression de la prévention et du traitement et à une amélioration du pronostic des patients souffrant d'insuffisance cardiaque à fraction d'éjection réduite (HFrEF).1 En effet, les recommandations actuelles de la Société Européenne de Cardiologie (ESC) nous fournissent un très large spectre de traitements evidence-based pour l'HFrEF.2 Toutefois, le nombre de patients souffrant d'insuffisance cardiaque à fraction d'éjection préservée (HFpEF) a augmenté au cours de la même période et, actuellement, au moins 50 % de tous les patients hospitalisés pour insuffisance cardiaque ont une fraction d'éjection préservée.3 Malheureusement, les possibilités de traitement de l'HFpEF sont jusqu'à présent décevantes (figure 1) et les recommandations de l'ESC se limitent à un traitement symptomatique ciblé sur la diminution de la congestion et le contrôle des comorbidités.2
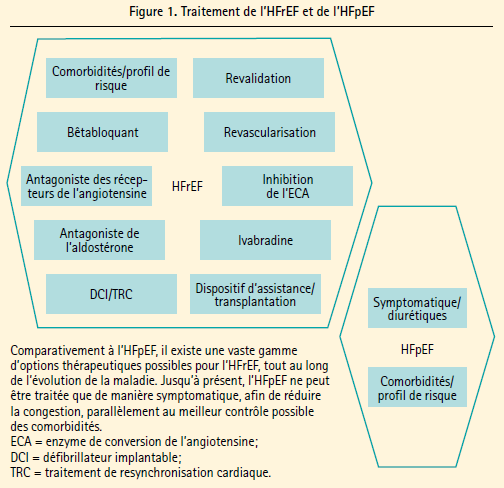 Le manque d'options thérapeutiques adéquates pour les patients souffrant d'HFpEF peut être attribué à deux facteurs importants. Tout d'abord, une bonne partie des études antérieures comportaient des problèmes méthodologiques, et des groupes très diversifiés de patients ont été étudiés.4 Toutefois, le fait que la physiopathologie de l'HFpEF était à peine connue, il y a un peu plus de 10 ans, constitue un problème beaucoup plus important,5 et l'amélioration sur ce plan ne date que des dernières années.6, 7
Le manque d'options thérapeutiques adéquates pour les patients souffrant d'HFpEF peut être attribué à deux facteurs importants. Tout d'abord, une bonne partie des études antérieures comportaient des problèmes méthodologiques, et des groupes très diversifiés de patients ont été étudiés.4 Toutefois, le fait que la physiopathologie de l'HFpEF était à peine connue, il y a un peu plus de 10 ans, constitue un problème beaucoup plus important,5 et l'amélioration sur ce plan ne date que des dernières années.6, 7 Cette revue analyse les connaissances actuelles au sujet de la physiopathologie de l'HFpEF, ainsi que les nouveaux développements sur le plan du diagnostic, avec une conclusion consacrée aux futures options thérapeutiques potentielles.
Physiopathologie
Ces dernières années, les connaissances au sujet de la physiopathologie de l'HFpEF se sont étoffées grâce à des études scientifiques. Récemment, un bel article de synthèse a donné un aperçu très détaillé de la physiopathologie.8 Cette revue se limitera aux connaissances actuelles relatives aux anomalies myocardiques dans le ventricule gauche (VG) en cas d'HFpEF. Une caractéristique de l'HFpEF, qui est d'ailleurs à la base de la symptomatologie, est une rigidité accrue du myocarde, débouchant sur une dysfonction diastolique du VG, qu'on peut définir au mieux comme l'impossibilité, pour le coeur, de parvenir à un volume télédiastolique adéquat sans augmentation trop importante des pressions dans le coeur, et ce, sans atteinte endocardique ni péricardique.9 La rigidité accrue qu'on observe au niveau du myocarde touché par l'HFpEF repose sur une interaction complexe entre la matrice extracellulaire et les cardiomyocytes. Avant de traiter plus en détail de cette interaction, il importe d'examiner ce qui semble provoquer l'HFpEF.
Inflammation microvasculaire due à des comorbidités métaboliques: la cause de l'HFpEF?
Contrairement à la plupart des cas d'HFrEF, la cause de l'HFpEF est longtemps restée incertaine. Un patient peut par exemple développer une HFrEF après un infarctus myocardique étendu, une chimiothérapie cardiotoxique, ou encore suite à une fibrillation auriculaire avec réponse ventriculaire rapide. En cas d'HFpEF, il est pratiquement impossible de pointer une cause bien déterminée, mais des études épidémiologiques récentes démontrent notamment que la prévalence de comorbidités est très élevée dans cette population.
En dépit du fait que de nombreuses études ne rapportent pas le périmètre abdominal ni le nombre de patients présentant une surcharge pondérale (indice de masse corporelle (IMC) 25-30 kg/m2), il s'avère qu'un tiers de tous les patients sont obèses, d'après un très vaste registre (IMC ≥ 30kg/m2).10 Par ailleurs, dans ce même registre, 46 % de tous les patients souffrant d'HFpEF étaient diabétiques. La prévalence d'hypertension artérielle est également très élevée en cas d'HFpEF, variant de 76 à 96 %.10, 11 Les BPCO et l'insuffisance rénale chronique sont également très fréquentes en cas d'HFpEF, les prévalences atteignant respectivement 33 % et 52 %.10 Il va de soi que bon nombre de patients présentent plus d'une comorbidité. En outre, le nombre de comorbidités a une importance pronostique.12 La grande analogie entre ces comorbidités métaboliques est qu'elles sont capables de créer un statut inflammatoire stérile chronique de bas grade, qui est par ailleurs couplé à un stress oxydatif. Ces observations ont débouché sur un nouveau paradigme pour la physiopathologie de l'HFpEF.6
Inflammation et stress oxydatif en cas d'HFpEF
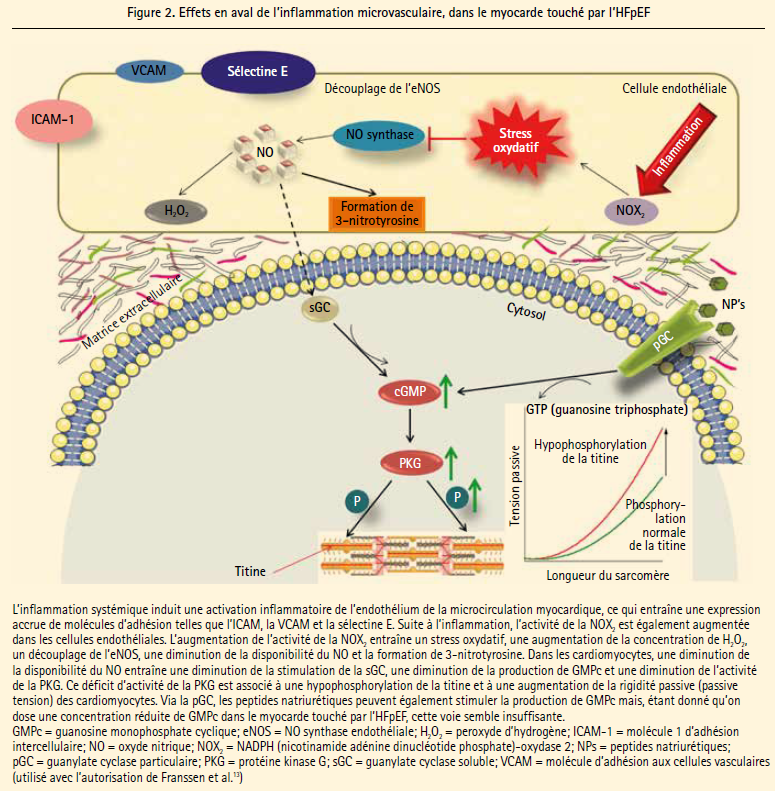
Dans le nouveau paradigme pour la physiopathologie de l'HFpEF, les comorbidités métaboliques occupent une place centrale, étant donné qu'elles sont capables de créer un statut inflammatoire chronique avec un stress oxydatif, qui touche notamment l'endothélium des microvaisseaux coronaires.6 En effet, on a récemment démontré, dans le myocarde de patients souffrant d'HFpEF, une expression accrue des molécules d'adhésion vasculaire de type sélectine E et ICAM-1 (molécule d'adhésion intercellulaire), et ce, comparativement à l'HFrEF et aux patients souffrant de sténose valvulaire aortique (SA), ce qui indique une inflammation microvasculaire en cas d'HFpEF (figure 2). La concentration de peroxyde d'hydrogène (H2O2) était également significativement plus élevée dans le myocarde touché par l'HFpEF, comparativement à l'HFrEF ou au tissu myocardique de patients souffrant de sténose valvulaire aortique, ce qui traduit un stress oxydatif.13
Ces observations humaines ont été confirmées dans un modèle d'HFpEF récemment développé, impliquant des rats.13 Ce modèle utilise des rats ZSF-1 obèses, issus d'un croisement entre des rats Zucker diabétiques obèses et des rats spontanément hypertendus, souffrant d'insuffisance cardiaque. Ce croisement donne naissance à des rats hypertendus dès la naissance, mais qui ne connaissent pas le sentiment de satiété, à cause de leur résistance à la leptine, et qui développent de ce fait une obésité et par la suite un diabète. Sur le plan cardiaque, ils développent un tableau manifeste d'HFpEF avec une hypertrophie concentrique du VG, une fonction systolique préservée, une augmentation des pressions de remplissage et une congestion pulmonaire.14 Le fait que seuls les rats obèses diabétiques développent le phénotype d'HFpEF et que les rats témoins hypertendus conservent une fonction cardiaque normale plaide fortement en faveur de l'importance des comorbidités métaboliques dans la physiopathologie de l'HFpEF.14 Chez ces rats ZSF-1 obèses, on a noté une expression nettement accrue de la sélectine E et de l'ICAM-1, mais aussi de CD68 et de la myéloperoxydase, des marqueurs des monocytes/macrophages et de leur état activé.13 Par le passé, il est également déjà apparu que la molécule d'adhésion aux cellules vasculaires était davantage exprimée en cas d'HFpEF.15 Outre les marqueurs inflammatoires, la concentration d'H2O2 était également plus élevée chez les rats ZSF-1 obèses que chez les rats témoins.
Une des enzymes importantes, capables de générer un stress oxydatif myocardique, est la NADPH (nicotinamide adénine dinucléotide phosphate)-oxydase 2 (NOX2) (figure 2). Cette enzyme est également augmentée dans le myocarde des patients souffrant d'HFpEF ainsi que chez les rats ZSF-1 obèses, mais cette expression accrue était surtout localisée au niveau de l'endothélium microvasculaire et des macrophages, tandis qu'il n'y avait pas d'augmentation de l'expression de NOX2 dans les cardiomyocytes.13 En outre, dans une récente étude post mortem, on a démontré que le myocarde touché par l'HFpEF est caractérisé par une densité de capillaires moindre ('capillary rarefaction').16 Ces observations suggèrent que la physiopathologie de l'HFpEF se déroule en premier lieu au niveau de l'endothélium, et que c'est au départ de cet endroit qu'elle influence la fonction cardiomyocytaire et myocardique. Elle ne constituerait donc pas tellement un problème cardiomyocytaire primaire. Les effets de cette inflammation endothéliale microvasculaire et du stress oxydatif sur le fonctionnement des cardiomyocytes seront traités plus loin.
Augmentation de la rigidité myocardique en cas d'HFpEF
Les expérimentations sur des biopsies d'HFpEF ont fourni d'importantes notions au sujet de la base de la rigidité myocardique accrue en cas d'HFpEF.17 Les cardiomyocytes ont été isolés au départ de ces biopsies endomyocardiques, et ont été fixés sous microscope entre un capteur de force et un lengtemotor. Ceci permet de mesurer la force passive (Fpassive) générée lorsque ces cardiomyocytes sont étirés. Cette Fpassive s'est avérée nettement plus élevée que dans les biopsies témoins. En outre, la Fpassive et le degré de fibrose (collagen volume fraction, CVF) étaient corrélés avec les paramètres de la fonction diastolique mesurés de manière invasive chez les patients.17 Par ailleurs, on a remarqué que l'administration de protéine kinase A (PKA) pouvait normaliser la rigidité des cardiomyocytes, et ce, vraisemblablement en corrigeant une hypophosphorylation de l'énorme protéine cardiomyocytaire qu'est la titine17 (figure 2). La titine, la plus grosse protéine du corps humain, donne d'une part un soutien aux filaments contractiles (actine et myosine) et les maintient en place, mais d'autre part, la titine détermine la rigidité des cardiomyocytes.18 Des études de suivi ont démontré que la titine est effectivement hypophosphorylée dans des biopsies d'HFpEF humaines, mais aussi chez les rats ZSF-1 obèses, et que cette hypophosphorylation donnait lieu à des cardiomyocytes plus rigides, ce qu'on pouvait corriger au moyen de PKA ou de PKG.14, 19, 20 Par ailleurs, les cardiomyocytes des biopsies d'HFpEF étaient plus grands et plus rigides que ceux observés en cas d'HFrEF, et ce, indépendamment de la CVF, ce qui suggère que les cardiomyocytes/la titine jouent peut-être un rôle plus important dans la rigidité myocardique que la fibrose de la matrice extracellulaire.19 En outre, les rats ZSF-1 obèses avaient un phénotype d'HFpEF clair, sans modifications du métabolisme du collagène.14
étant donné que ceci revêt une importance cruciale pour la physiopathologie, les contributions relatives des cardiomyocytes et de la fibrose en cas d'HFpEF ont dès lors été étudiées récemment dans de fines bandelettes musculaires myocardiques. Ces bandelettes musculaires sont également fixées entre un capteur de force et un lengtemotor, mais la différence par rapport aux cardiomyocytes isolés est que la Fpassive mesurée lors de l'étirement est à présent générée tant par les cardiomyocytes que par la matrice extracellulaire. En ajoutant à ces bandelettes une solution de KI et de KCl, toutes les protéines cardiomyocytaires sont découplées, mais la matrice extracellulaire reste intacte. La contribution de la matrice extracellulaire à la Fpassive peut être calculée en étirant à nouveau les bandelettes. Des expérimentations menées sur les rats ZSF-1 obèses ont montré que la matrice extracellulaire ne commence à jouer un rôle que lors d'un étirement (vraisemblablement) supraphysiologique de la bandelette musculaire.14 Une récente étude lors de laquelle on a prélevé des biopsies chez des patients souffrant d'HFpEF lors d'un CABG a en effet démontré que la matrice extracellulaire ne contribue de manière significative à la rigidité myocardique qu'en cas d'étirement important de la bandelette musculaire.21 Ces observations pourraient s'expliquer par le fait que, sur le plan de la rigidité, la matrice extracellulaire joue purement un rôle au niveau de la protection contre l'excès d'étirement du myocarde, mais aussi que la fibrose du myocarde ne se produit qu'à un stade avancé d'HFpEF. En effet, contrairement à l'HFrEF, où la fibrose remplace les cardiomyocytes nécrosés ('replacement fibrosis'), la fibrose notée en cas d'HFpEF est réactionnelle et ne remplace pas les cardiomyocytes, de sorte que ceci ne joue potentiellement un rôle plus important qu'à un stade plus avancé de la maladie.6
Relation entre les comorbidités, l'inflammation, le stress oxydatif et la rigidité myocardique
Comme nous l'avons cité plus haut, l'HFpEF est associée à une prévalence élevée de comorbidités métaboliques susceptibles d'induire une inflammation et un stress oxydatif, et le myocarde touché par l'HFpEF est caractérisé essentiellement par une augmentation de la rigidité cardiomyocytaire. L'endothélium des microvaisseaux et l'oxyde d'azote (NO) produit à cet endroit forment les chaînons manquants entre ces observations (figure 2). Dans l'endothélium, l'inflammation et le stress oxydatif entraînent une dysfonction de l'enzyme eNOS (NO synthase endothéliale), qui produit le NO. Dans l'endothélium sain, elle fonctionne comme un dimère mais, en cas d'excès de radicaux libres oxygénés, l'eNOS peut se 'découpler' en monomères qui ne vont pas produire du NO, mais des superoxydes.22 Les superoxydes sont un type très réactif de radicaux libres oxygénés, qui entraînent non seulement une dysfonction additionnelle de l'eNOS, mais qui entrent également en réaction avec le NO présent, débouchant ainsi sur la formation de peroxynitrite. Celui-ci est à son tour un dérivé très réactif qui a des effets toxiques directs sur les structures protéiques ('nitrosylation') et peut par exemple former de la 3-nitrotyrosine23 (figure 2). La conséquence de ces réactions est une diminution de la disponibilité du NO dans le myocarde touché par l'HFpEF, et cette cascade d'événements a également été confirmée récemment dans des expérimentations humaines ainsi que dans le modèle de rats ZSF-1 obèses.13
Le NO joue un rôle important dans la fonction des cardiomyocytes. En premier lieu, le NO régule également la contractilité des cardiomyocytes via l'activité des récepteurs de la ryanodine, via lesquels se produit l'influx de Ca2+ au départ du réticulum sarcoplasmique vers le cytosol.24 En outre, le NO module la première phase active de la diastole, via un contrôle sur l'activité de la Ca2+-ATPase du réticulum sarcoplasmique (SERCA) et donc la réabsorption du Ca2+ au départ du cytosol.25 La relaxation passive durant la diastole est aussi fortement influencée par le NO, via des effets en aval sur la guanosine monophosphate cyclique (GMPc) et, en fin de compte, sur l'activité de la PKG. Dans le cardiomyocyte, le NO peut stimuler la guanylate cyclase soluble (sGC) à produire du GMPc, ce qui augmente à son tour l'activité de la PKG (figure 2). En cas de diminution de disponibilité du NO, cette cascade NO-sGC-GMPc- PKG peut dès lors être compromise. Des études antérieures ont en effet déjà pu démontrer qu'il y avait une diminution de la concentration de GMPc et de l'activité de la PKG dans des biopsies d'HFpEF humaines, phénomène qui était à nouveau associé à une augmentation de la rigidité des cardiomyocytes.20 De récentes expérimentations menées sur des rats ZSF-1 obèses ont également pu démontrer une diminution de la disponibilité du NO, des diminutions des concentrations de GMPc et une diminution de l'activité de la PKG.13 Ces observations confirment le paradigme de l'HFpEF dans lequel les comorbidités métaboliques entraînent un déficit en NO, en raison de l'inflammation et du stress oxydatif, avec pour conséquence une diminution de l'activité de la PKG, débouchant en fin de compte sur une hypophosphorylation de la titine et une augmentation de la rigidité myocardique.6
Développements diagnostiques
Un premier algorithme diagnostique de l'HFpEF a été élaboré en 2007 et, en pratique clinique, on utilise notamment les critères échocardiographiques, éventuellement complétés du dosage des peptides natriurétiques.26 Toutefois, des taux de peptides natriurétiques normaux n'excluent pas une HFpEF.27 Un inconvénient important de ces recommandations est que ces dosages sont souvent réalisés au repos, et même souvent à jeun, si pas au cours d'une hospitalisation avec restriction hydrosodée. Bon nombre de patients sont asymptomatiques au repos, et ne deviennent symptomatiques que lorsqu'ils fournissent un effort (limité). En effet, de récentes études invasives ont révélé que des efforts légers (tels que ceux accomplis dans la vie quotidienne) entraînent une importante augmentation des pressions télédiastoliques du VG et peuvent provoquer des symptômes.28-30 Les patients souffrant d'HFpEF sont par ailleurs très sensibles à des modifications relativement minimes de la volémie, de sorte que les dosages effectués à jeun en milieu hospitalier ne donnent souvent pas un reflet fiable de la situation ambulatoire.31 Ces observations suggèrent que bon nombre de patients souffrant d'HFpEF ne sont pas repérés lors de la mise au point diagnostique actuellement en vigueur. En outre, on a récemment démontré, chez des patients symptomatiques souffrant d'hypertension pulmonaire inexpliquée, ayant une fraction d'éjection du VG normale et une pression capillaire pulmonaire basse au repos, qu'un effort léger durant le cathétérisme augmentait rapidement les pressions de remplissage, conduisant ainsi à poser un diagnostic de dysfonction diastolique.32 Ces observations suggèrent un rôle futur pour les tests à l'effort dans le cadre du diagnostic de l'HFpEF.33
En outre, on assiste à un développement important sur le plan des biomarqueurs, lesquels sont notamment basés sur les dépôts de collagène (fibrose) dans la matrice extracellulaire. Parmi tous les biomarqueurs possibles, seuls le PICP (le propeptide carboxy-terminal du procollagène 1) et le PIIINP (le propeptide amino-terminal du procollagène III) ont pu prouver qu'ils sont associés à la fibrose myocardique.34
Il est possible que l'applicabilité de ces biomarqueurs et d'autres développements diagnostiques réside surtout dans le fait qu'ils peuvent aider à catégoriser les patients souffrant d'HFpEF en fonction du stade de la maladie. Peut-être la phase initiale de l'HFpEF consiste-t-elle surtout en des modifications de la titine, la fibrose myocardique gagnant en importance à un stade plus avancé, et il semble dès lors évident que les deux phases requièrent un traitement différent.
Développements thérapeutiques
Jusqu'à présent, toutes les études portant sur l'HFpEF ont tout au plus donné des résultats neutres. Comme nous l'avons déjà mentionné, ceci était surtout imputable au manque de connaissances au sujet de la physiopathologie de l'HFpEF. Maintenant qu'il est clair que la physiopathologie de l'HFpEF est totalement différente de celle de l'HFrEF, il coule pratiquement de source que nous ne pouvons supposer qu'un traitement de l'HFrEF puisse être fructueux en cas d'HFpEF. En effet, il est entre-temps apparu que le traitement classique de l'HFrEF, basé sur les bêtabloquants, les IEC, les antagonistes des récepteurs de l'angiotensine et la digoxine n'est pas associé à une amélioration de la survie ni à des effets bénéfiques sur la progression de la maladie en cas d'HFpEF.35-38
Des études plus récentes, également dérivées des options thérapeutiques de l'HFrEF, ont semblé plus prometteuses sur le plan physiopathologique. Le sildénafil est un inhibiteur connu de la phosphodiestérase (PDE) de type 5, l'enzyme qui dégrade le GMPc. L'inhibition de la dégradation du GMPc pourrait dès lors entraîner une élévation de la concentration de GMPc et de l'activité de la PKG dans les cardiomyocytes. Cette hypothèse a été testée dans l'étude RELAX, mais un traitement chronique par sildénafil n'a pas entraîné d'amélioration de la capacité à l'effort ou du statut clinique, pas plus qu'il n'entraînait d'amélioration hémodynamique significative. En outre, on n'a pas observé d'augmentation de la concentration de GMPc.39 Ces résultats décevants obtenus avec le sildénafil peuvent d'une part s'expliquer par le stade avancé des patients (entre autres une prévalence élevée de fibrillation auriculaire), mais également par le fait que, si la synthèse de GMPc est moindre, c'est suite à une diminution de la disponibilité du NO, et pas tellement à cause du fait que la dégradation du GMPc est accrue en cas d'HFpEF.
Par ailleurs, on a également analysé l'indication des antagonistes de l'aldostérone en cas d'HFpEF, étant donné qu'ils réduisent la mortalité totale et cardiovasculaire en cas d'HFrEF.40-42
L'aldostérone est associée à l'inflammation et la dysfonction endothéliales, la rétention de sodium, la fibrose et l'hypertrophie (concentrique) du VG,43-45 raison pour laquelle les antagonistes de l'aldostérone semblent prometteurs en cas d'HFpEF. Toutefois, dans une étude (ALDO-DHF), on n'a observé qu'une légère amélioration échocardiographique sans amélioration de la capacité à l'effort.46 Une autre étude (TOPCAT) a malheureusement été perturbée par d'importantes différences régionales (pays d'Amérique du Nord et du Sud versus pays d'Europe de l'Est), avec des groupes de patients très différents, à propos desquels on a surtout observé une diminution des décès et des hospitalisations pour insuffisance cardiaque dans les pays américains (où les patients étaient plus atteints).47, 48 Ceci démontre qu'une bonne sélection/stadification des patients est essentielle.
Les connaissances actuelles au sujet de la physiopathologie indiquent, comme nous l'avons déjà signalé, qu'une action sur la cascade NO-sGC-GMPc-PKG peut réduire la rigidité myocardique (figure 2). Ainsi qu'on tente de le faire en cas d'HFrEF, il faut idéalement traiter la cause de l'insuffisance cardiaque. En cas d'HFpEF, il faudrait dès lors s'attaquer à la source de l'inflammation et du stress oxydatif. En cas d'obésité, par exemple, il est effectivement démontré que la perte de poids a des effets bénéfiques sur le coeur et la fonction diastolique,49 mais il n'est pas encore scientifiquement prouvé que ceci guérit effectivement l'HFpEF. En outre, il est généralement admis que les modifications du mode de vie en tant que cible thérapeutique primaire ne sont pas toujours réalisables, ce qui explique qu'on effectue beaucoup de recherches sur une prise en charge pharmacologique. Une étude en cours examine les effets du timing, de l'intensité et de la durée d'un programme de revalidation cardiaque en cas d'HFpEF (NCT02078947).
étant donné que l'administration de NO organique, dans l'espoir de stimuler la cascade sGC-GMPc-PKG, est souvent associée à une accoutumance50 ou à une hypotension symptomatique,51 on recherche des alternatives et des dérivés de celles-ci. L'administration aiguë de nitrites inorganiques a entraîné une nette diminution de la pression capillaire pulmonaire et du débit cardiaque lors des tests à l'effort lors desquels on effectuait simultanément des mesures hémodynamiques invasives, mais il va de soi que de plus amples études sont nécessaires pour évaluer les effets d'un traitement chronique.52 D'autres produits visant en fin de compte à augmenter la concentration de GMPc sont actuellement à l'étude. Le vericiguat, qui stimule la sGC, est actuellement testé dans une étude de phase II en cas d'HFpEF.53 Le LCZ696 inhibe la dégradation des peptides natriurétiques qui, via un autre récepteur, la guanylate cyclase particulaire (pGC), stimulent la synthèse de GMPc, et est actuellement évalué dans une étude multicentrique (NCT01920711). étant donné que les concentrations de GMPc dans le myocarde sont faibles et que cette voie alternative compense dès lors en soi insuffisamment l'échec de la voie NO-sGC, la stimulation du récepteur pGC peut s'avérer judicieuse. Par ailleurs, après que bon nombre d'études se sont ciblées sur les inhibiteurs de la PDE5, on a également démontré récemment l'expression de PDE9 dans le coeur humain, laquelle expression était en l'occurrence augmentée en cas d'HFpEF.54 En ce qui concerne l'aspect translationnel de cette étude, il est apparu que, dans des modèles animaux, la PDE9 agit surtout sur le GMPc synthétisé via les peptides natriurétiques et que l'inhibition de la PDE9 offrait une protection contre les neurohormones et les surcharges de pression.54 Les nouvelles connaissances physiopathologiques sont une source de cibles thérapeutiques qui seront dès lors étudiées en détail7 mais, pour le moment, les recommandations thérapeutiques se limitent toujours à la diminution de la congestion et au traitement des comorbidités.
Conclusion
Ces dernières années, la recherche translationnelle en cas d'HFpEF a permis de se faire une idée plus claire de la physiopathologie, dans laquelle les comorbidités métaboliques induisent une inflammation et un stress oxydatif de l'endothélium des microvaisseaux, avec secondairement une diminution de la disponibilité du NO. étant donné que les patients souffrant d'HFpEF constituent toujours un groupe très hétérogène et que bon nombre de patients ne sont pas identifiés, une nouvelle approche hémodynamique invasive semble utile pour identifier correctement les patients et, à l'avenir, les biomarqueurs permettront probablement une stadification des patients. De cette manière, de nouveaux médicaments agissant sur la cascade NO-sGC-GMPc-PKG pourront être testés chez les patients adéquats, et nous espérons que cela débouchera sur des traitements evidence-based de l'HFpEF.
Références
- Gerber, Y., Weston, S.A, Redfield, M.M., Chamberlain, A.M., Manemann, S.M., Jiang, R. et al. A Contemporary Appraisal of the Heart Failure Epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med, 2015, 175, 996-1004.
- McMurray, J.J.V., Adamopoulos, S,. Anker, S.D., Auricchio, A., Böhm, M., Dickstein, K. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J, 2012, 33, 1787-1847.
- Owan, T.E., Hodge, D.O., Herges, R.M., Jacobsen, S.J., Roger, V.L., Redfield, M.M. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med, 2006, 355, 251-259.
- Paulus, W.J., van Ballegoij, J.J.M. Treatment of heart failure with normal ejection fraction: an inconvenient truth! J Am Coll Cardiol, 2010, 55, 526-537.
- Redfield, M.M. Understanding “diastolic” heart failure. N Engl J Med, 2004, 350, 1930-1931.
- Paulus, W.J., Tschöpe, C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol, 2013, 62, 263-271.
- Franssen, C., Chen, S., Hamdani, N., Paulus, W.J. From comorbidities to heart failure with preserved ejection fraction: a story of oxidative stress. Heart, Published Online First: 16 December 2015, doi:10.1136/ heartjnl- 2015-307787.
- Borlaug, B.A.. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol, 2014, 11, 507-515.
- Aurigemma, G.P., Zile, M.R., Gaasch, W.H. Contractile behavior of the left ventricle in diastolic heart failure: with emphasis on regional systolic function. Circulation, 2006, 113, 296-304.
- Steinberg, B.A., Zhao, X., Heidenreich, P.A., Peterson, E.D., Bhatt D.L., Cannon C.P. et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation, 2012, 126, 65-75.
- Lam, C.S.P., Roger, V.L., Rodeheffer, R.J., Bursi, F., Borlaug, B.A., Ommen, S.R. et al. Cardiac structure and ventricular-vascular function in persons with heart failure and preserved ejection fraction from Olmsted County, Minnesota. Circulation, 2007, 115, 1982-1990.
- Ather, S., Chan, W,. Bozkurt, B., Aguilar, D., Ramasubbu, K., Zachariah, A.A. et al. Impact of noncardiac comorbidities on morbidity and mortality in a predominantly male population with heart failure and preserved versus reduced ejection fraction. J Am Coll Cardiol, 2012, 59, 998-1005.
- Franssen, C., Chen, S., Unger, A., Korkmaz, H.I., De Keulenaer, G.W., Tschöpe, C. et al. Myocardial Microvascular Inflammatory Endothelial Activation in Heart Failure With Preserved Ejection Fraction. JCHF, 2015, doi:10.1016/j.jchf.2015.10.007.
- Hamdani, N., Franssen, C., Lourenço, A., Falcão-Pires, I., Fontoura, D., Leite, S. et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circ Heart Fail, 2013, 6, 1239-1249.
- Westermann, D., Lindner, D., Kasner, M., Zietsch, C., Savvatis, K., Escher, F. et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction. Circ Heart Fail, 2011, 4, 44-52.
- Mohammed, S.F., Hussain, S., Mirzoyev, S.A., Edwards, W.D., Maleszewski, J.J., Redfield, M.M. Coronary Microvascular Rarefaction and Myocardial Fibrosis in Heart Failure With Preserved Ejection Fraction. Circulation, 2014, 131, 550-559.
- Borbély, A., van der Velden, J., Papp, Z., Bronzwaer, J.G.F., Edes, I., Stienen, G.J.M., et al. Cardiomyocyte stiffness in diastolic heart failure. Circulation, 2005, 111, 774-781.
- Linke, W.A., Hamdani, N. Gigantic business: titin properties and function through thick and thin. Circ Res, 2014, 114, 1052-1068.
- van Heerebeek, L., Borbély, A., Niessen, H.W.M., Bronzwaer, J.G.F., van der Velden, J., Stienen, G.J.M. et al. Myocardial structure and function differ in systolic and diastolic heart failure. Circulation, 2006, 113, 1966-1973.
- van Heerebeek, L., Hamdani, N., Falcão-Pires, I., Leite- Moreira, A.F., Begieneman, M.P. V., Bronzwaer, J.G.F. et al. Low myocardial protein kinase g activity in heart failure with preserved ejection fraction. Circulation, 2012, 126, 830-839.
- Zile, M.R., Baicu, C.F., Ikonomidis, J., Stroud, R.E., Nietert, P.J., Bradshaw, A.D. et al. Myocardial Stiffness in Patients with Heart Failure and a Preserved Ejection Fraction: Contributions of Collagen and Titin. Circulation, 2015, 131, 1247-1259.
- Carnicer, R., Crabtree, M.J., Sivakumaran, V., Casadei, B., Kass, D.A. Nitric oxide synthases in heart failure. Antioxid Redox Signal, 2013, 18, 1078-1099.
- Zhang, M., Shah, A.M. ROS signalling between endothelial cells and cardiac cells. Cardiovasc Res, 2014, 102, 249-257.
- Zahradníková, A., Minarovic, I., Venema, R.C., Meszaros, L. Inactivation of the cardiac ryanodine receptor calcium release channel by nitric oxide. Cell Calcium, 1997, 22, 447-453.
- Maltsev, A.V., Kokoz, Y.M., Evdokimovskii, E.V., Pimenov, O.Y., Reyes, S., Alekseev, A.E. Alpha-2 adrenoceptors and imidazoline receptors in cardiomyocytes mediate counterbalancing effect of agmatine on NO synthesis and intracellular calcium handling. J Mol Cell Cardiol, 2014, 68, 66-74.
- Paulus, W.J., Tschöpe, C., Sanderson, J.E., Rusconi, C., Flachskampf, F.A., Rademakers, F.E. et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J, 2007, 28, 2539-2550.
- Anjan, V.Y., Loftus, T.M., Burke, M.A., Akhter, N., Fonarow, G.C., Gheorghiade, M. et al. Prevalence, Clinical Phenotype, and Outcomes Associated With Normal BType Natriuretic Peptide Levels in Heart Failure With Preserved Ejection Fraction. Am J Cardiol, 2012, 110, 870-876.
- Dorfs, S., Zeh, W., Hochholzer, W., Jander, N., Kienzle, R.-P., Pieske, B. et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J, 2014, 35, 3103-3112.
- Borlaug, B.A., Nishimura, R.A., Sorajja, P., Lam, C.S.P., Redfield, M.M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circ Heart Fail, 2010, 3, 588-595.
- Borlaug, B.A. Exercise haemodynamics and outcome in patients with dyspnoea. Eur Heart J, 2014, 35, 3085-3087.
- Fujimoto, N., Borlaug, B.A., Lewis, G.D., Hastings, J.L., Shafer, K.M., Bhella, P.S., et al. Hemodynamic responses to rapid saline loading: the impact of age, sex, and heart failure. Circulation, 2013, 127, 55-62.
- Maor, E., Grossman, Y., Balmor, R.G., Segel, M., Fefer, P., Ben-Zekry, S. et al. Exercise haemodynamics may unmask the diagnosis of diastolic dysfunction among patients with pulmonary hypertension. Eur J Heart Fail, 2015, 17, 151-158.
- Franssen, C., Paulus, W.J. Normal resting pulmonary artery wedge pressure: a diagnostic trap for heart failure with preserved ejection fraction. Eur J Heart Fail, 2015, 17, 132-134.
- López, B., González, A., Ravassa, S., Beaumont, J., Moreno, M.U., San José, G. et al. Circulating Biomarkers of Myocardial Fibrosis. J Am Coll Cardiol, 2015, 65, 2449-2456.
- Massie, B.M., Nelson, J.J., Lukas, M.A., Greenberg, B., Fowler, M.B., Gilbert, E.M. et al. Comparison of outcomes and usefulness of carvedilol across a spectrum of left ventricular ejection fractions in patients with heart failure in clinical practice. Am J Cardiol, 2007, 99, 1263-1268.
- Cleland, J.G.F., Tendera, M., Adamus, J., Freemantle, N., Polonski, L., Taylor, J. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J, 2006, 27, 2338-2345.
- Yusuf, S., Pfeffer, M.A., Swedberg, K., Granger, C.B., Held, P., McMurray, J.J.V. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet, 2003, 362, 777-781.
- Ahmed, A., Rich, M.W., Fleg, J.L., Zile, M.R., Young, J.B., Kitzman, D.W., et al. Effects of digoxin on morbidity and mortality in diastolic heart failure: the ancillary digitalis investigation group trial. Circulation, 2006, 114, 397-403.
- Redfield, M.M., Chen, H.H., Borlaug, B.A., Semigran, M.J., Lee, K.L., Lewis, G. et al. Effect of phosphodiesterase- 5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA, 2013, 309, 1268-1277.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341, 709-17.
- Pitt, B., Remme, W., Zannad, F., Neaton, J., Martinez, F., Roniker, B. et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med, 2003, 348, 1309-1321
- Zannad, F., McMurray, J.J.V., Krum, H., van Veldhuisen, D.J., Swedberg, K., Shi, H. et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med, 2011, 364, 11-21.
- Borlaug, B.A., Paulus, W.J. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment. Eur Heart J, 2011, 32, 670-679.
- Weber, K.T. Aldosterone in congestive heart failure. N Engl J Med, 2001, 345, 1689-1697.
- Edelmann, F., Tomaschitz, A., Wachter, R., Gelbrich, G., Knoke, M., Düngen, H-D. et al. Serum aldosterone and its relationship to left ventricular structure and geometry in patients with preserved left ventricular ejection fraction. Eur Heart J, 2012, 33, 203-212.
- Edelmann, F., Wachter, R., Schmidt, A.G., Kraigher- Krainer, E., Colantonio, C., Kamke, W., et al. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo-DHF randomized controlled trial. JAMA, 2013, 309, 781-791.
- Pitt, B., Pfeffer, M.A., Assmann, S.F., Boineau, R., Anand, I.S., Claggett, B. et al. Spironolactone for Heart Failure with Preserved Ejection Fraction. N Engl J Med, 2014, 370, 1383-1392.
- Pfeffer, M.A., Claggett, B., Assmann, S.F., Boineau, R., Anand, I.S., Clausell, N. et al. Regional Variation in Patients and Outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) Trial. Circulation, 2015, 131, 24-43.
- Valezi, A.C., Machado, V.H.S. Morphofunctional evaluation of the heart of obese patients before and after bariatric surgery. Obes Surg, 2011, 21, 1693-1697.
- Münzel, T., Daiber, A., Gori T. Nitrate therapy: new aspects concerning molecular action and tolerance. Circulation, 2011, 123, 2132-2144.
- Schwartzenberg, S., Redfield, M.M., From, A.M., Sorajja, P., Nishimura, R.A., Borlaug, B.A. Effects of vasodilation in heart failure with preserved or reduced ejection fraction implications of distinct pathophysiologies on response to therapy. J Am Coll Cardiol, 2012, 59, 442-451.
- Borlaug, B.A., Koepp, K.E., Melenovsky, V. Sodium Nitrite Improves Exercise Hemodynamics and Ventricular Performance in Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol, 2015, 66, 1672-1682.
- Pieske, B., Butler, J., Filippatos, G., Lam, C.S.P., Maggioni A.P., Ponikowski P., et al. Rationale and design of the SOluble guanylate Cyclase stimulatoR in heArT failurE Studies (SOCRATES). Eur J Heart Fail, 2014, 16, 1026-1038.
- Lee, D.I., Zhu, G., Sasaki, T., Cho, G.-S., Hamdani, N., Holewinski, R., et al. Phosphodiesterase 9A controls nitric-oxide-independent cGMP and hypertrophic heart disease. Nature, 2015, 519, 472-476.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.