Introductie
De laatste decennia is de incidentie van hartfalen afgenomen door grote progressie in de preventie, behandeling en prognose van patiënten met hartfalen en verminderde ejectiefractie (HFrEF).1 Er is inderdaad een zeer uitgebreid spectrum aan evidencebased behandelingen voor HFrEF ter beschikking met de huidige richtlijnen van de Europese Vereniging voor Cardiologie (ESC).2 De incidentie van patiënten met hartfalen en een bewaarde ejectiefractie (HFpEF) is echter in dezelfde periode toegenomen en tegenwoordig heeft minstens 50 % van alle patiënten die voor hartfalen gehospitaliseerd worden een bewaarde ejectiefractie.3 Helaas zijn de behandelingsmogelijkheden voor HFpEF vooralsnog teleurstellend (figuur 1) en beperken de ESC-richtlijnen zich tot een symptomatische behandeling gericht op het verminderen van congestie en de controle van comorbiditeiten.2
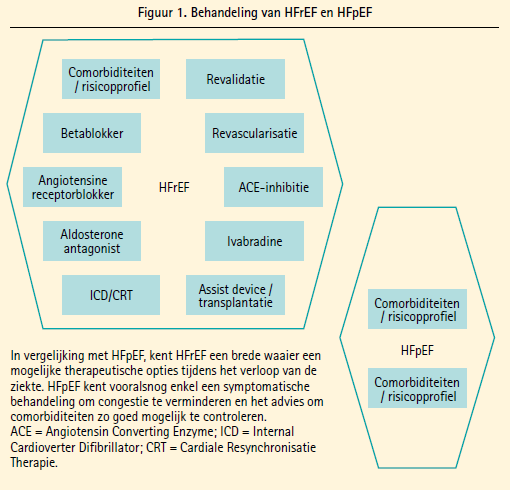
Het gebrek aan adequate behandelingsopties voor HFpEF-patiënten kan aan twee belangrijke factoren toegeschreven worden. Allereerst kampte een groot deel van de vroegere studies met methodologische problemen en werden zeer diverse groepen patiënten bestudeerd.4 Een groter probleem is echter dat men iets meer dan 10 jaar geleden nauwelijks kennis had van de pathofysiologie van HFpEF5 en dat dit pas de laatste jaren geleidelijk aan het verbeteren is.6, 7
Deze review bespreekt de huidige kennis omtrent de pathofysiologie van HFpEF, gevolgd door nieuwe ontwikkelingen op het gebied van de diagnostiek en een besluit met mogelijke toekomstige therapeutische opties.
Pathofysiologie
De afgelopen jaren is de kennis van de pathofysiologie van HFpEF toegenomen door wetenschappelijk onderzoek. Een zeer uitgebreid overzicht van de pathofysiologie werd onlangs in een fraai overzichtsartikel besproken.8 Deze review zal zich beperken tot de huidige kennis van myocardiale afwijkingen in de linker ventrikel (LV) bij HFpEF. Karakteristiek voor HFpEF en de basis voor de symptomatologie is een toegenomen stijfheid van het myocard, leidend tot LV diastolische disfunctie, wat het beste omschreven kan worden als het onvermogen van het hart om tot een adequaat einddiastolisch volume te vullen zonder al te grote toename van de drukken in het hart en dit zonder endocardiale of pericardiale ziekte.9 De toegenomen stijfheid die wordt waargenomen in het HFpEF-myocard berust op een complex samenspel tussen de extracellulaire matrix en de cardiomyocyten. Alvorens deze interactie in meer detail te bespreken, is het nuttig om te bekijken wat HFpEF lijkt te veroorzaken.
Microvasculaire inflammatie door metabole comorbiditeiten: de oorzaak van HFpEF?
In tegenstelling tot in de meeste gevallen van HFrEF, is de oorzaak van HFpEF lang onduidelijk geweest. Een patiënt ontwikkelt bijvoorbeeld HFrEF na een uitgebreid myocardinfarct, cardiotoxische chemotherapie of ten gevolge van atriumfibrillatie met snel ventrikelantwoord. Bij HFpEF is het nagenoeg onmogelijk om één welbepaalde oorzaak aan te duiden, maar recente epidemiologische studies tonen aan dat met name de prevalentie van comorbiditeiten zeer hoog is in deze populatie.
Ondanks het feit dat veel studies buikomtrek of het aantal patiënten met overgewicht (body mass index (BMI) 25-30 kg/m2) niet rapporteren, blijkt een derde van alle patiënten obees te zijn in een zeer grote registry (BMI ≥ 30 kg/m2).10 Verder bleek in dezelfde registry 46 % van alle HFpEF-patiënten diabetes mellitus te hebben. Ook de prevalentie van arteriële hypertensie is zeer hoog in HFpEF, variërend van 76 tot zelfs 96 %.10, 11 Ook COPD en chronische nierinsufficiëntie zijn veelvoorkomend in HFpEF met prevalenties van respectievelijk 33 % en 52 %.10 Uiteraard hebben veel patiënten meer dan één van deze comorbiditeiten en het aantal comorbiditeiten blijkt bovendien van prognostisch belang te zijn.12 De grote overeenkomst tussen deze metabole comorbiditeiten is het feit dat zij in staat zijn om een chronische, steriele, laaggradige inflammatoire status te creëren die bovendien gepaard gaat met oxidatieve stress. Deze bevindingen hebben geleid tot een nieuw paradigma voor de pathofysiologie van HFpEF.6
Inflammatie en oxidatieve stress in HFpEF
In het nieuwe paradigma voor de pathofysiologie van HFpEF staan metabole comorbiditeiten centraal, aangezien zij in staat zijn een chronische inflammatoire status met oxidatieve stress te creëren die onder andere het endotheel van de coronaire microvasculatuur treft.6 Inderdaad werd onlangs in het myocard van HFpEF-patiënten een verhoogde expressie van de vasculaire adhesiemoleculen E-selectin en Intercellular adhesion molecule (ICAM)-1 aangetoond in vergelijking met HFrEF en patiënten met aortaklepstenose (AS), wijzend op microvasculaire inflammatie in HFpEF (figuur 2). Ook de concentratie waterstofperoxide (H2O2) bleek significant hoger te zijn in HFpEF-myocard dan in HFrEF of myocardweefsel van patiënten met aortaklepstenose, wijzend op oxidatieve stress.13
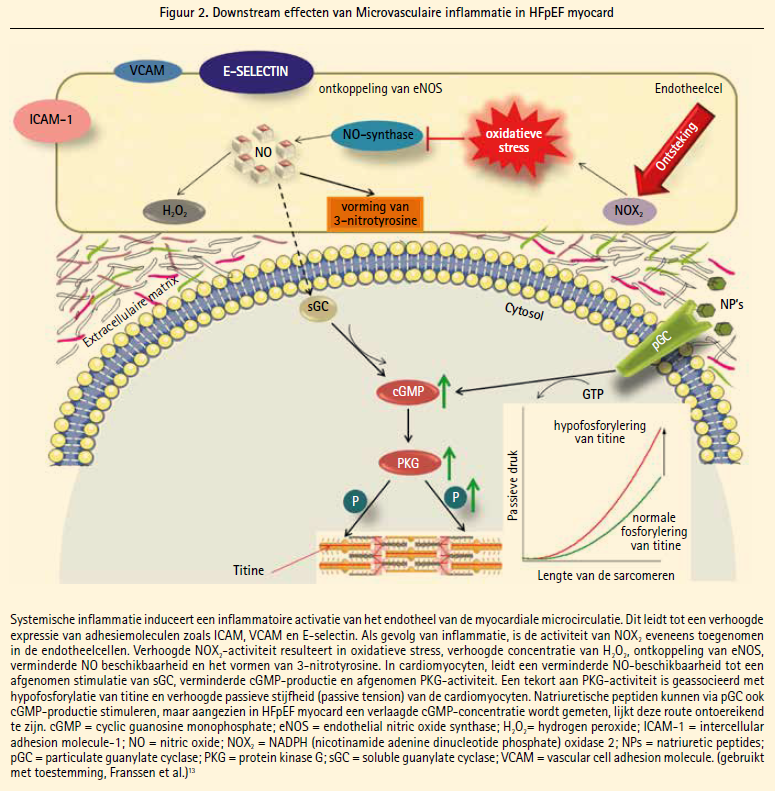
Deze humane bevindingen werden bevestigd in een recent ontwikkeld ratmodel voor HFpEF.13 Dit ratmodel maakt gebruik van obese ZSF-1-ratten: een kruising tussen Zucker diabetic fatty- en Spontaneously hypertensive heart failure-ratten. Deze kruising leidt tot ratten die bij geboorte hypertensief zijn, maar door hun leptineresistentie geen verzadigingsgevoel kennen en daardoor obesitas en vervolgens diabetes mellitus ontwikkelen. Cardiaal ontwikkelen zij een duidelijk beeld van HFpEF met concentrische LV-hypertrofie, bewaarde systolische functie, verhoogde vullingsdrukken en pulmonaire congestie.14 Het feit dat alleen de obese ratten met diabetes mellitus het HFpEF-fenotype ontwikkelen en hypertensieve controleratten een normale cardiale functie behouden, pleit sterk voor het belang van de metabole comorbiditeiten in de HFpEF-pathofysiologie.14 In deze obese ZSF-1-ratten bleek er duidelijk meer expressie te zijn van E-selectin en ICAM-1, maar ook van CD68 en myeloperoxidase, markers voor monocyten/macrofagen en hun geactiveerde toestand.13 Ook de vascular cell adhesion molecule bleek voorheen al een verhoogde expressie in HFpEF te hebben.15 Behalve inflammatoire markers bleek ook de concentratie van H2O2 in de obese ZSF-1-ratten hoger dan in de controles.
Een van de belangrijke enzymen die myocardiale oxidatieve stress kan genereren, is nicotinamide adenine dinucleotide phosphate (NADPH) oxidase-2 (NOX2) (figuur 2). Dit enzym bleek eveneens verhoogd te zijn in het myocard van HFpEF-patiënten en obese ZSF- 1-ratten, maar deze verhoogde expressie bleek vooral gelokaliseerd ter hoogte van het microvasculair endotheel en macrofagen, terwijl er geen toename was in NOX2-expressie van de cardiomyocyten.13 In een recente postmortemstudie werd bovendien aangetoond dat HFpEFmyocard gekenmerkt wordt door een lagere densiteit aan capillairen ('capillary rarefaction').16 Deze bevindingen suggereren dat de pathofysiologie van HFpEF zich primair in het endotheel afspeelt en van hieruit de cardiomyocytaire en myocardiale functie beïnvloedt en niet zozeer een primair cardiomyocytair probleem is. De effecten van deze microvasculaire endotheliale inflammatie en oxidatieve stress op het functioneren van de cardiomyocyten worden verder besproken.
Verhoogde myocardiale stijfheid in HFpEF
Belangrijke kennis omtrent de basis van de verhoogde myocardiale stijfheid in HFpEF werd verkregen door experimenten op HFpEF-biopten.17 Uit deze endomyocardiale biopten werden cardiomyocyten geïsoleerd en deze werden onder een microscoop bevestigd tussen een krachtopnemer en een lengtemotor. Dit maakt het mogelijk om de passieve kracht (Fpassive) te meten die gegenereerd wordt wanneer deze cardiomyocyten uitgerekt worden. Deze Fpassive bleek duidelijk hoger te zijn dan bij controlebiopten. Bovendien correleerden Fpassive en de mate van fibrose (collagen volume fraction, CVF) met de invasief gemeten parameters voor diastolische functie in de patiënten.17 Belangrijk was verder de observatie dat toediening van proteïne kinase A (PKA) de stijfheid van de cardiomyocyten kon normaliseren en dit vermoedelijk door een hypofosforylatie van het enorme cardiomyocytaire eiwit titine te corrigeren17 (figuur 2). Titine is het grootste eiwit in het menselijk lichaam en geeft enerzijds steun aan de contractiele filamenten (actine en myosine) en houdt deze op hun plaats, maar anderzijds bepaalt titine de stijfheid van de cardiomyocyt.18 Vervolgstudies hebben aangetoond dat titine in humane HFpEF-biopten, maar ook in de obese ZSF-1-ratten inderdaad gehypofosforyleerd is en dit leidde tot stijvere cardiomyocyten, wat gecorrigeerd kon worden met PKA of PKG.14, 19, 20 Verder bleken cardiomyocyten van HFpEF-biopten groter en stijver te zijn dan HFrEF-cardiomyocyten en dit onafhankelijk van de CVF, wat suggereert dat de cardiomyocyten/ titine in de myocardiale stijfheid misschien wel een belangrijkere rol speelt dan fibrose van de extracellulaire matrix.19 Daarenboven bleken de obese ZSF-1-ratten een duidelijk HFpEF-fenotype te hebben zonder veranderingen in het collageenmetabolisme.14
Aangezien dit voor de pathofysiologie van groot belang is, zijn de relatieve bijdragen van cardiomyocyten en fibrose in HFpEF dan ook recentelijk verder onderzocht in fijne myocardiale spierstrips. Deze spierstrips worden eveneens bevestigd tussen een krachtopnemer en een lengtemotor, maar het verschil met de enkele cardiomyocyten is dat de gemeten Fpassive bij het oprekken nu zowel door de cardiomyocyten als door de extracellulaire matrix gegenereerd wordt. Door aan deze strips een oplossing van KI en KCl toe te dienen, worden alle cardiomyocytaire eiwitten ontkoppeld, maar blijft de extracellulaire matrix intact. Door de strips nadien opnieuw op te rekken, kan de bijdrage van de extracellulaire matrix aan Fpassive berekend worden. Experimenten in de obese ZSF-1-ratten toonden aan dat de extracellulaire matrix pas bij (vermoedelijk) suprafysiologische uitrekking van de spierstrip een rol begon te spelen.14 Een recente studie waarbij biopten genomen werden van HFpEF-patiënten tijdens CABG, toonde inderdaad aan dat de extracellulaire matrix pas bij belangrijke uitrekking van de spierstrip een significante bijdrage krijgt in de myocardiale stijfheid.21 Mogelijke verklaringen voor deze bevindingen zijn dat de extracellulaire matrix in de stijfheid louter een rol heeft in de bescherming tegen overrekking van het myocard, maar ook dat fibrose van het myocard pas in een vergevorderd stadium van HFpEF optreedt. Immers, in tegenstelling tot HFrEF, waar fibrose afgestorven cardiomyocyten vervangt ('replacement fibrosis'), is de fibrose in HFpEF reactionair en vervangt deze geen cardiomyocyten, zodat dit mogelijk pas in een later stadium van de ziekte een belangrijkere rol speelt.6
De relatie tussen comorbiditeiten, inflammatie, oxidatieve stress en myocardiale stijfheid
Zoals hierboven besproken, kent HFpEF een hoge prevalentie van metabole comorbiditeiten die inflammatie en oxidatieve stress kunnen induceren en wordt het HFpEF-myocard gekenmerkt door voornamelijk toegenomen cardiomyocytaire stijfheid. Het endotheel van de microvasculatuur en de aldaar geproduceerde stikstofoxide (NO) vormen de ontbrekende schakel tussen deze bevindingen (figuur 2). Inflammatie en oxidatieve stress leiden in het endotheel tot een disfunctie van eNOS (endothelial nitric oxide synthase). eNOS is het enzym dat NO produceert en het functioneert in gezond endotheel als een dimeer, maar in geval van een overmaat aan vrije zuurstofradicalen kan eNOS 'ontkoppelen' in monomeren die geen NO maar superoxide produceren.22 Superoxide is een zeer reactieve vrije zuurstofradicaal dat niet alleen tot verdere disfunctie van eNOS leidt, maar bovendien met het aanwezige NO een reactie aangaat en zo peroxynitriet vormt. Peroxynitriet is op zijn beurt een zeer reactief nitraatderivaat dat directe toxische effecten op eiwitstructuren heeft ('nitrosylatie') en kan bijvoorbeeld 3-nitrotyrosine vormen23 (figuur 2). Het gevolg van deze reacties is een verminderde NO-beschikbaarheid in het HFpEF-myocard en deze cascade aan events werd recentelijk ook bevestigd in humane experimenten en in het obese ZSF-1-ratmodel.13
NO speelt een belangrijke rol in de functie van cardiomyocyten. In de eerste plaats reguleert NO mede de contractiliteit van de cardiomyocyt via de activiteit van de ryanodinereceptoren, via dewelke de influx van Ca2+ vanuit het sarcoplasmatisch reticulum naar het cytosol verloopt.24 Daarnaast moduleert NO de eerste, actieve fase van de diastole via controle over de activiteit van de sarcoplasmatisch reticulum Ca2+-ATP-ase (SERCA) en dus de heropname van Ca2+ vanuit het cytosol.25 Ook de passieve relaxatie tijdens de diastole wordt sterk beïnvloedt door NO via downstreameffecten op cyclisch guanosine monofosfaat (cGMP) en uiteindelijk PKGactiviteit. NO kan in de cardiomyocyt soluble guanylate cyclase (sGC) stimuleren tot cGMP-productie, wat op zijn beurt PKG-activiteit verhoogt (figuur 2). Bij verminderde NO-beschikbaarheid kan deze NO-sGC-cGMP-PKG-cascade dan ook in het gedrang komen. Vroegere studies konden inderdaad al aantonen dat er in humane HFpEF-biopten een verlaagde cGMP-concentratie en PKGactiviteit was, wat weer geassocieerd was met stijvere cardiomyocyten.20 Ook recente experimenten in het obese ZSF- 1-ratmodel konden verminderde NObeschikbaarheid, gedaalde cGMP-concentraties en verminderde PKG-activiteit aantonen.13 Deze bevindingen bevestigen het HFpEF-paradigma waarin metabole comorbiteiten door inflammatie en oxidatieve stress leiden tot een NO-tekort met als gevolg een verminderde PKG-activiteit met uiteindelijk titine-hypofosforylatie en toegenomen myocardiale stijfheid.6
Diagnostische ontwikkelingen
Een eerste diagnostisch algoritme van HFpEF werd in 2007 opgesteld en in de klinische praktijk wordt met name van de echocardiografische criteria gebruikgemaakt, eventueel aangevuld met bepaling van natriuretische peptiden.26 Echter, normale natriuretische peptiden sluiten HFpEF niet uit.27 Een belangrijk nadeel van deze richtlijnen is het feit dat deze metingen in rust en vaak zelfs in nuchtere toestand plaatsvinden, al dan niet tijdens een ziekenhuisopname met vochten zoutbeperking. Veel patiënten zijn in rust klachtenvrij en worden slechts symptomatisch tijdens het verrichten van een (beperkte) inspanning. Inderdaad is bij recente invasieve studies gebleken dat lichte inspanningen (zoals deze in het dagelijks leven verricht worden) leiden tot een belangrijke stijging van de einddiastolisch LV-drukken en symptomen kunnen uitlokken.28-30 Ook blijken HFpEF-patiënten zeer gevoelig te zijn voor relatief kleine veranderingen in vullingstoestand, zodat nuchtere meetwaarden in het ziekenhuis vaak geen betrouwbaar beeld geven van de ambulante situatie. 31 Deze bevindingen suggereren dat veel HFpEF-patiënten gemist worden in de momenteel gangbare diagnostische uitwerking. Daarnaast is onlangs aangetoond dat in symptomatische patiënten met onverklaarde pulmonale hypertensie, normale LV-ejectiefractie en een lage wiggedruk in rust een milde inspanning tijdens de katheterisatie de vullingsdrukken snel liet oplopen en een diagnose van diastolische disfunctie gesteld kon worden.32 Deze bevindingen suggereren een toekomstige rol voor inspanningstesten in de diagnose van HFpEF.33
Daarnaast is er een grote ontwikkeling op het gebied van biomarkers, die met name gebaseerd zijn op de collageendepositie (fibrose) in de extracellulaire matrix. Van alle mogelijke biomarkers is alleen van PICP (het carboxy-terminal propeptide van procollageen 1) en PIIINP (het amino-terminal propeptide van procollageen III) bewezen dat deze geassocieerd zijn met myocardiale fibrose.34
Mogelijk schuilt de toepassing van deze biomarkers en andere diagnostische ontwikkelingen vooral in het feit dat zij kunnen helpen HFpEF-patiënten te graderen in functie van het stadium van de ziekte. Mogelijk bestaat de initiële fase van HFpEF vooral uit veranderingen in titine, maar wordt in een later stadium de myocardiale fibrose belangrijker en het lijkt dan ook evident dat beide fasen een verschillende behandeling vragen.
Therapeutische ontwikkelingen
Tot op heden hadden alle studies in HFpEF hooguit neutrale resultaten. Dit was, zoals al vermeld, vooral te wijten aan het tekort aan kennis omtrent de pathofysiologie van HFpEF. Nu het duidelijk is geworden dat HFpEF een heel andere pathofysiologie heeft dan HFrEF, is het bijna vanzelfsprekend dat we niet kunnen veronderstellen dat een HFrEFbehandeling succesvol is in HFpEF. Inderdaad bleek inmiddels dat de klassieke HFrEF-behandeling met bètablokkers, ACE-inhibitoren, angiotensinereceptorblokkers en digoxine niet tot een betere overleving of gunstige effecten op ziekteprogressie in HFpEF leiden.35-38
Recentere studies, ook afgeleid van de HFrEF-behandelingsopties leken met het oog op de pathofysiologie beloftevoller. Sildenafil is een gekende inhibitor van fosfodi-esterase (PDE) 5, het enzym dat cGMP afbreekt. Remming van cGMP-afbraak zou dan ook tot een stijging van cGMP-concentratie en PKG-activiteit in de cardiomyocyt kunnen leiden. Deze hypothese werd in de RELAX-trial getest, maar chronische behandeling met sildenafil leidde niet tot een betere inspanningscapaciteit of klinische status, maar had ook geen significante hemodynamische verbetering en bovendien zag men geen stijging in cGMP-concentratie.39 Enerzijds kunnen deze teleurstellende resultaten van sildenafil verklaard worden door het vergevorderde stadium van de patiënten (onder andere hoge prevalentie van atriumfibrillatie), maar ook door het feit dat de aanmaak van cGMP via verminderde NO-beschikbaarheid verlaagd is, maar niet zozeer doordat de afbraak van cGMP is toegenomen in HFpEF.
Verder werd ook in HFpEF de indicatie van aldosteronantagonisten bekeken, aangezien deze in HFrEF de totale en cardiovasculaire mortaliteit doen verminderen.40-42 Aldosteron staat in verband met endotheliale inflammatie en disfunctie, natriumretentie, fibrose en (concentrische) LV-hypertrofie43-45 en daarom lijken aldosteronantagonisten beloftevol in HFpEF. In één studie (ALDO-DHF) werd echter slechts een lichte echocardiografische verbetering geobserveerd zonder verbeterde inspanningscapaciteit.46 Een andere studie (TOPCAT) werd helaas verstoord door belangrijke regionale verschillen (Noord- en Zuid-Amerikaanse landen versus Oost-Europese landen) met zeer verschillende patiëntengroepen, waarbij men vooral in de Amerikaanse landen (met ziekere mensen) een afname van overlijden en hartfalenhospitalisaties waarnam.47, 48 Dit toont aan dat een goede selectie/stadiëring van patiënten essentieel is.
De huidige kennis van de pathofysiologie wijst er zoals gezegd op dat het aanpakken van de NO-sGC-cGMP-PKG-cascade myocardiale stijfheid kan verminderen (figuur 2). Idealiter wordt, net zoals men bij HFrEF probeert, de oorzaak van het hartfalen behandeld. Bij HFpEF zou men dan ook de bron van de inflammatie en oxidatieve stress aanpakken. In het geval van obesitas, bijvoorbeeld, is wel aangetoond dat gewichtsverlies gunstige effecten op het hart en de diastolische functie heeft,49 maar er is nog geen wetenschappelijk bewijs dat dit HFpEF daadwerkelijk geneest. Bovendien is het algemeen geweten dat levensstijlverandering als primair therapeutisch aangrijpingspunt niet altijd haalbaar is en daarom vindt veel onderzoek naar een farmacologische aanpak plaats. Een lopende studie onderzoekt wel de effecten van timing, intensiteit en duur van een cardiaal revalidatieprogramma in HFpEF (NCT02078947).
Aangezien bij toediening van organisch NO, in de hoop zo sGC-cGMP-PKG te stimuleren, vaak gewenning50 optreedt of symptomatische hypotensie,51 wordt gezocht naar alternatieven en afgeleiden hiervan. Acute toediening van inorganische nitriet leidde tot een duidelijke afname van de wiggedruk en cardiac output tijdens inspanningstesten waarbij gelijktijdig invasieve hemodynamicametingen werden verricht, maar uiteraard zijn verdere studies nodig om de effecten van een chronische behandeling te onderzoeken.52 Ook andere producten die uiteindelijk de cGMPconcentratie proberen te verhogen zijn in onderzoek. De sGC-stimulator vericiguat wordt momenteel in een fase II-studie getest in HFpEF.53 LCZ696 remt de afbraak van natriuretische peptides die via een andere receptor, particulate guanylate cyclase (pGC) de aanmaak van cGMP stimuleren en wordt momenteel in een multicenter studie onderzocht (NCT01920711). Aangezien cGMP-concentraties in het myocard laag zijn en deze alternatieve route dan ook op zich onvoldoende compenseert voor het falen van de NO-sGC-route, kan stimulatie van de pGC-receptor zinvol zijn. Verder is, nadat veel onderzoek zich richtte op PDE5-inhibitoren, onlangs ook PDE9-expressie in het menselijke hart aangetoond en deze expressie was met name in HFpEF verhoogd.54 In het translationele aspect van deze studie bleek dat in diermodellen PDE9 vooral ingrijpt op cGMP dat via natriuretische peptiden wordt aangemaakt en PDE9-inhibitie bood bescherming tegen neurohormonen en drukoverbelasting.54 De nieuwe kennis van de pathofysiologie is een bron aan therapeutische aangrijpingspunten die dan ook uitgebreid bestudeerd worden,7 maar voorlopig blijven de behandeladviezen nog altijd beperkt tot het verminderen van congestie en het behandelen van de comorbiditeiten.
Conclusie
Translationeel onderzoek in HFpEF heeft de laatste jaren geleid tot een duidelijker beeld van de pathofysiologie, waarbij metabole comorbiditeiten inflammatie en oxidatieve stress van het microvasculair endotheel induceren met secundair een verminderde NO-beschikbaarheid. Aangezien HFpEF-patiënten nog altijd een zeer heterogene groep zijn en veel patiënten miskend worden, lijkt een nieuwe invasief hemodynamische aanpak bruikbaar om patiënten correct te identificeren en kunnen in de toekomst biomarkers patiënten waarschijnlijk stadiëren. Op deze manier kunnen nieuwere farmaca die aangrijpen op de NO-sGC-cGMP-PKG-cascade bij de juiste patiënten getest worden, hopelijk leidend tot evidencebased behandelingen in HFpEF.
Referenties
- Gerber, Y., Weston, S.A, Redfield, M.M., Chamberlain, A.M., Manemann, S.M., Jiang, R. et al. A Contemporary Appraisal of the Heart Failure Epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med, 2015, 175, 996-1004.
- McMurray, J.J.V., Adamopoulos, S,. Anker, S.D., Auricchio, A., Böhm, M., Dickstein, K. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J, 2012, 33, 1787-1847.
- Owan, T.E., Hodge, D.O., Herges, R.M., Jacobsen, S.J., Roger, V.L., Redfield, M.M. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med, 2006, 355, 251-259.
- Paulus, W.J., van Ballegoij, J.J.M. Treatment of heart failure with normal ejection fraction: an inconvenient truth! J Am Coll Cardiol, 2010, 55, 526-537.
- Redfield, M.M. Understanding “diastolic” heart failure. N Engl J Med, 2004, 350, 1930-1931.
- Paulus, W.J., Tschöpe, C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol, 2013, 62, 263-271.
- Franssen, C., Chen, S., Hamdani, N., Paulus, W.J. From comorbidities to heart failure with preserved ejection fraction: a story of oxidative stress. Heart, Published Online First: 16 December 2015, doi:10.1136/ heartjnl- 2015-307787.
- Borlaug, B.A.. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol, 2014, 11, 507-515.
- Aurigemma, G.P., Zile, M.R., Gaasch, W.H. Contractile behavior of the left ventricle in diastolic heart failure: with emphasis on regional systolic function. Circulation, 2006, 113, 296-304.
- Steinberg, B.A., Zhao, X., Heidenreich, P.A., Peterson, E.D., Bhatt D.L., Cannon C.P. et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation, 2012, 126, 65-75.
- Lam, C.S.P., Roger, V.L., Rodeheffer, R.J., Bursi, F., Borlaug, B.A., Ommen, S.R. et al. Cardiac structure and ventricular-vascular function in persons with heart failure and preserved ejection fraction from Olmsted County, Minnesota. Circulation, 2007, 115, 1982-1990.
- Ather, S., Chan, W,. Bozkurt, B., Aguilar, D., Ramasubbu, K., Zachariah, A.A. et al. Impact of noncardiac comorbidities on morbidity and mortality in a predominantly male population with heart failure and preserved versus reduced ejection fraction. J Am Coll Cardiol, 2012, 59, 998-1005.
- Franssen, C., Chen, S., Unger, A., Korkmaz, H.I., De Keulenaer, G.W., Tschöpe, C. et al. Myocardial Microvascular Inflammatory Endothelial Activation in Heart Failure With Preserved Ejection Fraction. JCHF, 2015, doi:10.1016/j.jchf.2015.10.007.
- Hamdani, N., Franssen, C., Lourenço, A., Falcão-Pires, I., Fontoura, D., Leite, S. et al. Myocardial titin hypophosphorylation importantly contributes to heart failure with preserved ejection fraction in a rat metabolic risk model. Circ Heart Fail, 2013, 6, 1239-1249.
- Westermann, D., Lindner, D., Kasner, M., Zietsch, C., Savvatis, K., Escher, F. et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction. Circ Heart Fail, 2011, 4, 44-52.
- Mohammed, S.F., Hussain, S., Mirzoyev, S.A., Edwards, W.D., Maleszewski, J.J., Redfield, M.M. Coronary Microvascular Rarefaction and Myocardial Fibrosis in Heart Failure With Preserved Ejection Fraction. Circulation, 2014, 131, 550-559.
- Borbély, A., van der Velden, J., Papp, Z., Bronzwaer, J.G.F., Edes, I., Stienen, G.J.M., et al. Cardiomyocyte stiffness in diastolic heart failure. Circulation, 2005, 111, 774-781.
- Linke, W.A., Hamdani, N. Gigantic business: titin properties and function through thick and thin. Circ Res, 2014, 114, 1052-1068.
- van Heerebeek, L., Borbély, A., Niessen, H.W.M., Bronzwaer, J.G.F., van der Velden, J., Stienen, G.J.M. et al. Myocardial structure and function differ in systolic and diastolic heart failure. Circulation, 2006, 113, 1966-1973.
- van Heerebeek, L., Hamdani, N., Falcão-Pires, I., Leite- Moreira, A.F., Begieneman, M.P. V., Bronzwaer, J.G.F. et al. Low myocardial protein kinase g activity in heart failure with preserved ejection fraction. Circulation, 2012, 126, 830-839.
- Zile, M.R., Baicu, C.F., Ikonomidis, J., Stroud, R.E., Nietert, P.J., Bradshaw, A.D. et al. Myocardial Stiffness in Patients with Heart Failure and a Preserved Ejection Fraction: Contributions of Collagen and Titin. Circulation, 2015, 131, 1247-1259.
- Carnicer, R., Crabtree, M.J., Sivakumaran, V., Casadei, B., Kass, D.A. Nitric oxide synthases in heart failure. Antioxid Redox Signal, 2013, 18, 1078-1099.
- Zhang, M., Shah, A.M. ROS signalling between endothelial cells and cardiac cells. Cardiovasc Res, 2014, 102, 249-257.
- Zahradníková, A., Minarovic, I., Venema, R.C., Meszaros, L. Inactivation of the cardiac ryanodine receptor calcium release channel by nitric oxide. Cell Calcium, 1997, 22, 447-453.
- Maltsev, A.V., Kokoz, Y.M., Evdokimovskii, E.V., Pimenov, O.Y., Reyes, S., Alekseev, A.E. Alpha-2 adrenoceptors and imidazoline receptors in cardiomyocytes mediate counterbalancing effect of agmatine on NO synthesis and intracellular calcium handling. J Mol Cell Cardiol, 2014, 68, 66-74.
- Paulus, W.J., Tschöpe, C., Sanderson, J.E., Rusconi, C., Flachskampf, F.A., Rademakers, F.E. et al. How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J, 2007, 28, 2539-2550.
- Anjan, V.Y., Loftus, T.M., Burke, M.A., Akhter, N., Fonarow, G.C., Gheorghiade, M. et al. Prevalence, Clinical Phenotype, and Outcomes Associated With Normal BType Natriuretic Peptide Levels in Heart Failure With Preserved Ejection Fraction. Am J Cardiol, 2012, 110, 870-876.
- Dorfs, S., Zeh, W., Hochholzer, W., Jander, N., Kienzle, R.-P., Pieske, B. et al. Pulmonary capillary wedge pressure during exercise and long-term mortality in patients with suspected heart failure with preserved ejection fraction. Eur Heart J, 2014, 35, 3103-3112.
- Borlaug, B.A., Nishimura, R.A., Sorajja, P., Lam, C.S.P., Redfield, M.M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction. Circ Heart Fail, 2010, 3, 588-595.
- Borlaug, B.A. Exercise haemodynamics and outcome in patients with dyspnoea. Eur Heart J, 2014, 35, 3085-3087.
- Fujimoto, N., Borlaug, B.A., Lewis, G.D., Hastings, J.L., Shafer, K.M., Bhella, P.S., et al. Hemodynamic responses to rapid saline loading: the impact of age, sex, and heart failure. Circulation, 2013, 127, 55-62.
- Maor, E., Grossman, Y., Balmor, R.G., Segel, M., Fefer, P., Ben-Zekry, S. et al. Exercise haemodynamics may unmask the diagnosis of diastolic dysfunction among patients with pulmonary hypertension. Eur J Heart Fail, 2015, 17, 151-158.
- Franssen, C., Paulus, W.J. Normal resting pulmonary artery wedge pressure: a diagnostic trap for heart failure with preserved ejection fraction. Eur J Heart Fail, 2015, 17, 132-134.
- López, B., González, A., Ravassa, S., Beaumont, J., Moreno, M.U., San José, G. et al. Circulating Biomarkers of Myocardial Fibrosis. J Am Coll Cardiol, 2015, 65, 2449-2456.
- Massie, B.M., Nelson, J.J., Lukas, M.A., Greenberg, B., Fowler, M.B., Gilbert, E.M. et al. Comparison of outcomes and usefulness of carvedilol across a spectrum of left ventricular ejection fractions in patients with heart failure in clinical practice. Am J Cardiol, 2007, 99, 1263-1268.
- Cleland, J.G.F., Tendera, M., Adamus, J., Freemantle, N., Polonski, L., Taylor, J. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J, 2006, 27, 2338-2345.
- Yusuf, S., Pfeffer, M.A., Swedberg, K., Granger, C.B., Held, P., McMurray, J.J.V. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet, 2003, 362, 777-781.
- Ahmed, A., Rich, M.W., Fleg, J.L., Zile, M.R., Young, J.B., Kitzman, D.W., et al. Effects of digoxin on morbidity and mortality in diastolic heart failure: the ancillary digitalis investigation group trial. Circulation, 2006, 114, 397-403.
- Redfield, M.M., Chen, H.H., Borlaug, B.A., Semigran, M.J., Lee, K.L., Lewis, G. et al. Effect of phosphodiesterase- 5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA, 2013, 309, 1268-1277.
- Pitt, B., Zannad, F., Remme, W.J., Cody, R., Castaigne, A., Perez, A. et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med, 1999, 341, 709-17.
- Pitt, B., Remme, W., Zannad, F., Neaton, J., Martinez, F., Roniker, B. et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med, 2003, 348, 1309-1321
- Zannad, F., McMurray, J.J.V., Krum, H., van Veldhuisen, D.J., Swedberg, K., Shi, H. et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med, 2011, 364, 11-21.
- Borlaug, B.A., Paulus, W.J. Heart failure with preserved ejection fraction: pathophysiology, diagnosis, and treatment. Eur Heart J, 2011, 32, 670-679.
- Weber, K.T. Aldosterone in congestive heart failure. N Engl J Med, 2001, 345, 1689-1697.
- Edelmann, F., Tomaschitz, A., Wachter, R., Gelbrich, G., Knoke, M., Düngen, H-D. et al. Serum aldosterone and its relationship to left ventricular structure and geometry in patients with preserved left ventricular ejection fraction. Eur Heart J, 2012, 33, 203-212.
- Edelmann, F., Wachter, R., Schmidt, A.G., Kraigher- Krainer, E., Colantonio, C., Kamke, W., et al. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo-DHF randomized controlled trial. JAMA, 2013, 309, 781-791.
- Pitt, B., Pfeffer, M.A., Assmann, S.F., Boineau, R., Anand, I.S., Claggett, B. et al. Spironolactone for Heart Failure with Preserved Ejection Fraction. N Engl J Med, 2014, 370, 1383-1392.
- Pfeffer, M.A., Claggett, B., Assmann, S.F., Boineau, R., Anand, I.S., Clausell, N. et al. Regional Variation in Patients and Outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) Trial. Circulation, 2015, 131, 24-43.
- Valezi, A.C., Machado, V.H.S. Morphofunctional evaluation of the heart of obese patients before and after bariatric surgery. Obes Surg, 2011, 21, 1693-1697.
- Münzel, T., Daiber, A., Gori T. Nitrate therapy: new aspects concerning molecular action and tolerance. Circulation, 2011, 123, 2132-2144.
- Schwartzenberg, S., Redfield, M.M., From, A.M., Sorajja, P., Nishimura, R.A., Borlaug, B.A. Effects of vasodilation in heart failure with preserved or reduced ejection fraction implications of distinct pathophysiologies on response to therapy. J Am Coll Cardiol, 2012, 59, 442-451.
- Borlaug, B.A., Koepp, K.E., Melenovsky, V. Sodium Nitrite Improves Exercise Hemodynamics and Ventricular Performance in Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol, 2015, 66, 1672-1682.
- Pieske, B., Butler, J., Filippatos, G., Lam, C.S.P., Maggioni A.P., Ponikowski P., et al. Rationale and design of the SOluble guanylate Cyclase stimulatoR in heArT failurE Studies (SOCRATES). Eur J Heart Fail, 2014, 16, 1026-1038.
- Lee, D.I., Zhu, G., Sasaki, T., Cho, G.-S., Hamdani, N., Holewinski, R., et al. Phosphodiesterase 9A controls nitric-oxide-independent cGMP and hypertrophic heart disease. Nature, 2015, 519, 472-476.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.