L'hôpital de campagne marocain au camp Zaatari, établi à la frontière syrojordanienne, accueille depuis sa création en 2012 plus de 500 000 réfugiés. Les nourrissons et enfants arrivent en tête des prestations médicales, largement dominés par la pathologie infectieuse propre à l'enfant réfugié, mais souvent quelques pathologies rares attirent l'attention des 2 pédiatres présents sur place qui, malgré les difficultés liées aux moyens et aux flux importants de patients, essaient de gérer au mieux ces conditions spéciales. Nous rapportons le cas d'un enfant de 4 ans installé au camp depuis 1 an, suivi auparavant en Syrie pour surdité bilatérale non étiquetée et qui présentait depuis environ 2 ans et demi des syncopes avec malaises lipothymiques, la famille ayant déjà perdu un enfant à l'âge de 5 ans dans un tableau d'arrêt cardiorespiratoire brutal. L'ECG réalisé à l'hôpital marocain révélait un allongement de l'espace QT à 600 ms avec un coeur d'architecture normal à l'échocardiographie. Rare mais engageant, le pronostic vital de l'enfant s'il reste méconnu, le syndrome de Jervell et Lange-Nielsen (SJLN) est une maladie à transmission autosomique récessive. Deux gènes sont actuellement identifiés: KCNQ1 ou KCNE1, gènes majoritairement exprimés dans la strie vasculaire et à l'origine de la surdité de perception. La prise en charge a pour but de prévenir la syncope, l'arrêt cardiaque et la mort subite.
Introduction
Le syndrome de Jervell et Lange-Nielsen (SJLN) associe une surdité bilatérale congénitale avec un allongement de l'espace QT de l'électrocardiogramme supérieure à 500 ms. Cet allongement de l'espace QT est responsable de tachycardie ventriculaire, de torsades de pointe et de fibrillation ventriculaire se traduisant cliniquement par des syncopes survenant lors d'un stress (typiquement, syncope lors des pleurs ou des jeux) qui peuvent conduire à des morts subites.1 Du fait de la transmission autosomique récessive, la présence d'antécédents familiaux n'est pas classique mais devant la possible gravité de ce syndrome, il est légitime de rechercher à l'interrogatoire la présence de malaises ou de morts subites dans la famille.
Observation
Nous rapportons le cas d'un garçon âgé de 4 ans, de parents consanguins au 2ème degré. On ne retrouve pas d'histoire de surdité ou mort subite dans la famille des 2 parents. L'interrogatoire a révélé néanmoins le décès d'une soeur aînée en Syrie à l'âge de 2 ans et demi dans un tableau de mort subite au cours d'un jeu habituel à effort modéré. L'enquête familiale à cette date a mis en évidence une surdité chez le frère vivant mais les circonstances politiques de guerre et de déplacement n'ont pas permis d'étayer le diagnostic. L'enfant s'est présenté à la consultation pédiatrique de l'hôpital marocain 1 an après avoir quitté son pays d'origine pour la notion de malaise répétés à l'occasion d' efforts divers ainsi que pour sa surdité et absence de parole. Devant ce tableau très évocateur du SJLN un électrocardiogramme a été réalisé en première intention (figure 1) montrant un rythme sinusal régulier, des complexes QRS fins, un espace PR normal avec un QT corrigé à 600 ms, une repolarisation anormale avec onde T négative. Un complément échocardiographique réalisé par le cardiologue sur place était sans anomalies avec un coeur d'architecture normal et de bonne fonction systolique. L'examen O.R.L. retrouvait une surdité bilatérale sans anomalies otoscopiques. Le bilan biologique a objectivé une anémie hypochrome avec une kaliémie normale. L'enfant a été mis sous bêtabloquants dans l'attente de son évacuation en dehors du camp pour une éventuelle implantation cochléaire avec consultation génétique.
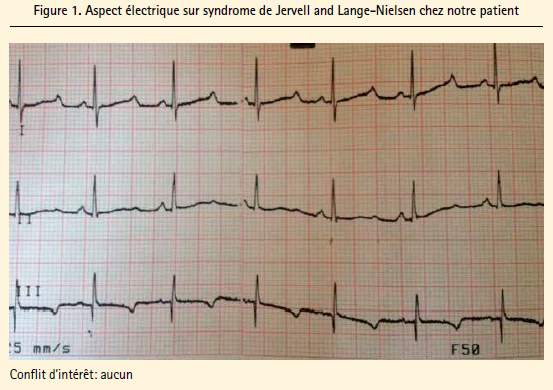
Commentaires
Le syndrome de JLN est une affection rare, mais au cours de laquelle le pronostic vital est engagé. Elle a été décrite pour la première fois en 1957 dans une publication par Anton Jervell.1 Malheureusement, le diagnostic de ce syndrome est souvent retardé, exposant les enfants au risque de mort subite par arythmie ou asystolie. Environ un enfant sur deux atteint de ce syndrome meure avant l'âge de 20 ans. Dans la littérature, on retrouve que 15 % des enfants deviennent symptomatiques avant l'âge de 23 mois. à partir de 18 ans, au moins 90 % des patients présentant un syndrome de JLN ont présenté un évènement cardiaque.2 Il est nécessaire de prescrire de façon systématique un ECG à tous les enfants présentant une surdité sévère à profonde non étiquetée, surtout si ces derniers doivent bénéficier d'une anesthésie générale.3
L'association d'allongement de l'intervalle QT avec des syncopes récurrentes et des accès de tachyarythmies ventriculaires malignes définit le syndrome du QT long. Le syndrome peut être familial, avec ou sans surdité congénitale ou idiopathique. L'association entre surdité et SJLN n'est pas à ce jour clairement élucidée. Neyround et al.4 ont retrouvé des gènes JLNS, et KVLQT1 sur le chromosome 11 qui jouent un rôle primordial dans la repolarisation ventriculaire ainsi que l'homéostasie de l'endolymphe. La surdité est profonde ou sévère, bilatérale, prédominante sur les fréquences aiguës, congénitales et isolées. Il n'existe pas d'anomalie vestibulaire.
Le SJLN se transmet sur le mode autosomique récessif. Dans le cas que nous rapportons au sein du camp de réfugiés, les parents sont cousins éloignés ce qui n'est pas rare dans les traits autosomiques récessifs. En Syrie, le mariage au sein de la même famille est interdit pour motif religieux, mais d'autres mariages consanguins comme entre oncle et nièce ou cousins lointains sont encouragés dans le cadre de coutumes locales. Une étude menée en Arabie saoudite5 a mis en évidence l'effet génétique néfaste élevée de la pratique des mariages arrangés au sein de la même famille, avec une fréquence estimée à 23 % des enfants atteints de désordres génétiques avec un premier cas du SJLN déclaré en 1996.6
L'origine génétique su SVJL a été confirmée avec six loci et cinq gènes identifiés actuellement. Les études génétiques récentes trouvent des mutations en rapport avec un syndrome du QT long dans 10 à 15 % des cas, sur des séries autopsiques de morts subites inexpliquées.7 Le diagnostic repose sur des explorations électrophysiologiques d'interprétation parfois délicate, mais également sur une enquête génétique exhaustive. Il permet une attitude préventive et thérapeutique bien codifiée en fonction du génotype.8 Depuis le premier gène découvert en 1997, 10 gènes et plus de 200 mutations ont été impliqués dans ce syndrome.9
Ces différentes connaissances génétiques et de biologie moléculaire ont permis, grâce à un traitement bêtabloquant à vie, de réduire la mortalité de 75 % à 5 % en 10 ans %, et elle est actuellement de 0,2 à 0,5 % par an.10
Leur mécanisme d'action implique une modulation de la réponse adrénergique. Ils induisent clairement une diminution des malaises même si leur influence sur la durée du QT reste négligeable. Dans le cas de notre petit réfugié, il a été mis en l'absence de contre-indications absolue sous nadolol avec vérification hebdomadaire de l'adhérence thérapeutique, permettant la diminution des malaises hebdomadaires de l'ordre de 50 % mais avec persistance de l'allongement du QT sur les ECG ultérieurs.
Cependant, la réponse aux bêtabloquants visant à limiter l'activation du système sympathique varie d'un patient à l'autre. En effet, l'étude de Villain a montré que les patients avec le (SJLN) ont continué à présenter des troubles du rythme majeurs (27 %) sous bêtabloquants, alors que 51 % sont restés symptomatiques.11 Ces mauvais résultats sont constatés quand les bêtabloquants sont associés à la sympathectomie cervicothoracique gauche (LCSD) ou à l'appareillage par un pacemaker pour prévenir une éventuelle bradycardie. La seule solution demeure donc le DAI (défibrillateur automatique implantable), seule capable de prévenir une mort subite. Mais il faut l'associer à une sympathectomie cervicothoracique gauche (LCSD) pour diminuer le nombre de chocs induits par le DAI (défibrillateur automatique implantable).
Conclusion
Le syndrome de Jervell et Lange-Nielsen est une maladie rare, mais grave. Le cas de notre enfant diagnostiqué en contexte humanitaire devant des syncopes répétées justifie la prescription de façon systématique d'un ECG à tous les enfants présentant une surdité sévère à profonde non étiquetée, associée à des événements cardiaques. Quand un SJLN est avéré, une prévention des facteurs de stress doit être faite et des précautions doivent être prises pendant un acte chirurgical. Le traitement par bêtabloquants a permis de diminuer nettement le risque de mortalité. Une prise en charge multidisciplinaire entre généticiens, physiologistes et cliniciens devrait permettre de mieux préciser la relation phénotype-génotype, et d'affiner les indications thérapeutiques. Le défibrillateur automatique implantable est la seule capable de prévenir la mort subite chez les patients à haut risque.
Références
- Jervell, A., Lange-Nielsen, F. Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval, and sudden death. Am Heart J, 1957, 54 (1), 59-68.
- Schwartz, P.J., Moss, A.J., Vincent GM, Crampton RS. Diagnostic criteria for the long QT syndrome. An update. Circulation, 1993, 88 (2), 782-784.
- Mayhew, J.F. Anaesthesia and undiagnosed Jervell and Lange-Nielsen syndrome (letter; comment). Anaesthesia, 1993, 48 (12), 1117-1118.
- Neyround, N., Tesson, F., Denjoy, I. A novel mutation in the potassium channel gene KVLQT1 causes the Jervell and Lange-Nielsen syndrome. Nat Genet, 1997, 15 (2), 186-189.
- Zakzouk, S., El-Sayed, Y. and Bafaqeeh, S. Consanguinity and hereditary hearing impairment among Saudi population. Ann Saudi Med, 1993, 13 (5), 447-450.
- Al Rakaf, M., Zakzoukb, S.M., Al Shahwan, S.A.. Jervell and Lange-Nielsen QT syndrome: a casereport from Saudi Arabia. Int J Pediatr Otorhinolaryngol, 1997, 39 (2), 163-168.
- Tester, D., Ackerman, M. Postmortem long QT syndrome genetic testing for sudden unexplained death in the young. J Am Coll Cardiol, 2007, 49 (2), 240-246.
- Jullien, C., Patural, H., Teyssier, G., Dacosta, A. [Ventricular repolarisation disorders and long QT syndrome: clinical and genetic study in 10 paediatric cases]. Arch Pediatr, 2008, 15 (4), 410-415.
- Gao, Y., Li, C., Liu, W., Wu, R., Qiu, X., Liang, R. et al. Genotype-phenotype analysis of three Chinese families with Jervell and Lange-Nielsen syndrome. J Cardiovasc Dis Res, 2012, 3, 67-75.
- Lupoglazoff, J., Denjoy, I., Guicheney, P., Casasoprana, A., Coumel, P. [Congenital long QT syndrome]. Arch Pediatr, 2001, 8 (5), 525-534.
- Villain, E., Denjoy, I., Lupoglazoff, J., Guicheney, P., Hainque, B., Lucet, V. et al. Low incidence of cardiac events with beta-blocking therapy in children with long QT syndrome. Eur Heart J, 2004, 25 (16), 1405-1411.
Aucun élément du site web ne peut être reproduit, modifié, diffusé, vendu, publié ou utilisé à des fins commerciales sans autorisation écrite préalable de l’éditeur. Il est également interdit de sauvegarder cette information par voie électronique ou de l’utiliser à des fins illégales.