ACCA Congress 2019 Malaga
Le congrès de l'ACCA (Acute Cardiovascular Care Association) à Malaga a fait la part belle à la défaillance cardiaque aiguë (AHF), le temps fort étant une session récapitulative lors de laquelle on a également abordé de prometteuses perspectives d'avenir. Comme toujours, les présentations Powerpoint y afférentes sont disponibles via le site de l'ESC 365.
La prise en charge initiale préhospitalière et au Service des urgences
O. Miro (Barcelone, Espagne)
La défaillance cardiaque aiguë (AHF) est définie comme l'apparition rapide ou l'aggravation aiguë des symptômes de l'insuffisance cardiaque. La prise en charge urgente de cette population de patients est décrite en détail dans un article de consensus de l'ESC, datant de 2015, qui propose un algorithme (figure 1).1 Parmi les patients qui se présentent aux Urgences en raison d'une AHF, environ 70-80 % sont hospitalisés et 20-30 % peuvent rentrer chez eux. En Europe, il existe de grandes différences dans les moyens de transport utilisés pour se rendre aux Urgences, au sein du groupe de patients atteints d'AHF. Ainsi, en Espagne, plus de la moitié des patients sont transportés en ambulance, tandis qu'en Finlande, 89 % d'entre eux se rendent à l'hôpital par leurs propres moyens. Le registre EAHFE (Epidemiology of Acute Heart Failure in the Emergency Departments) est actuellement la plus grande base de données européenne de patients atteints d'AHF, qui se présentent aux urgences. Il a inclus plus de 13 000 patients provenant de différents services d'urgence espagnols au cours de la période 2007-2016. Ceci a notamment montré que le pronostic de l'AHF ne s'est malheureusement pas amélioré au cours de cette période et que c'est vraisemblablement dû en partie au vieillissement de la population; en conséquence, les comorbidités dans cette population de patients augmentent également.2
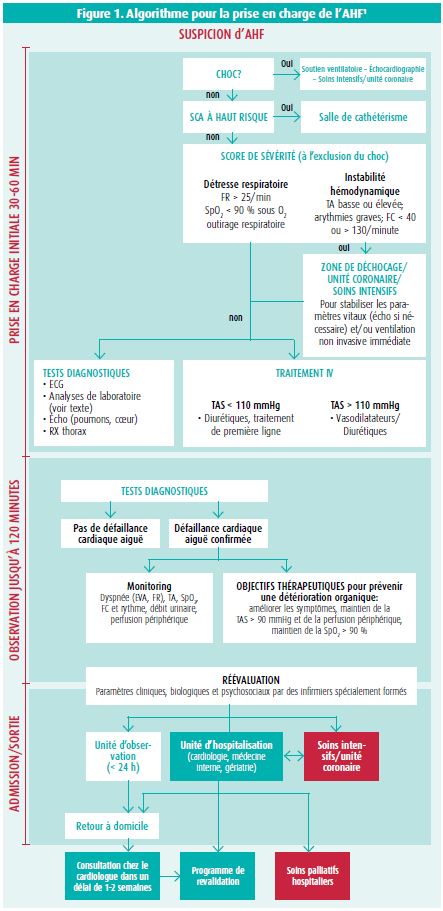
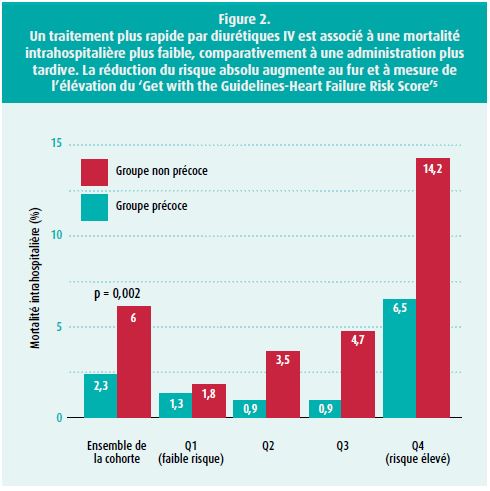
Dans les recommandations de 2016 de l'ESC, relatives à l'insuffisance cardiaque, les diurétiques IV sont une des seules interventions pharmacologiques à bénéficier d'une recommandation de classe Ib en cas d'AHF.3 Les recommandations pour l'utilisation des diurétiques n'ont pas changé depuis l'étude DOSE, pionnière, en 2011: il n'y a aucune différence symptomatique ou pronostique entre une administration continue ou en bolus.4 Par souci de facilité, on choisit donc habituellement l'administration en bolus au service des urgences. Par analogie avec les antibiotiques en cas de septicémie, le groupe de Matsue et al. a montré, en 2017, que l'administration plus rapide de diurétiques IV est associée à une mortalité intrahospitalière plus faible (figure 2).5 Cependant, cette affirmation n'a pas été confirmée par les recherches récentes de Park et al.6 De plus amples études sont donc nécessaires à ce sujet.
Selon les recommandations, les opiacés peuvent être envisagés chez les patients atteints d'AHF, pour réduire la dyspnée et l'anxiété (recommandation de classe IIb). Leurs effets hémodynamiques bénéfiques consistent essentiellement en une réduction de la précharge et, dans une moindre mesure, de la postcharge. Les effets négatifs potentiels sont de nature hémodynamique (hypotension), neurologique (réduction de la pulsion respiratoire) et gastro-intestinale (nausées). Les preuves disponibles, limitées, plaident donc plutôt contre l'utilisation d'opiacés dans cette indication.7
Les preuves sont également limitées en ce qui concerne l'utilisation de vasodilatateurs IV (nitrés) pour le contrôle des symptômes chez les patients souffrant d'AHF, ayant une tension artérielle systolique > 90 mmHg (recommandation de classe IIa). L'utilisation de ces produits a donc diminué au cours des dernières années.8
Malgré leur effet positif sur l'hémodynamique et la perfusion des organes cibles, les agents inotropes n'ont aucune place dans le traitement de routine de l'AHF, parce qu'ils n'ont jamais pu prouver d'influence positive sur le pronostic et qu'ils sont même associés à de moins bons résultats dans certaines études. Toutefois, on dispose d'opinions d'experts sur l'utilisation des agents inotropes dans certaines situations: en cas d'insuffisance cardiaque réfractaire, dans l'attente d'un soutien circulatoire mécanique ou d'une transplantation cardiaque; brièvement, chez les patients présentant un faible débit cardiaque et une dysfonction d'organes cibles (p. ex. pendant un traitement décongestionnant). Les vasopresseurs ne sont pas non plus utilisés systématiquement, parce qu'ils sont associés à de moins bons résultats. Selon les experts, ils peuvent être utilisés en cas de choc cardiogénique, aux doses les plus faibles possibles, et uniquement si l'hypotension est considérée comme réversible ou si un traitement définitif (soutien circulatoire mécanique ou transplantation cardiaque) est prévu.3
Heureusement, on dispose de preuves solides (recommandation de classe I) au sujet de la poursuite des médicaments modifiant la maladie pendant la décompensation, tant que le patient reste hémodynamiquement stable et qu'il n'y a aucune autre contre-indication. Gayat et al. ont montré une réduction de la mortalité après 90 jours et après 1 an, tant au sujet de la poursuite des bêtabloquants que des inhibiteurs de l'ECA/ sartans (l'effet pronostique positif n'a pas été démontré pour les antagonistes des récepteurs des minéralocorticoïdes).9
Au service des urgences, avant qu'on n'ait posé le moindre diagnostic, on administre souvent un traitement combiné pour traiter les plaintes de dyspnée (furosémide, bronchodilatateurs et corticostéroïdes). L'étude BRONCH-AF a montré que cette approche n'avait pas d'effets pronostiques négatifs. La seule exception concernait les patients à qui on avait administré des aérosols combinés (bêtamimétiques + anticholinergiques) avant que le diagnostic d'AHF n'ait été posé. Dans ce groupe, la durée d'hospitalisation était en moyenne plus longue.10
Afin d'améliorer l'évolution des patients atteints d'AHF, la prise en charge préhospitalière de ces patients peut constituer un paramètre important. L'orateur estime dès lors qu'il faut continuer à chercher de bons protocoles à ce sujet.
Le monitoring optimal des patients souffrant de défaillance cardiaque aiguë
S. Price (Londres, Grande-Bretagne)
Plusieurs raisons justifient le monitoring des patients en cardiologie: l'anticipation d'un collapsus cardiovasculaire imminent, le diagnostic différentiel d'une instabilité hémodynamique et l'évaluation de l'effet du traitement. Récemment, un article de synthèse sur le monitoring des patients atteints d'AHF a été publié dans le European Journal of Heart Failure.11 Lors de cet exposé, le Dr Price a expliqué quelques points importants. Il convient de noter que pratiquement toutes les recommandations sont basées sur l'opinion d'experts, sans beaucoup de preuves.
Le monitoring ecg est principalement utilisé pour le diagnostic de l'ischémie et d'arythmies. Dans des circonstances normales, la fréquence cardiaque est assez linéairement proportionnelle au débit cardiaque. Cependant, ce n'est pas le cas dans des conditions pathologiques. La durée de la systole est relativement stable quelle que soit la fréquence cardiaque, sauf en cas d'ischémie myocardique. Dès lors, en cas de tachycardie, la durée de la diastole diminue. La durée optimale de la diastole varie en fonction de la pathologie sous-jacente. Ainsi, les patients présentant une sténose de la valve mitrale ont besoin d'un temps de remplissage plus long. Toutefois, la durée de la diastole est moins importante si le ventricule est restrictif puisque, dans cette situation, la majeure partie du remplissage a lieu en début de diastole, en raison des pressions élevées dans l'oreillette gauche. La fréquence cardiaque optimale dépend donc de la pathologie sous-jacente.
L'orateur a attiré l'attention sur le risque de sous-diagnostic d'une ischémie silencieuse chez les patients en état critique (jusqu'à 21 % de la population). Il y a plusieurs explications à cela: la sédation et l'analgésie masquent le tableau clinique, les modifications à l'ecg surviennent tardivement dans la cascade ischémique et la surveillance du segment ST sur un ecg à 12 dérivations n'est pas très sensible. D'où l'importance des biomarqueurs et de l'échocardiographie dans le diagnostic de l'ischémie myocardique.
Au cours de la dernière décennie, on s'est de plus en plus intéressé à l'échographie pulmonaire comme outil diagnostique en cas de dyspnée. Un atelier pratique a dès lors été organisé pendant le congrès. Cette technique d'imagerie est basée sur l'évaluation des artefacts, des résultats échographiques spécifiques et de leur distribution à travers le thorax. L'échographie pulmonaire est principalement utilisable pour diagnostiquer/exclure un pneumothorax, un épanchement pleural et un oedème pulmonaire.12 Il existe en outre de plus en plus de preuves en faveur de l'utilisation de l'échographie pulmonaire avant que le patient ne quitte l'hôpital, car cette technique a également une valeur pronostique, en particulier parce qu'elle peut révéler une congestion résiduelle.13
En ce qui concerne le monitoring invasif du débit cardiaque, le cathéter de Swan-Ganz aux soins intensifs a beaucoup perdu en popularité ces dernières années. En 2013, Rajaram et al. ont publié la plus grande revue systématique à propos de cette population, soit 13 études cliniques randomisées ayant inclus en tout plus de 5 000 patients. Il en est ressorti que l'utilisation d'un cathéter de Swan-Ganz n'avait aucun effet sur la mortalité et qu'il n'entraînait pas d'économies.14 Toutefois, il faut souligner que la majorité de cette population d'étude se composait principalement de patients ayant subi une chirurgie majeure et d'un groupe hétérogène de patients en état critique. Néanmoins, les auteurs estiment que le cathéter de Swan-Ganz ne doit pas être totalement abandonné, et qu'il a encore une place pour le diagnostic différentiel en cas de choc complexe. D'autres études sont donc nécessaires pour déterminer les indications optimales du cathéter de Swan-Ganz chez les patients atteints d'AHF. Les recommandations disponibles restent vagues à ce sujet. La recommandation de 2016 de l'ESC relative à l'insuffisance cardiaque indique qu'un cathéter de Swan- Ganz peut être envisagé, mais elle ne dit rien au sujet des déterminants de ce processus décisionnel. Le Dr Price a conclu en ces termes: 'Aucun moniteur n'améliorera le pronostic d'un patient s'il n'est pas couplé à une intervention correcte.'
Physiopathologie et prise en charge de la détérioration de la fonction rénale en cas de défaillance cardiaque aiguë
H. Schaubroeck (Aalter, Belgique)
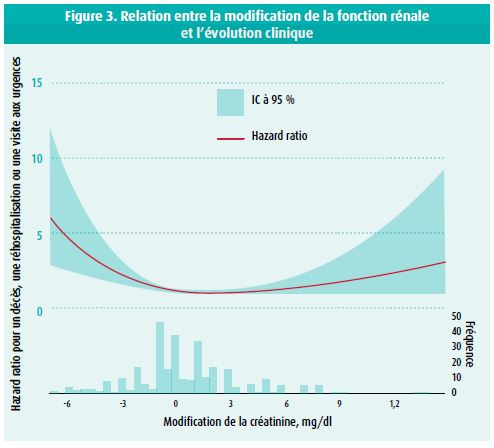
Dans la littérature cardiologique, le concept de détérioration de la fonction rénale (worsening renal function, WRF) est le plus souvent défini comme une élévation de la créatinine sérique d'au moins 0,3 mg/dl pendant le traitement de l'insuffisance cardiaque décompensée. Par le passé, on partait du principe que la WRF était toujours associée à un pronostic moins favorable.15 Cependant, des études plus récentes montrent que l'élévation de la créatinine sérique peut aussi être un marqueur de décongestion et que, dans ce contexte, elle signifie un meilleur pronostic (figure 3).16 Pour clarifier cette distinction, Damman et al. ont introduit le concept de pseudo-WRF pour les patients présentant une élévation de la créatinine et une amélioration clinique (basée sur les signes cliniques
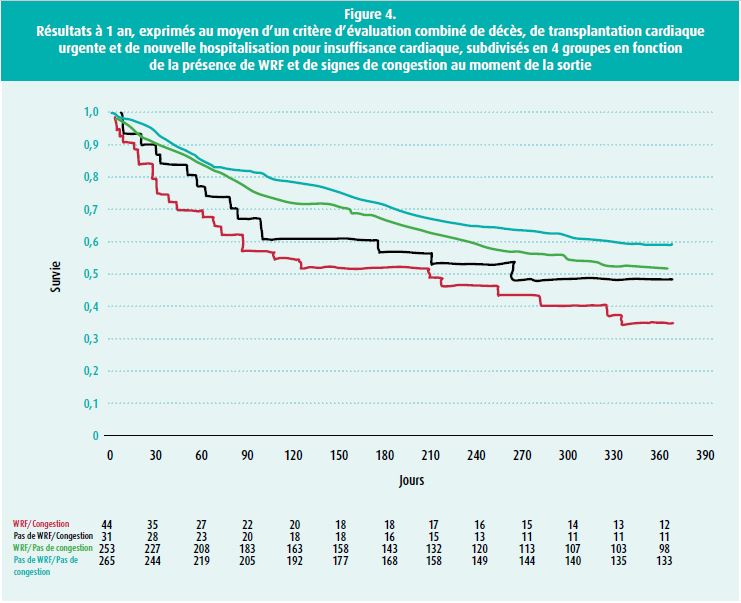
de congestion et le poids corporel, le débit urinaire, l'hématocrite, les peptides natriurétiques...). étant donné qu'une élévation de la créatinine sérique n'a de conséquences négatives sur le pronostic que chez les patients présentant une congestion persistante, il est capital de traiter adéquatement la congestion au moyen de diurétiques (figure 4).18 En cas de congestion importante d'un troisième secteur (épanchement pleural et ascite), il convient de drainer celui-ci, car le drainage a un effet plus rapide que les diurétiques. Clark et al. ont étudié l'effet pronostique de la WRF après le début de l'inhibition du SRAA (avec des inhibiteurs de l'ECA ou des sartans) au moyen d'une grande méta-analyse. Ils ont montré que l'effet bénéfique pronostique de l'inhibition du SRAA est encore plus puissant dans le groupe des patients présentant une WRF.19 Ceci est vraisemblablement lié au fait que la stimulation du SRAA est plus importante chez les patients présentant une diminution de la fonction rénale. Les recommandations préconisent donc d'accepter de petites élévations de la créatinine après le début de l'inhibition du SRAA (bien qu'aucune valeur seuil concrète ne soit proposée). Bien sûr, en cas de détérioration importante de la fonction rénale, il faut toujours être attentif à la possibilité d'une sténose bilatérale de l'artère rénale (ou d'une sténose unilatérale d'un rein unique).
Selon les recommandations, l'ultrafiltration (UF) peut être envisagée chez les patients présentant une congestion réfractaire au traitement par diurétiques (recommandation de classe IIb). En effet, rien ne prouve que l'utilisation de l'UF au lieu des diurétiques en traitement de première ligne donne de meilleurs résultats. L'étude UNLOAD a montré que, même si l'UF avait un effet bénéfique sur la réduction pondérale, comparativement aux diurétiques de l'anse, cela ne se traduisait pas par une différence sur le plan des symptômes dans les deux groupes. Dans le groupe UF, cependant, le taux de réhospitalisation était significativement plus faible.20 Dans l'étude CARRESS-HF, l'UF a été comparée à un traitement pharmacologique graduel chez des patients atteints d'un syndrome cardiorénal de type I. Le groupe UF présentait une détérioration plus importante de la fonction rénale et davantage d'effets indésirables (liés aux cathéters et aux anticoagulants).21 Dans l'étude décisive la plus récente, l'étude AVOID-HF, qui date de 2016, le groupe UF avait une tendance non statistiquement significative en faveur d'un délai plus long avant l'événement d'AHF suivant (défini comme une réhospitalisation ou la nécessité de diurétiques IV ambulatoires ou d'une ultrafiltration), comparativement au groupe diurétique. Au cours des 30 premiers jours, le taux d'hospitalisation était effectivement significativement plus faible, et la durée d'hospitalisation était plus courte dans le groupe UF. Bien que la mortalité dans les deux groupes ait été la même après 90 jours, le groupe UF a présenté davantage d'effets indésirables. Pour cette raison, l'étude a été arrêtée prématurément par le sponsor, ce qui signifie que les résultats doivent être interprétés avec une certaine prudence.22 L'étude PURE-HF est toujours en cours actuellement. Cette étude examinera si l'association d'une UF graduelle et de diurétiques à faible dose a un effet positif sur la mortalité à 90 jours chez les patients présentant une insuffisance cardiaque symptomatique, comparativement aux diurétiques à dose élevée.
On dénombre plusieurs indications absolues pour le traitement de substitution rénale (RRT), telles que l'acidémie, l'hyperkaliémie, l'hyperuricémie ou la résistance aux diurétiques. Il n'existe actuellement aucun consensus dans la littérature au sujet du moment idéal pour débuter la RRT. L'étude ELAIN est l'étude comptant le plus grand nombre de patients atteints d'AHF (40 % de la population totale de l'étude), et cette étude a montré une mortalité plus faible au bout de 90 jours, dans le groupe chez qui la RRT a débuté rapidement (à savoir dans les 8 heures suivant le diagnostic du stade KDIGO 2).23 Jusqu'à présent, les preuves sont insuffisantes quant à la meilleure modalité de RRT dans ce contexte. Une méta-analyse de Bagshaw n'a montré qu'une tendance à moins d'instabilité hémodynamique et d'arythmies dans le groupe ayant une RRT continue par rapport à une RRT intermittente.24 On a récemment démontré que l'instabilité hémodynamique peut être réduite en utilisant un dialysat ayant une teneur en sodium plus élevée et une température inférieure.25
Referenties
- Mebazaa, A., Yilmaz, M.B., Levy, P., Ponikowski, P., Peacock, W.F., Laribi, S. et al. Recommendations on pre-hospital & early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergency Medicine. Eur J Heart Fail, 2015, 17 (6), 544-58.
- Llorens, P., Javaloyes, P., Martin-Sanchez, F.J., Jacob, J., Herrero-Puente, P., Gil, V. et al. Time trends in characteristics, clinical course, and outcomes of 13,791 patients with acute heart failure. Clin Res Cardiol, 2018, 107 (10), 897-913.
- Ponikowski, P., Voors, A.A., Anker, S.D., Bueno, H., Cleland, J.G.F., Coats, A.J.S. et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure. Revista Espanol Cardiol, 2016, 69 (12), 1167.
- Felker, G.M., Lee, K.L., Bull, D.A., Redfield, M.M., Stevenson, L.W., Goldsmith, S.R. et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med, 2011, 364 (9), 797-805.
- Matsue, Y., Damman, K., Voors, A.A., Kagiyama, N., Yamaguchi, T., Kuroda, S. et al. Time-to-Furosemide Treatment and Mortality in Patients Hospitalized With Acute Heart Failure. J Am Coll Cardiol, 2017, 69 (25), 3042-3051.
- Park, J.J., Kim, S.H., Oh, I.Y., Choi, D.J., Park, H.A., Cho, H.J., et al. The Effect of Door-to-Diuretic Time on Clinical Outcomes in Patients With Acute Heart Failure. JACC Heart Fail, 2018, 6 (4), 286-294.
- Iakobishvili, Z., Cohen, E., Garty, M., Behar, S., Shotan, A., Sandach, A., et al. Use of intravenous morphine for acute decompensated heart failure in patients with and without acute coronary syndromes. Acute Cardiac Care, 2011, 13 (2), 76-80.
- Wakai, A., McCabe, A., Kidney, R., Brooks, S.C., Seupaul, R.A., Diercks, D.B. et al. Nitrates for acute heart failure syndromes. Cochrane Database Syst Rev, 2013, 6 (8): CD005151. PubMed PMID: 23922186.
- Gayat, E., Arrigo, M., Littnerova, S., Sato, N., Parenica, J., Ishihara, S. et al. Heart failure oral therapies at discharge are associated with better outcome in acute heart failure: a propensity-score matched study. Eur J Heart Fail, 2018, 20 (2), 345-354.
- Miro, O., Tost, J., Gil, V., Martin-Sanchez, F.J., Llorens, P., Herrero, P. et al. The BRONCH-AHF study: effects on short-term outcome of nebulized bronchodilators in emergency department patients diagnosed with acute heart failure. Eur J Heart Fail, 2018, 20 (4), 822-826.
- Harjola, V.P., Parissis, J., Brunner-La Rocca, H.P., Celutkiene, J., Chioncel, O., Collins, S.P. et al. Comprehensive in-hospital monitoring in acute heart failure: applications for clinical practice and future directions for research. A statement from the Acute Heart Failure Committee of the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur J Heart Fail, 2018, 20 (7), 1081-1099.
- Lancellotti, P., Price, S., Edvardsen, T., Cosyns, B., Neskovic, A.N., Dulgheru, R. et al. The use of echocardiography in acute cardiovascular care: recommendations of the European Association of Cardiovascular Imaging and the Acute Cardiovascular Care Association. Eur Heart J Acute Cardiovasc Care, 2015, 4 (1), 3-5.
- Gargani, L. Lung ultrasound: a new tool for the cardiologist. Cardiovasc Ultrasound, 2011, 9 (6), PubMed PMID: 21352576. Pubmed Central PMCID: 3059291.
- Rajaram, S.S., Desai, N.K., Kalra, A., Gajera, M., Cavanaugh, S.K., Brampton, W. et al. Pulmonary artery catheters for adult patients in intensive care. Cochrane Database Syst Rev, 2013, 2: CD003408. PubMed PMID: 23450539.
- Vandenberghe, W., Gevaert, S., Kellum, J.A., Bagshaw, S.M., Peperstraete, H., Herck, I. et al. Acute Kidney Injury in Cardiorenal Syndrome Type 1 Patients: A Systematic Review and Meta-Analysis. Cardiorenal Med, 2016, 6 (2), 116-128.
- Brisco, M.A., Zile, M.R., Hanberg, J.S., Wilson, F.P., Parikh, C.R., Coca, S.G. et al. Relevance of Changes in Serum Creatinine During a Heart Failure Trial of Decongestive Strategies: Insights From the DOSE Trial. J Cardiac Fail, 2016, 22 (10), 753-760.
- Damman, K., Tang, W.H., Testani, J.M., McMurray, J.J. Terminology and definition of changes renal function in heart failure. Eur Heart J, 2014, 35 (48), 3413-3416.
- Metra, M., Davison, B., Bettari, L., Sun, H., Edwards, C., Lazzarini, V. et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circulation Heart Fail, 2012, 5 (1), 54-62.
- Clark, H., Krum, H., Hopper, I. Worsening renal function during renin-angiotensin-aldosterone system inhibitor initiation and long-term outcomes in patients with left ventricular systolic dysfunction. Eur J Heart Fail, 2014, 16 (1), 41-48.
- Mentz, R.J., Kjeldsen, K., Rossi, G.P., Voors, A.A., Cleland, J.G., Anker, S.D. et al. Decongestion in acute heart failure. Eur J Heart Fail, 2014, 16 (5), 471-482.
- Bart, B.A., Goldsmith, S.R., Lee, K.L., Givertz, M.M., O'Connor, C.M., Bull, D.A. et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med, 2012, 367 (24), 2296-2304.
- Costanzo, M.R., Negoianu, D., Jaski, B.E., Bart, B.A., Heywood, J.T., Anand, I.S. et al. Aquapheresis Versus Intravenous Diuretics and Hospitalizations for Heart Failure. JACC Heart Fail, 2016, 4 (2), 95-105.
- Zarbock, A., Kellum, J.A., Schmidt, C., Van Aken, H., Wempe, C., Pavenstadt, H., et al. Effect of Early vs Delayed Initiation of Renal Replacement Therapy on Mortality in Critically Ill Patients With Acute Kidney Injury: The ELAIN Randomized Clinical Trial. JAMA, 2016, 315 (20), 2190-2199.
- Bagshaw, S.M., Berthiaume, L.R., Delaney, A., Bellomo, R. Continuous versus intermittent renal replacement therapy for critically ill patients with acute kidney injury: a meta-analysis. Critic Care Med, 2008, 36 (2), 610-617.
- Douvris, A., Malhi, G., Hiremath, S., McIntyre, L., Silver, S.A., Bagshaw, S.M. et al. Interventions to prevent hemodynamic instability during renal replacement therapy in critically ill patients: a systematic review. Critic Care, 2018, 22 (1), 41.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.