Le pronostic des patients souffrant d'insuffisance mitrale secondaire est mauvais, d'une part à cause de l'insuffisance cardiaque sousjacente, d'autre part à cause de la sévérité de l'insuffisance mitrale. Depuis la publication de l'étude COAPT (Cardiovascular Outcomes Assessment of the MitraClip Percutaneous Therapy for Heart Failure Patients With Functional Mitral Regurgitation), le traitement percutané de l'insuffisance mitrale offre une nouvelle perspective à ces patients. Toutefois, il est capital de bien sélectionner les candidats qui entrent en ligne de compte pour ce traitement. Cet article donne un aperçu de la littérature récente et des recommandations relatives à la réparation transcathéter bord à bord (TEER) en cas d'insuffisance mitrale secondaire.
La prévalence de l'insuffisance cardiaque chronique (ICC) augmente d'année en année, et cette affection touche actuellement 1-2 % de la population adulte. Environ un tiers des patients souffrant d'ICC développent une insuffisance mitrale secondaire (IMs) modérée à sévère, et le chiffre atteint même 50 % chez les patients hospitalisés. Les chiffres de la Mayo Clinic indiquent que l'IMs est 2 fois plus fréquente que l'IM primaire (IMp), et qu'elle est plus souvent imputable à un remodelage ventriculaire gauche (VG) qu'à un remodelage de l'oreillette gauche (OG)1.
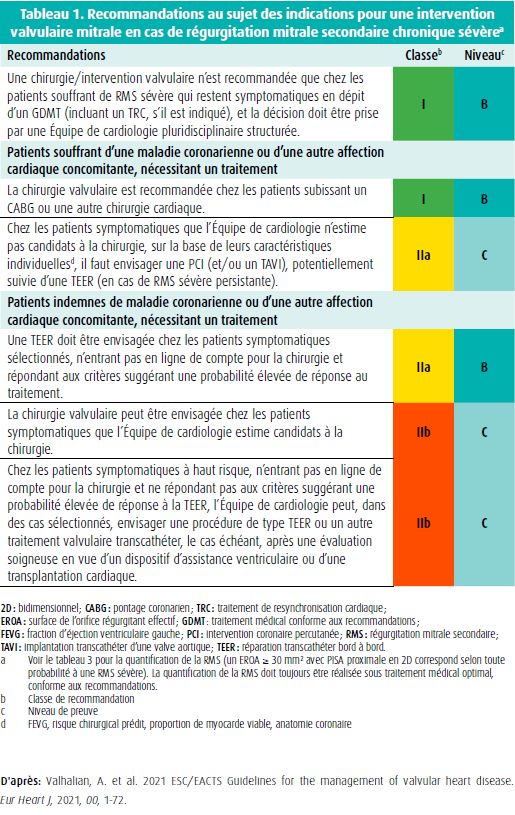
En cas d'IMs, l'insuffisance valvulaire n'est pas la cause, mais la conséquence de la dilatation et de la dysfonction du VG, et ce contrairement à l'IMp. En cas d'IMp, le traitement est dès lors ciblé sur une réparation ou un remplacement de la valve, étant donné que ceci aura un caractère curatif pour le patient. En cas d'IMs, il faut se focaliser sur le traitement de l'insuffisance cardiaque sous-jacente. On cherche depuis longtemps à savoir si un traitement de la valve elle-même offre un avantage supplémentaire. En pratique, nous voyons que seuls 3-4 % des patients souffrant d'IMs subiront en définitive une chirurgie valvulaire, tandis qu'un tiers de ces patients présentent une IMs sévère. Chez les patients souffrant de dysfonction du VG et d'IMs sévère isolée, la chirurgie valvulaire est en effet associée à une mortalité peropératoire élevée, et les études n'ont jusqu'à présent pas pu démontrer de bénéfice pronostique de la chirurgie valvulaire. L'IMs sévère reste une bonne indication pour une chirurgie valvulaire, si le patient a besoin d'une chirurgie concomitante, par exemple un pontage coronarien ou une autre chirurgie valvulaire, comme un remplacement de la valve aortique2,3 (tableau 1). Dans ce contexte, la recommandation est principalement basée sur des études observationnelles lors desquelles on a pratiqué une annuloplastie réductrice. Le problème avec l'annuloplastie est le risque de récidive de l'insuffisance mitrale à moyen terme. Une étude randomisée qui a comparé d'un remplacement de la valve mitrale par rapport à une plastie valvulaire mitrale chez des patients souffrant d'IM ischémique a montré un meilleur succès de la chirurgie et moins d'hospitalisations pour insuffisance cardiaque, mais au prix toutefois d'une mortalité peropératoire plus élevée. Les recommandations de l'ACC/ AHA attribuent une recommandation de classe IIb, niveau de preuve (level of evidence, LOE) B pour un remplacement valvulaire mitral épargnant les cordages et une recommandation de classe IIa, LOE B, pour une annuloplastie réductrice dans le cadre d'un CABG concomitant3. Des techniques chirurgicales additionnelles au niveau de l'appareil sous-valvulaire peuvent être nécessaires pour garantir le succès d'une annuloplastie.
Le principal mécanisme de l'IMs en cas de dysfonction du VG est un déplacement géométrique des muscles papillaires, qui génère une traction plus élevée sur les feuillets valvulaires. Un déséquilibre entre la force de traction et la force de fermeture entraîne un 'tenting' des feuillets valvulaires, ce qui induit souvent un défect au niveau de la ligne de coaptation. À terme, on observe aussi une fibrose des feuillets valvulaires, due à une stimulation du facteur de croissance transformant bêta (TGF-β). Contrairement à une valvulopathie rhumatismale/ toxique primaire, les feuillets valvulaires ne présentent de mouvement restrictif que pendant la systole (type IIIb selon la classification de Carpentier). Un tenting important diminue les chances de réparation fructueuse par annuloplastie et est une des raisons pour lesquelles une prothèse valvulaire mitrale peut être indiquée.
Si l'IMs est principalement due à un remodelage de l'OG (on parle également d'IM auriculaire secondaire), nous voyons essentiellement un défaut de coaptation au niveau des feuillets valvulaires dû à une dilatation et à une dysfonction de l'anneau valvulaire mitral. Ces patients ont souvent une insuffisance cardiaque à fraction d'éjection préservée (HFpEF) sous-jacente, ou une fibrillation auriculaire persistante4. Dans cette forme d'IMs, la mobilité des feuillets valvulaires est généralement préservée (type I selon la classification de Carpentier). Des données récentes soulignent l'importance du contrôle du rythme, du traitement de l'insuffisance cardiaque sous-jacente et si nécessaire de l'annuloplastie chez les patients résistants au traitement5. Toutefois, on ne dispose pas encore d'études prospectives démontrant l'utilité de la chirurgie dans ce contexte. La place des interventions percutanées en cas d'IM auriculaire doit également encore être étudiée.
Une IMs qui se développe essentiellement suite à un remodelage du VG s'observe surtout chez les patients souffrant d'insuffisance cardiaque, avec une fonction du VG (légèrement) diminuée (HF(m)rEF). Ces patients sont généralement plus jeunes que les patients souffrant d'HFpEF et, si l'IM est sévère, le risque d'une intervention valvulaire doit être analysé. De toute façon, ces patients doivent tout d'abord recevoir un traitement médical optimal, et la première étape vise une décongestion adéquate et une titration des médicaments. En effet, tous les traitements médicaux préconisés dans les recommandations actuelles pour les patients souffrant d'HFrEF ont une influence bénéfique sur le remodelage du VG. Les IECA, les bêtabloquants, les antagonistes des récepteurs des minéralocorticoïdes, les diurétiques, mais aussi la nouvelle génération de médicaments comme le sacubitril/valsartan et les inhibiteurs du SGLT2 diminuent le remodelage du VG et peuvent réduire la sévérité de l'IM2,6-8. Les nouvelles recommandations de l'ACC/AHA attribuent une recommandation de classe I, LOE A, au traitement médical9. Sur ce plan, il est important que le traitement soit titré jusqu'à la dose maximale tolérée, ce qui est encore trop peu le cas en pratique quotidienne et explique qu'il est souvent utile d'adresser le patient à un centre de l'insuffisance cardiaque. Chez les patients souffrant d'un bloc de branche gauche large, un traitement de resynchronisation cardiaque (TRC) a un effet clair sur l'IMs, d'une part immédiate, suite à la resynchronisation elle-même, d'autre part à plus long terme, grâce au remodelage inverse10.
Depuis l'approbation par la FDA du Mitra- Clip pour le traitement des patients souffrant d'IM primaire, des milliers de patients souffrant d'IM secondaire ont déjà bénéficié d'un MitraClip dans le monde entier. Les registres indiquent que la réparation transcathéter bord à bord (TEER) est associée à une amélioration des symptômes d'insuffisance cardiaque, si l'on obtient une bonne réduction de l'IMs (au moins < 2+/4). L'approbation et le remboursement du MitraClip pour l'IMs ont été suivi à la publication de 2 études randomisées qui ont évalué l'effet et la sécurité de la TEER11,12. Dans les 2 études, la procédure était associée à une réduction significative et durable de la sévérité de l'IMs. Toutefois, l'étude MITRA-FR n'a pas pu démontrer d'effet bénéfique de la TEER en plus du traitement médical, comparativement au traitement médical seul, sur le plan du critère d'évaluation primaire combiné (hospitalisations pour insuffisance cardiaque et mortalité) après 1 an et 2 ans de suivi11,13. Par contre, l'étude COAPT a montré une réduction marquée du critère d'évaluation primaire (hospitalisations pour insuffisance cardiaque) et des différents critères d'évaluation secondaires (e. a. mortalité totale, qualité de vie et classe NYHA) après 2 et 3 ans de suivi12,14. Dans l'étude COAPT, il ne fallait traiter que 6 patients pendant 2 ans avec un MitraClip pour éviter 1 décès (NNT = 6).
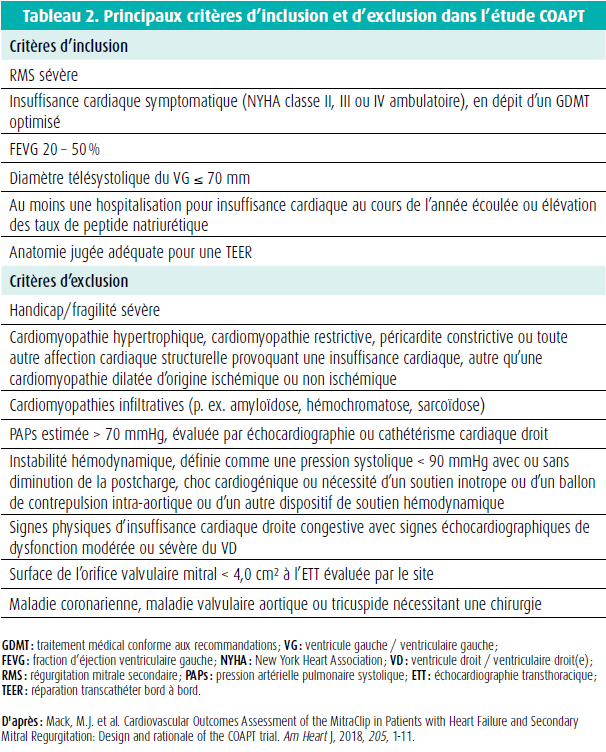
Ces dernières années, cette discordance frappante dans les résultats d'études a été à l'origine d'un débat animé. Un récent Joint Position Paper de la ESC reprend une synthèse des principaux résultats15. Il est clair que les patients de l'étude COAPT ont fait l'objet d'une sélection beaucoup plus stricte, e.a. sur le plan des comorbidités et de la réponse au traitement médical. Dans l'étude MITRA-FR, la titration ultérieure des médicaments était par exemple possible durant l'étude, ce qui explique l'amélioration comparable de la classe NYHA dans le groupe traité par TEER et dans le groupe témoin. Dans l'étude COAPT, un comité de sélection central était impliqué dans la sélection et l'inclusion des patients. Ainsi, les patients devaient non seulement souffrir d'IMs sévère, réfractaire au traitement, mais une forte dilatation du VG (diamètre télésystolique du VG > 70 mm), une dysfonction modérée à sévère du ventricule droit (VD) et une hypertension pulmonaire irréversible avec une PAPs estimée > 70 mmHg faisaient partie des critères d'exclusion (tableau 2).
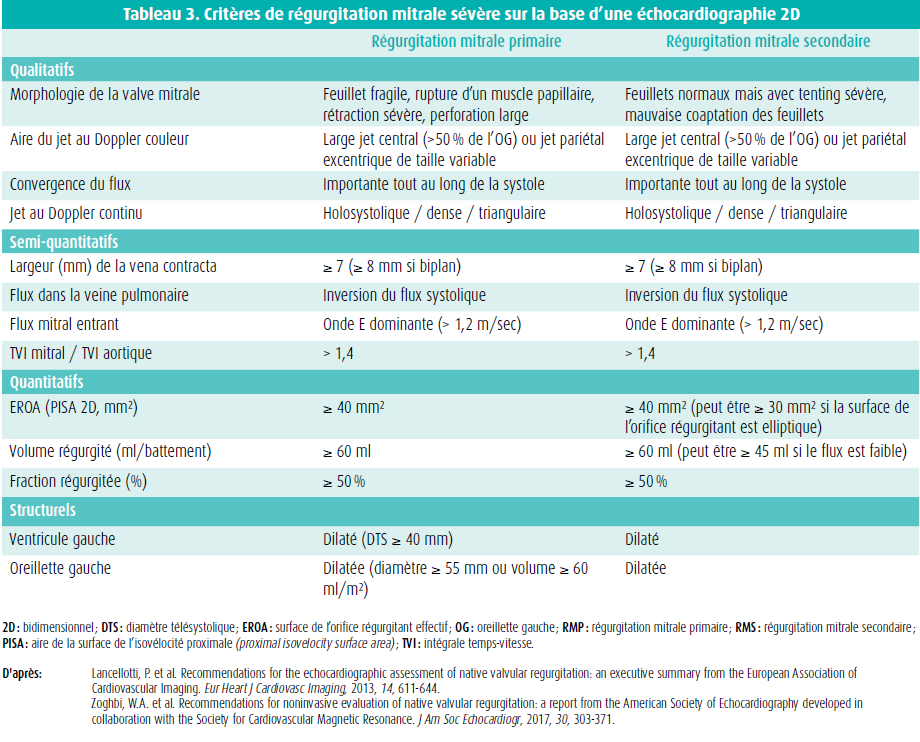
Un autre point important qui peut expliquer les différences de résultats en fonction des études est la définition de la sévérité de l'IMs. L'étude MITRA-FR a utilisé les critères publiés en 2017 par la ESC en ce qui concerne l'IMs sévère, et elle a donc inclus des patients ayant une surface régurgitante effective (ERO) ≥ 0,2 cm2 ou un volume régurgité (VR) ≥ 30 ml16. L'étude COAPT a utilisé les critères de l'American Society of Echocardiography et a inclus des patients ayant un ERO ≥ 0,3 cm2 ou un VR ≥ 45 ml17. En outre, le degré de dilatation du VG était moins prononcé dans l'étude COAPT. De ce fait, malgré la FEVG comparable dans les 2 études, l'ERO moyen était 30 % plus élevé et le volume télédiastolique moyen du VG était 25 % plus faible dans l'étude COAPT. Cette constatation a donné lieu au concept notoire d'IMs sévère 'disproportionnée', décrit par Paul Grayburn et Milton Packer18. Ils estiment que la différence de Proportionality Index (PI), lors de laquelle l'ERO est normalisé selon le volume télédiastolique du VG pourrait expliquer les différences de résultats entre ces 2 études. En effet, un ERO de 0,3 cm2 ne signifie pas la même chose selon que le VG est normal ou dilaté. Un PI < 0,13 mm2/ml comme c'était le cas dans l'étude MITRA-FR impliquerait que l'IM n'était pas suffisamment sévère pour qu'une procédure TEER puisse être associée à des bénéfices. Dans l'étude COAPT, ce PI était près de 2 fois plus élevé que dans l'étude MITRA-FR (0,21 vs 0,11 mm2/ml), ce qui suggère que l'IM était plus sévère que ce qu'on aurait pu escompter sur la base de la seule dilatation du VG. Bien que ce concept paraisse plausible, il doit encore être validé de manière prospective. Jusqu'à présent, des analyses rétrospectives des données de ces 2 études et d'autres études observationnelles n'ont pas pu démontrer que ce PI était prédictif d'un meilleur résultat19-21. Un message important en rapport avec ce concept est qu'on ne peut se baser sur un seul paramètre échographique (comme l'ERO) pour évaluer si une IMs est sévère, mais qu'une approche multiparamétrique avec évaluation des paramètres qualitatifs et (semi-)quantitatifs est essentielle22.
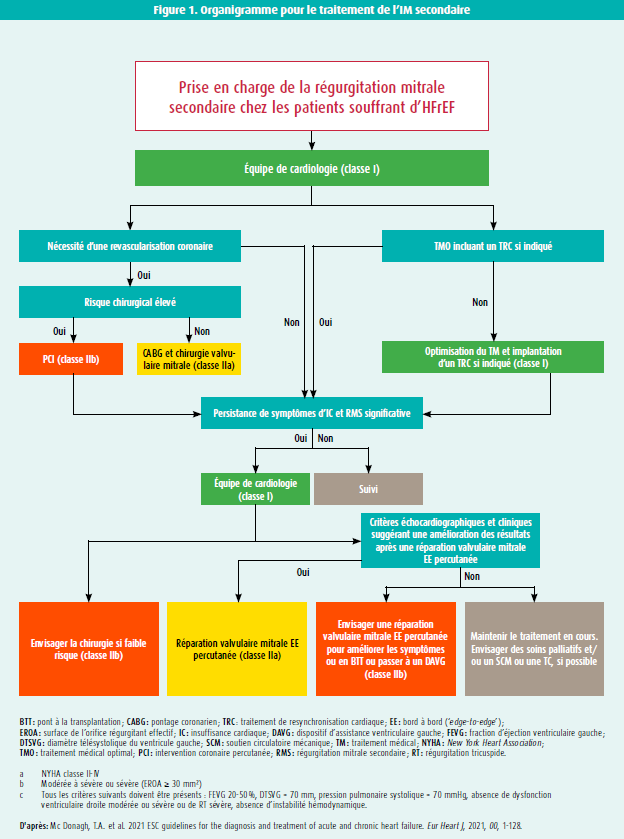
Sur la base de l'étude COAPT, une TEER pour une IMs sévère isolée se voit attribuer une recommandation de classe IIa, LOE B, dans les nouvelles recommandations de l'ACC/AHA et de la ESC/EACTS, pour le traitement de la maladie valvulaire (tableau 1). Contrairement à la chirurgie, une TEER est une procédure à faible risque. Il va de soi qu'on obtient les meilleurs résultats si les patients répondent aux critères d'inclusion et d'exclusion de l'étude COAPT (tableau 2). L'adaptation de la définition d'une IMs sévère dans les nouvelles recommandations 2021 de la ESC est importante (tableau 3). En effet, pour la quantification de l'IMs, on utilisera désormais les mêmes valeurs seuils que pour l'IMp (ERO ≥ 40 mm2 ou volume régurgité ≥ 60 ml) pour autant qu'on prête suffisamment attention au débit systolique du VG et à la forme de la surface régurgitante (en croissant de lune ou circulaire) afin d'éviter une sous-estimation de la sévérité. Si le débit systolique du VG est bas ou si la surface régurgitante est non circulaire, on peut donc utiliser une valeur seuil moindre, en l'occurrence de 30 mm2 pour l'ERO et de 45 ml pour le VR. La discussion au sein de l'équipe est essentielle pour évaluer le traitement médical, le risque opératoire et l'anatomie et le caractère 'clipable' de la valve, sur la base d'un examen transoesophagien. En cas de TEER, il faut également tenir compte des comorbidités du patient, et une espérance de vie d'au moins 1 an est souhaitable, afin d'éviter des interventions inutiles et coûteuses2,3. Si le patient n'entre pas encore en ligne de compte pour une transplantation cardiaque ou un soutien mécanique (dispositif d'assistance ventriculaire gauche, DAVG), une TEER peut également aider à le stabiliser, dans l'intervalle. Cette recommandation figure dans les récentes guidelines de la ESC au sujet du traitement de l'insuffisance cardiaque aiguë et chronique. La figure 1 illustre l'organigramme proposé dans ces nouvelles recommandations 2021 de la ESC23 (figure 1).
Conclusion
Une TEER est une intervention à faible risque, qui peut être utile chez les patients présentant des symptômes d'insuffisance cardiaque et une IMs sévère, en dépit d'un traitement médical maximal. Tenant compte des indications actuelles pour la TEER, seule une faible proportion de patients entrent en ligne de compte pour cette procédure. Plusieurs études utilisant différents critères d'inclusion sont en cours pour examiner plus en détail la place de la TEER par rapport à la chirurgie et à d'autres techniques percutanées. Le traitement de l'insuffisance cardiaque reste en tout cas la pierre angulaire du traitement de l'IMs, et seule une sélection optimale des candidats potentiels à une TEER permettra d'améliorer les résultats en pratique.
Références
- Dziadzko, V., Dziadzko, M., Medina-Inojosa, J. et al. Causes and mechanisms of isolated mitral regurgitation in the community: clinical context and outcome. Eur Heart J, 2019, 40, 2194-2202.
- Valhalian, A. et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J, 2021, 00, 1-72.
- O Bonow, R. et al. 2020 Focus update of the 2017 Concensus Decision Pathway on the Management of Mitral Regurgitation. J Am Coll Cardiol, 2020, 75, 2236-2270.
- Deferm, S., Bertrand, P.B., Verbrugge, F.H. et al. Atrial functional mitral regurgitation: JACC review topic of the week. J Am Coll Cardiol, 2019, 73, 2465-2476.
- Deferm, S., Bertrand, P.B., Verhaert, D. et al. Outcome and durability of mitral valve annuloplasty in atrial secondary mitral regurgitation. Heart, 2021, 107 (18), 1503- 1509.
- Kang, D.H., Park, S.J., Shin, D.H. et al. Angiotensin Receptor Neprilysin Inhibitor for Functional Mitral Regurgitation PRIME Study. Circulation, 2019, 139, 1354-1365.
- Mullens, W. and Martens, P. Sacubutril/ Valsartan to reduce secondary mitral regurgitation: refinement of guideline directed medical therapy? Circulation, 2019, 139, 1366-1370.
- Lee, M., Jhund, P., Petrie, M. et al. Effect of Empagliflozin on Left Ventricular Volumes in Patients With Type 2 Diabetes, or Prediabetes, and Heart Failure With Reduced Ejection Fraction (SUGAR-DM-HF). Circulation, 2021, 143, 516-525.
- Otto, C.M. et al. 2020 ACC/AHA guideline for the management of patient with valvular heart disease. Circulation, 2021, 143, e27- e227.
- Van Bommel, R.J., Marsan, N.A., Delgado, V. et al. Cardiac Resynchronization Therapy as a Therapeutic Option in Patients With Moderate-Severe Functional Mitral Regurgitation and High Operative Risk. Circulation, 2011, 124, 912-919.
- Obadia, J-F., Messika-Zeitoun, D., Leurent, G. et al. Percutaneous repair or medical treatment for secondary mitral regurgitation. N Engl J Med, 2018, 379, 2297-2306.
- Stone, G.W., Lindenfeld, J., Abraham, W.T. et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med, 2018, 379, 2307-2318.
- Iung, B., Armoiry, X., Vahanian, A. et al. MITRA-FR Investigators. Percutaneous repair or medical treatment for secondary mitral regurgitation:outcomes at 2 years. Eur J Heart Fail, 2019, 21, 1619-1627.
- Mack, M., Lindenfeld, J., Abraham, W. et al. 3 Years Outcome of Transcatheter Mitral Valve Repair in Patients With Heart Failure. J Am Coll Cardiol, 2021, 77, 1029-1040.
- Coats, A., Ancker, S., Baumbach, A. et al. Management of secondary mitral regurgitation in heart failure. Joint position statement of HFA, EACVI, EHRA and EAPCI of ESC. Eur Heart J, 2021, 42, 1254-1269.
- Baumgarter, H. et al. 2017 ESC/EACTS Guidelines for the Management of Valvular Heart Disease. Eur Heart J, 2017, 38, 2739- 2791.
- Zoghbi, W.A., Asch, F.M., Bruce, C. et al. Guidelines for the evaluation of valvular regurgitation after percutaneous valve repair or replacement: a report from the American Society of Echocardiography. Developed in collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr, 2019, 32, 431-475.
- Grayburn, P.A., Sannino, A., Packer, M. Proportionate and disproportionate functional mitral regurgitation: a new conceptual framework that reconciles the results of the MITRA-FR and COAPT trials. JACC Cardiovasc Imaging, 2019, 12, 353-362.
- Asch. F.M., Grayburn, P.A., Siegel, R.J. et al. Echocardiographic Outcomes After Transcatheter Leaflet Approximation in Patients With Secondary Mitral Regurgitation The COAPT Trial. J Am Coll Cardiol, 2019, 74 (24), 2969-2979.
- Lindenfeld, J., Abraham, W.T., Grayburn, P.A. Association of Effective Regurgitation Orifice Area to Left Ventricular End-Diastolic Volume Ratio With Transcatheter Mitral Valve Repair Outcomes. JAMA Cardiol, 2021, 6 (4), 427-436.
- Messika-Zeitoun, D., Iung, B., Armoiry, X. Impact of Mitral Regurgitation Severity and Left Ventricular Remodeling on Outcome After MitraClip Implantation: Results From the Mitra-FR Trial. JACC Cardiovasc Imaging, 2021, 14, 742-752.
- Grayburn, P.A., Packer, M., Sannino, A. Review: Disproportionate secondary mitral regurgita-tion: myths, misconceptions and clinical implications. Heart, 2021, 107, 528- 534.
- McDonagh, T.A., Metra, M., Adamo, M., Gardner, R.S., Baumbach, A., Böhm, M. et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2021, 42 (36), 3599-3726.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.