Voilà 30 ans qu'on a décrit un nouveau syndrome clinique et électrocardiographique distinct, désormais connu sous le nom de syndrome de Brugada (BrS). Ce syndrome se caractérise typiquement par un ECG particulier, avec un sus-décalage du segment ST dans les dérivations précordiales droites. La présentation clinique de la maladie est très variable : les patients peuvent rester totalement asymptomatiques, mais ils peuvent aussi développer des épisodes de syncope, une fibrillation auriculaire (FA), un syndrome du sinus malade (SSS), des troubles de la conduction, une asystolie et une fibrillation ventriculaire (FV). La maladie est due à des mutations dans les gènes responsables du potentiel d'action des cellules cardiaques. Le gène le plus fréquemment impliqué, SCN5A, contrôle la structure et la fonction du canal sodique cardiaque. La description de ce nouveau syndrome a eu des implications très positives dans tous les domaines de la médecine.
Introduction
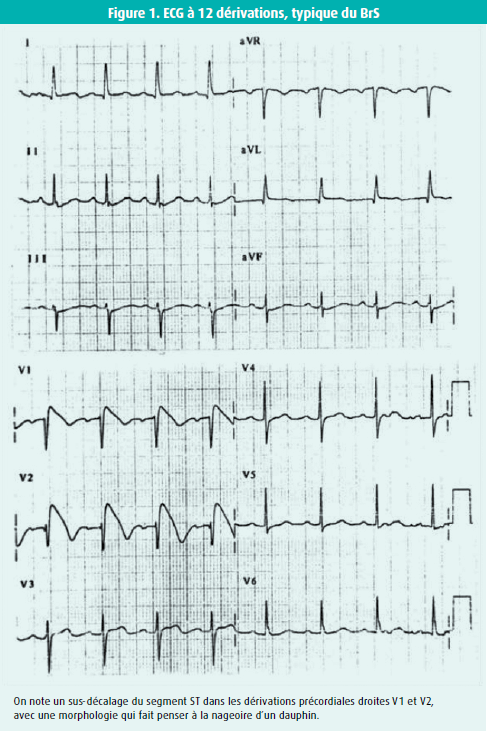
C'est en novembre 1992, il y a donc 30 ans, que l'article 'Right bundle branch block, persistent ST segment elevation and sudden death: A distinct clinical and electrocardiographic syndrome. A multicenter report' a été publié dans le Journal of the American College of Cardiology (JACC).1 L'article décrivait huit patients ayant une histoire de mort subite ressuscitée, provoquée par une FV. Des examens approfondis n'ont établi aucune cause expliquant ces troubles du rythme chez ces patients. Ces huit patients présentaient un ECG très particulier, avec un sus-décalage du segment ST dans les dérivations précordiales droites et ce qui semblait être un bloc de branche droit (figure 1). Trois des patients étaient des enfants, deux étaient des jeunes filles et deux des enfants étaient frère et soeur. Trois patients présentaient également des caractéristiques du SSS et on a aussi diagnostiqué une FA chez trois patients. Quatre patients présentaient des troubles de la conduction marqués, et quatre avaient également un intervalle HV prolongé ou limite, et tous les patients présentaient une tachycardie ventriculaire (TV) polymorphe (soutenue ou non) inductible à l'examen électrophysiologique. Les causes du syndrome n'étaient pas claires à l'époque, mais on a d'emblée compris qu'il s'agissait d'un problème purement électrique, le coeur étant structurellement normal, et qu'il devait s'agir d'un trouble héréditaire. La FV très rapide suggérait qu'il devait s'agir d'un problème de dispersion de périodes réfractaires courtes ou normales, contrairement à la FV relativement plus lente (torsades de pointes) du syndrome du QT long, où les périodes réfractaires ventriculaires sont longues en raison de la repolarisation prolongée. Cette publication a marqué le début d'une grande aventure qui est toujours en cours.
Il a fallu cinq ans pour identifier les quatre premiers patients. Ces quatre patients avaient été présentés dans un poster lors de la réunion de la NASPE en 1991. Après la présentation, et grâce à une collaboration internationale, un grand nombre de patients potentiellement similaires ont été signalés. En fin de compte, on a identifié quatre nouveaux patients ayant des caractéristiques identiques aux quatre premiers. Cette collaboration internationale spontanée (sans financement, sans protocole, sans comités ni conseil) a donné lieu à une des publications originales les plus citées en cardiologie. Ce que les auteurs ont initialement pris pour une sorte de curiosité est ensuite apparu comme une véritable révolution scientifique. Cette révolution se ressent dans les implications positives que la découverte de ce syndrome a comportées pour plusieurs aspects de la médecine.
Implications du BrS
Pour la cardiologie clinique
La description de ce nouveau syndrome a rendu un hommage superbe à la valeur de l'ECG en tant qu'outil diagnostique simple, bon marché et pourtant très précieux : le diagnostic du BrS repose sur un ECG anormal. L'ECG dit de 'type 1' (figure 1) est la seule condition pour poser le diagnostic après qu'on a exclu les autres causes possibles (tableau 1). Le BrS a une fois de plus montré à quel point il est dangereux de classer des ECG 'atypiques' comme des 'variantes de la normale'. Pendant des années, l'ECG du BrS a été considéré comme une variante de la normale, sans aucune signification diagnostique ou pronostique.2 On a tenté de structurer le diagnostic du BrS à l'aide d'un système de score.3 Malheureusement, en pratique, ce score n'a aucune valeur, car jusqu'à 40 % des patients présentant un BrS avéré n'auraient pas de critères suffisants pour poser le diagnostic4parler d'un patient ayant un 'ECG de Brugada' s'il n'y a pas d'autres observations pour parler du 'syndrome', comme une syncope, une mort subite ressuscitée, une FA, des troubles de la conduction ou des mutations pathologiques. À partir du moment où on trouve une ou plusieurs de ces observations, on peut parler de BrS. La question est de savoir si on peut parler d'une 'maladie' de Brugada au moment où on découvre une mutation pathologique (causale).
Pour la physiologie
Le BrS a conduit à la découverte de nouveaux mécanismes de troubles du rythme, en particulier le phénomène de 'réentrée de phase 2' (P2R) (figure 2).5
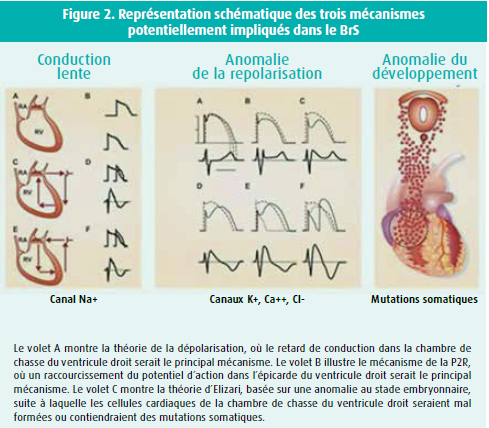
Le mécanisme exact de la FV en cas de BrS fait toujours l'objet de discussions. Outre la réentrée classique basée sur une conduction anormale (volet A de la figure 2), la P2R et la théorie de la crête neurale (neural crest) constituent deux alternatives pour expliquer les troubles du rythme. La réentrée classique dans la chambre de chasse du ventricule droit (RVOT) est considérée comme le principal mécanisme de la FV par le groupe de l'UMC d'Amsterdam. En revanche, le groupe d'Utica adhère à la théorie de la P2R. Alors que dans le premier mécanisme, les potentiels d'action seraient normaux et que le gradient électrique proviendrait de la conduction lente avec des potentiels d'action déphasés, dans la P2R, le gradient électrique est dû à un raccourcissement de la durée du potentiel d'action dans l'épicarde de la RVOT (volet B). Tandis que dans le premier mécanisme, le problème principal reposerait sur des mutations qui réduisent le courant sodique dans la cellule cardiaque, la P2R repose sur un courant potassique (Ito) excessif. Il est intéressant de noter qu'en cas de BrS, on a décelé des mutations dans de nombreux gènes différents ayant un très large éventail de fonctions. Il est préférable de dire que le BrS n'est qu'un phénotype dont les causes peuvent être nombreuses et différentes. On peut le comparer au syndrome du QT long (LQT) : l'ECG montre un intervalle QT long, mais les causes peuvent varier considérablement (canal sodique dans le LQT de type 3, canaux potassiques dans les types 1 et 2). Le groupe d'Elizari, à Buenos Aires, suggère que la base du BrS repose sur des mutations - probablement somatiques - dans les cellules de la crête neurale. Selon eux, le BrS est un problème de développement du coeur au stade embryonnaire. Il convient de noter qu'on trouve des mutations dans les cellules germinales dans maximum 40 % des familles atteintes du BrS. Il est en effet possible que les autres patients présentent des mutations somatiques qui ne seraient détectables que par une biopsie de la RVOT, et non par les techniques habituelles telles que les prélèvements sanguins. Cette possibilité a déjà été démontrée il y a longtemps chez des patients souffrant de TV idiopathique, chez qui une biopsie du VD a révélé des mutations somatiques.6 Cette possibilité de mutations somatiques dans le BrS est également étayée par le fait qu'environ la moitié des patients sont des cas isolés et non familiaux, comme si ces patients ne pouvaient pas transmettre la maladie via les cellules germinales.
Pour la génétique
La description, en 1996, du premier gène lié au BrS a représenté un moment véritablement historique dans les relations entre la génétique et la cardiologie. Les examens génétiques en cardiologie étaient à cet égard très limités et presque exclusivement axés sur la recherche de mutations chez les patients souffrant d'un LQT ou d'une cardiomyopathie hypertrophique. Les résultats étaient davantage considérés comme une curiosité que comme une contribution potentielle à la compréhension des mécanismes et, qui sait, peut-être à la mise au point ultérieure d'un traitement. Mais maintenant, nous savons que le canal sodique reste ouvert dans certaines mutations, que la repolarisation est prolongée, et que cela débouche sur un LQT (de type 3). Mais si le flux de sodium est réduit à la suite d'autres mutations dans le même gène, on obtient des troubles de la conduction et un BrS. Soudain, un tout nouveau monde s'est ouvert. Il n'est donc pas surprenant que le nombre de mutations publiées dans toutes les maladies cardiaques héréditaires ait augmenté très rapidement, et pas uniquement dans des maladies anciennes, connues de longue date. La découverte du gène responsable du syndrome du QT court a pris moins de trois ans. Grâce aux nouvelles techniques de tests génétiques (GWAS), l'ensemble du processus diagnostique a connu une accélération exponentielle. Malheureusement, toutes ces nouvelles informations posent un problème d'interprétation: toutes les mutations et tous les gènes sont-ils vraiment importants ? Sont-ils la cause de la maladie ? Quelle est l'importance réelle des polymorphismes ? Hélas, nous n'avons pas les moyens, le temps et suffisamment de patients différents pour étudier chaque mutation de manière fonctionnelle, afin de montrer que les effets escomptés d'une mutation donnée correspondent au tableau clinique auquel nous nous attendons. Il existe des modèles pour nous aider, mais leurs résultats impliquent toujours un certain degré de probabilité et d'incertitude quant à leur valeur. Néanmoins, ces résultats sont importants pour le traitement des familles souffrant du BrS.
Pour la fertilité
Malgré toutes les limites auxquelles on peut penser, le diagnostic génétique préimplantatoire (DPI) est devenu une option évidente pour le traitement des maladies héréditaires. Les opposants à cette technique affirment que presque aucune maladie, et certainement pas le BrS, n'est monogénique. Selon eux, outre le gène principal considéré comme responsable de la maladie, il doit y avoir un certain nombre d'autres mutations et variations, y compris des polymorphismes, qui s'accumulent jusqu'à ce qu'un certain 'score de risque génétique' soit atteint. Ainsi, l'implantation d'un embryon sélectionné, par exemple sur la base de l'absence d'une mutation dans le canal sodique, n'aurait aucune valeur pour éviter un BrS. Les partisans du DPI affirment, avec les mêmes arguments, que la sélection d'un embryon dépourvu de la mutation abaisse précisément le score de risque génétique, et que cela peut donc contrecarrer la manifestation de la maladie. Le DPI est proposé dans notre hôpital depuis de nombreuses années pour plus de 200 maladies différentes considérées comme monogéniques, notamment le BrS. Étant donné le jeune âge des enfants nés après un DPI, nous ne pouvons pas encore tirer de conclusions sur le développement - ou non - de la maladie. Ces enfants et jeunes adultes sont suivis de très près.
Un autre aspect de la fertilité concerne les fausses couches spontanées dans les familles touchées par le BrS. Bien qu'il soit possible que les embryons et les foetus meurent 'in utero' des suites de troubles du rythme, ou même parce que le coeur ne commence jamais à battre, il s'est avéré impossible de tirer des conclusions.7 Il y a trop de fausses couches qui passent complètement inaperçues chez les femmes fertiles pour pouvoir étudier ce phénomène.
Pour la gynécologie
Compte tenu des conséquences graves du BrS, il n'est pas surprenant qu'on se soit demandé quelles peuvent être les conséquences pour les femmes enceintes. Les informations recueillies montrent que la grossesse et l'accouchement n'impliquent aucun risque particulier7 pour les femmes souffrant du BrS.
Pour la pédiatrie
Le BrS est une cause de mort subite chez l'enfant, et également une des causes possibles de la mort subite du nourrisson. Peu de maladies ont donné lieu à autant de spéculations que la mort subite du nourrisson : la position du bébé pendant le sommeil, le tabagisme dans la chambre du bébé, l'utilisation ou non d'oreillers, etc. Nous savons maintenant que l'éventail des causes de la mort subite du nourrisson est très large, et que l'asphyxie du bébé, un homicide et des accidents non avoués peuvent effectivement jouer un rôle, mais nous savons aussi que la plupart de ces morts subites sont dues à des troubles du rythme, dont le BrS.8
Un problème similaire se rencontre dans le diagnostic de l'épilepsie et des syncopes de cause inconnue chez les enfants. Non seulement le LQT, mais aussi le syndrome du QT court et le BrS doivent être inclus dans le diagnostic différentiel, et d'autant plus si l'enfant présente des syncopes ou une épilepsie 'difficiles à traiter'. Il ne faut pas non plus oublier que les patients peuvent souffrir de plus d'une maladie : par exemple, une épilepsie et un BrS9, mais aussi une syncope vasovagale et arythmique.
Pour la pharmacologie
Depuis des années, on mène de nombreuses recherches sur les modifications de l'intervalle QT à l'ECG, induites par des médicaments. Un groupe de travail international publie une mise à jour presque hebdomadaire des médicaments qui peuvent allonger l'intervalle QT.10 Un tel allongement peut entraîner le développement de torsades de pointes et une mort subite. Désormais, grâce aux effets des médicaments dans le BrS, nous savons que d'autres médicaments peuvent également provoquer une mort subite via leurs effets sur le canal sodique. Une liste de ces médicaments est également tenue à jour par un consortium international.11
Pour la médecine du sport
Peu de choses affectent plus notre société que la mort brutale d'un athlète 'en parfaite santé'. Nous considérons que ce groupe est le plus sain dans notre société, et un décès brutal est presque inimaginable. Ceci touche également des sportifs professionnels qui font l'objet d'un dépistage annuel des maladies cardiovasculaires. Toutes les morts subites chez les sportifs ne surviennent pas pendant l'effort, au contraire.12 La plupart des décès se produisent soudainement après l'effort, soit immédiatement, soit plus tard, au repos complet. On savait depuis longtemps que le syndrome du QT long (LQT) et la TV polymorphe catécholaminergique (TVPC) étaient des causes possibles, mais aujourd'hui, après une étude approfondie des proches de ces défunts, il apparaît que le BrS est la cause la plus fréquente.12 Le fait que le BrS puisse se présenter avec un ECG tout à fait normal rend la détection de ces patients extrêmement difficile.
Pour la médecine légale
Notre pays n'a pas de bonnes habitudes en matière d'autopsies. En cas de mort subite d'un sujet jeune, on recourt très peu à cette pratique. Ce n'est que s'il pourrait s'agir d'une mort 'non naturelle' que l'autopsie sera obligatoire. Les résultats de ces autopsies varient énormément d'un examen à l'autre, mais aussi en fonction de l'expertise des médecins et de leur 'opiniâtreté'. Certains médecins cherchent la cause du décès plus longtemps et plus assidûment que d'autres. Mais même après une 'expert autopsy', la cause d'un très grand nombre de décès reste inconnue.12 C'est là qu'interviennent l'étude des membres de la famille et l'autopsie 'moléculaire'. L'étude de Papadakis et al.12 a montré que la cause la plus fréquente de la mort subite - du moins lorsqu'une cause est identifiée - est le BrS. Ceci a été démontré par les résultats du test à l'ajmaline chez les membres de la famille. Les examens génétiques post mortem peuvent également révéler une mutation causale potentielle dans 20-40 % des cas.13
Pour la médecine préventive
Le dépistage de personnes apparemment en bonne santé est un des meilleurs moyens de découvrir des maladies cachées. Bien sûr, la valeur du dépistage dépend fortement de l'examinateur et des examens effectués. Nous acceptons tous le dépistage du cancer du sein chez les femmes ou la détection de porteurs potentiels de tumeurs intestinales encore silencieuses, mais les avis divergent lorsqu'il s'agit de dépistage cardiovasculaire. Malheureusement, les arguments pour et contre ce dépistage ne sont pas si évidents. Si on examine les résultats de la prévention du cancer du côlon aux Pays-Bas, il s'avère que 95 % des tests positifs - suspects - sont des faux positifs. Ainsi, 95 % des 'patients' subissent une coloscopie 'pour rien'.14 Il en va de même pour le dépistage du cancer du sein. Les résultats sont si controversés que les autorités médicales suisses ont mis fin au dépistage du cancer du sein. Quant au coeur, les conclusions dépendent des examens : pour le dépistage, comme le suggèrent les études italiennes15, ou contre, comme l'affirment les études américaines. En tout cas, il y a une grande différence dans les arguments pour ou contre. Alors que les Italiens fondent leurs arguments sur une réduction de l'incidence de la mort subite grâce au dépistage, les Américains s'opposent au dépistage pour des raisons financières. Mais quel prix donnons-nous à la vie d'une personne jeune ?
Pour la médecine du travail
La contribution la plus extraordinaire de la description du BrS est peut-être la compréhension de certains 'mystères' médicaux. Prenons l'exemple de la forte incidence, dans les années 1970, de morts subites de travailleurs originaires d'Asie du Sud, survenues en Amérique. On ne comprenait absolument pas pourquoi ces jeunes hommes asymptomatiques et apparemment en bonne santé mouraient soudainement la nuit. Étant donné la présence presque endémique du BrS en Asie du Sud, et depuis les études de Nademannee16, nous savons désormais que le BrS était la cause de ces décès. Ceci a non seulement été prouvé par des études cliniques, mais aussi par des études génétiques.17
Pour l'anesthésie
Dans la liste des médicaments susceptibles de provoquer une mort subite chez les patients souffrant du BrS, nous trouvons également des anesthésiques.10 L'un d'entre eux est le propofol, responsable du syndrome dit 'du propofol'.18 Ce syndrome est également lié au BrS.19 Curieusement, dans une de nos études, nous n'avons pu trouver aucun inconvénient à l'utilisation du propofol chez les patients souffrant d'un BrS avéré.20 Les manifestations du syndrome du propofol peuvent dépendre de la dose et de la sensibilité du patient, mais d'autres pathologies sous-jacentes jouent certainement aussi un rôle. Le syndrome du propofol se manifeste par un élargissement très étrange du complexe QRS sur l'ECG, avec les sus-décalages du segment ST typiques associés au BrS, et par des troubles du rythme ventriculaire qui peuvent provoquer la mort subite du patient.
Pour la médecine d'urgence
Le BrS figure obligatoirement dans le diagnostic différentiel de plusieurs problèmes médicaux : syncope, traumatismes et accidents de la route provoqués par un éventuel trouble du rythme ou une perte de connaissance temporaire, épilepsie, toutes les formes d'arrêt cardiaque et de troubles du rythme ventriculaire, troubles de la conduction. Un groupe qui doit être étudié séparément est celui des jeunes patients souffrant d'une FA ou d'un flutter auriculaire. Avant d'injecter des médicaments par voie intraveineuse pour arrêter ces troubles du rythme, il faut toujours se demander s'il ne s'agit pas d'un BrS. L'administration de flécaïnide par voie intraveineuse à un tel patient peut entraîner la mort.
Pour les appareils électroniques cardiaques et l'ablation de la RVOT
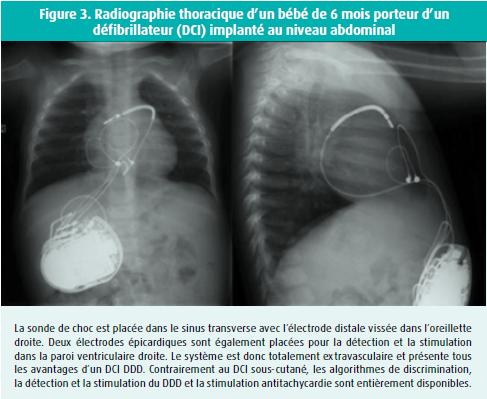
Le BrS est une maladie qui touche les sujets jeunes. Elle ne peut être contrôlée (en termes de mort subite) que par l'implantation d'un défibrillateur interne (DCI). Il n'est donc pas surprenant que les techniques d'implantation soient adaptées aux enfants. Ainsi, une implantation sous-costale, abdominale, est beaucoup plus confortable qu'une implantation prépectorale, surtout pour la pratique d'un sport. Moyennant la formation nécessaire, l'implantation peut être effectuée avec des sondes épicardiques, de sorte que le système veineux du patient soit complètement épargné (figure 3). Dans les centres expérimentés, cette implantation épicardique peut être combinée avec une ablation épicardique de la RVOT, où se trouve le substrat du BrS.21 Cette combinaison est notre protocole habituel pour traiter le BrS. Nous ne disposons pas encore de données suffisantes sur les effets à long terme de l'ablation. À l'heure actuelle, l'ablation n'est pas une alternative au DCI.
Le monde de la mort subite redessiné
Nous sommes entrés dans un nouveau monde en ce qui concerne les causes de mort subite chez des personnes ayant un coeur structurellement normal: du QT long au BrS comme causes principales.12
Aspects liés au genre
Dans de nombreuses publications sur le BrS, on a toujours signalé que les hommes atteints de cette maladie se portent moins bien que les femmes. Cette idée semble valable pour les adultes, mais pas pour les adolescents. Aucune différence sur le plan des symptômes et de la mortalité n'a pu être démontrée entre les garçons et les filles prépubères.22 Il est très clair que la testostérone joue un rôle dans le BrS. On a même démontré que la castration masculine améliore la manifestation de la maladie.23
Pour la médecine vétérinaire
La mort subite n'est pas inconnue dans le monde animal.24 On n'a jamais effectué de recherche systématique des causes possibles. Ce n'est que récemment, après une analyse intensive de ce phénomène, que le BrS a été inclus dans la liste des causes possibles.
Pour la philosophie : les paradoxes et le BrS
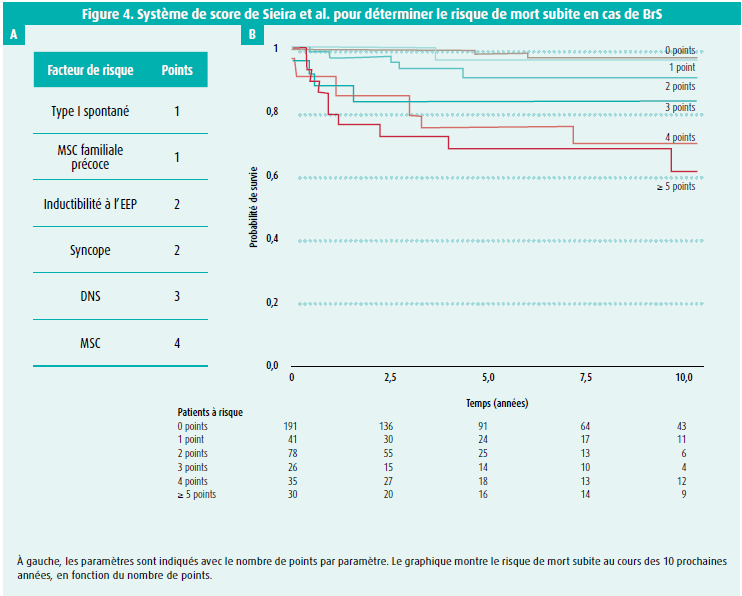
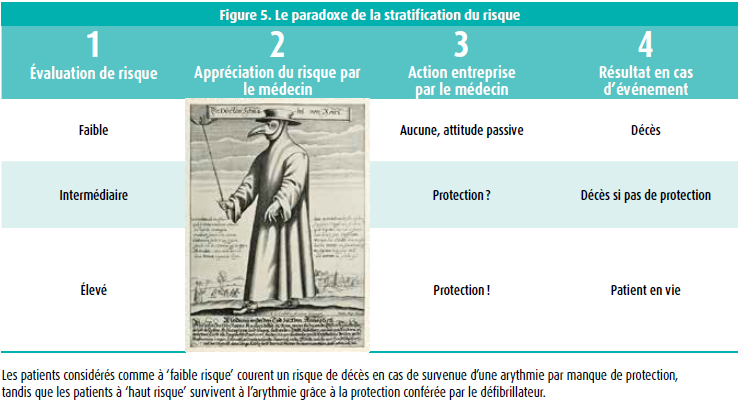
Un aspect très intéressant du BrS concerne la détermination du risque de mort subite. Comme nous l'avons mentionné dans l'introduction, le BrS compte une très large gamme de présentations cliniques. Le diagnostic peut être posé après un épisode de mort subite ressuscitée, mais de plus en plus de patients se voient poser ce diagnostic en étant complètement asymptomatiques. La syncope, la FA, le SSS, les troubles de la conduction … sont tous des symptômes et des observations ayant un impact sur le pronostic. Mais dès lors, à qui faut-il implanter un DCI à titre préventif ? La moitié des patients victimes d'une mort subite n'avait aucun symptôme. L'autre moitié avait fait une syncope ou une présyncope. Après des recherches très approfondies, J. Sieira a mis au point un 'score' permettant d'estimer le risque de mort subite25 (figure 4). Plus le nombre de points est élevé, plus le risque d'arrêt cardiaque dans le futur est élevé. Ce système de stratification du risque est très appréciable, mais il crée un paradoxe flagrant : en classant les patients en groupes à risque faible, moyen et élevé, nous pouvons commettre l'erreur de considérer qu'un risque 'faible' signifie un risque 'nul'. Ainsi, les patients ayant un score faible ne sont pas considérés comme des candidats à protéger par un DCI, et les patients ayant un score élevé sont systématiquement protégés. Paradoxalement, le résultat est que les patients à haut risque, qui sont protégés par le DCI, survivent aux troubles du rythme grâce à la protection de ce DCI, alors que le groupe à faible risque ne survit pas à une éventuelle arythmie, faute de protection par un DCI. Donc, bien que l'incidence de troubles du rythme soit beaucoup plus faible dans le groupe à faible risque, la mortalité y est plus élevée, en raison du manque de protection. Ce paradoxe est illustré à la figure 5.
Conclusion
En 30 ans, nous avons beaucoup appris sur le BrS, mais aussi sur d'autres maladies connexes. Il est clair que la description du BrS a fait entrer le monde de la rythmologie dans une nouvelle dimension.
Références
- Brugada, P., Brugada, J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome. A multicenter report. J Am Coll Cardiol, 1992, 20 (6), 1391-1396. doi: 10.1016/0735-1097(92)90253-j. PMID: 1309182.
- Osher, H.L., Wolff, L. Electrocardiographic pattern simulating acute myocardial injury. Am J Med Sci, 1953, 226, 541-545.
- Antzelevitch, C., Yan G.X., Ackerman M.J. et al. "J-wave syndromes expert consensus conference report: emerging concepts and gaps in knowledge". Heart Rhythm, 2016, 13 (10), e295-e324.
- Probst, V., Goronflot, T., Anys, S., Tixier, R., Briand, J., Berthome, P. et al. Robustness and relevance of predictive score in sudden cardiac death for patients with Brugada syndrome. Eur Heart J, 2021, 42 (17), 1687-1695. doi: 10.1093/eurheartj/ehaa763. PMID: 33289793.
- Antzelevitch, C. In vivo human demonstration of phase 2 reentry. Heart Rhythm, 2005, 2 (8), 804-806. doi: 10.1016/j. hrthm.2005.05.013
- Lerman, B.B., Dong, B., Stein, K.M., Markowitz, S.M., Linden, J., Catanzaro, D.F. Right ventricular outflow tract tachycardia due to a somatic cell mutation in G protein subunitalphai2. J Clin Invest, 1998, 101 (12), 2862-2868. doi: 10.1172/JCI1582. PMID: 9637720; PMCID: PMC508877.
- Rodríguez-Mañero, M., Casado-Arroyo, R., Sarkozy, A., Leysen, E., Sieira, J.A., Namdar, M. et al. The clinical significance of pregnancy in Brugada syndrome. Rev Esp Cardiol (Engl Ed), 2014, 67 (3), 176-180.
- Priori, S.Q., Napolitano, C., Giordano, U., Collisani, G., Memmi, M. Brugada syndrome and sudden death in children. The Lancet, 2000, 355 (9206), 808-809. doi: https://doi. org/10.1016/S0140-6736(99)05277-0
- Abdelghani, M.S., Chapra, A., Asaad, N., Hayat, S.A. Epilepsy and Brugada Syndrome: Association or Uncommon Presentation? Heart Views, 2020, 21 (2), 114-117. doi: 10.4103/HEARTVIEWS.HEARTVIEWS_34_20. Epub 2020 Jun 29. PMID: 33014305; PMCID: PMC7507913.
- www.crediblemeds.org
- www.brugadadrugs.org
- Papadakis, M., Papatheodorou, E., Mellor, G., Raju, H., Bastiaenen, R., Wijeyeratne, Y. et al. The Diagnostic Yield of Brugada Syndrome After Sudden Death With Normal Autopsy. J Am Coll Cardiol, 2018, 71 (11), 1204-1214. doi: 10.1016/j.jacc.2018.01.031. PMID: 29544603.
- Semsarian, C., Ingles, J. Molecular autopsy in victims of inherited arrhythmias. J Arrhythm, 2016, 32 (5), 359-365. doi: 10.1016/j. joa.2015.09.010. Epub 2015 Nov 19. PMID: 27761159; PMCID: PMC5063264.
- https://www.rivm.nl › bevolkingsonderzoekdarmkanker
- Sarto, P., Zorzi, A., Merlo, L., Vessella, T., Pegoraro, C., Giorgiano, F. et al. Serial Versus Single Cardiovascular Screening of Adolescent Athletes. Circulation, 2021, 143 (17), 1729-1731. doi: 10.1161/ CIRCULATIONAHA.120.053168. Epub 2021 Apr 26. PMID: 33900830; PMCID: PMC8061335
- Veerakul, G., Nademanee, K., What is the sudden Death syndrome in South-east Asia males? Cardiology in Review, 2000, 8, 90-95.
- Makarawate, P., Glinge, C., Khongphatthanayothin, A., Walsh, R., Mauleekoonphairoj, J., Amnueypol, M. et al. Common and rare susceptibility genetic variants predisposing to Brugada syndrome in Thailand. Heart Rhythm, 2020, 17 (12), 2145-2153. doi: 10.1016/j.hrthm.2020.06.027. Epub 2020 Jun 30. PMID: 32619740.
- Mirrakhimov, A.E., Voore, P., Halytskyy, O., Khan, M., Ali, A.M. Propofol infusion syndrome in adults: a clinical update. Crit Care Res Pract, 2015, 2015, 260385. doi: 10.1155/2015/260385
- Shimizu, W., Antzelevitch, C., Suyama, K., Kurita, T., Taguchi, A., Aihara, N. et al. Effect of sodium channel blockers on ST segment, QRS duration, and corrected QT interval in patients with Brugada syndrome. J Cardiovasc Electrophysiol, 2000, 11 (12), 1320-132.
- Flamée, P., De Asmundis, C., Bhutia, J.T., Conte, G., Beckers, S., Umbrain, V. et al. Safe single-dose administration of propofol in patients with established Brugada syndrome: a retrospective database analysis. Pacing Clin Electrophysiol, 2013, 36 (12), 1516-21. doi: 10.1111/pace.12246. Epub 2013 Aug 16. PMID: 23952345.
- Nademanee, K., Veerakul, G., Chandanamattha P. et al. Prevention of ventricular fibrillation episodes in Brugada syndrome by catheter ablation over the anterior right ventricular outflow tract epicardium. Circulation, 2011, 123, 1270-1279.
- Conte, G., de Asmundis, C., Ciconte, G. et al. Follow-up From Childhood to Adulthood of Individuals With Family History of Brugada Syndrome and Normal Electrocardiograms. JAMA, 2014, 312 (19), 2039-2041. doi: 10.1001/jama.2014.13752
- Matsuo, K., Akahoshi, M., Seto, S., Yano, K. Disappearance of the Brugada-type electrocardiogram after surgical castration: a role for testosterone and an explanation for the male preponderance. Pacing Clin Electrophysiol, 2003, 26 (7 Pt 1), 1551-1553. doi: 10.1046/j.1460-9592.2003.t01-1-00227.x. PMID: 12914638.
- Brugada, C., Hellemans, A., Brugada, P., Smets, P. Sudden cardiac death: A comparative review of humans, dogs and cats. The Veterinary Journal, 2021, 274. 105696. 10.1016/j.tvjl.2021.105696.
- Sieira, J., Conte, G., Ciconte, G., Chierchia, G-B., Casado-Arroyo, R., Baltogiannis, G. et al. A score model to predict risk of events in patients with Brugada Syndrome, Eur Heart J, 2017, 38 (22) 1756-1763. https://doi.org/10.1093/eurheartj/ehx119
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.