Symposium tijdens Heart Failure 2018 26-29/05/2018 Vienna
Dit artikel vormt een verslag van de 'Iron Deficiency' sessie op zaterdag 26/05/2018. Tijdens deze sessie spraken dr. P. Van Der Meer, prof. dr. E. A. Jankowska, prof. dr. S. D. Anker en prof. dr. C. S. P. Lam over ijzerdeficiëntie als comorbiditeit bij patiënten met hartfalen, over het belang van correcte diagnostiek en behandeling en er was een praktische voorstelling over de aanpak van ijzerdeficiëntie bij patiënten met hartfalen in de klinische praktijk.
IJzermetabolisme
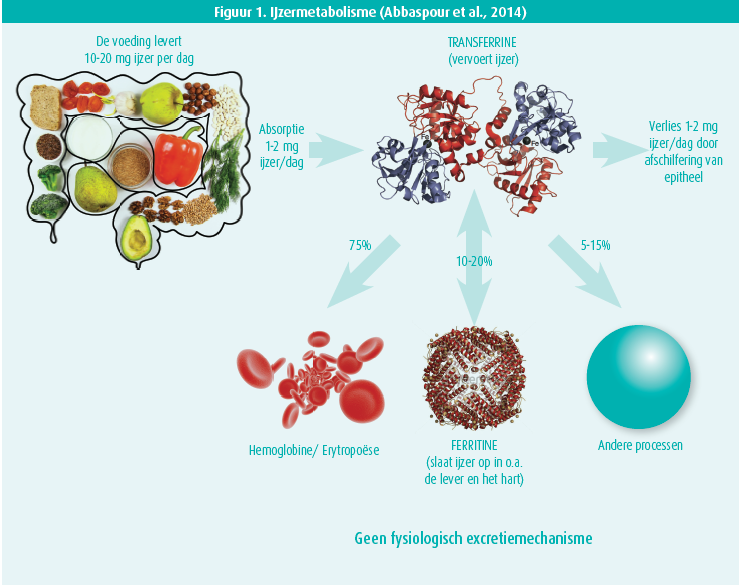
De dagelijkse aanvoer van ijzer via ons dieet bedraagt ongeveer tien tot twintig milligram. Hiervan wordt één tot twee milligram per dag opgenomen, voornamelijk door de enterocyten in het duodenum en het proximale jejunum (figuur 1). Vervolgens wordt ijzer getransfereerd naar het bloed waar het via transferrine getransporteerd wordt naar onder andere het beenmerg. Zo zal 75 % van het opgenomen ijzer gebruikt worden voor de synthese van hemoglobine en voor de erythropoëse, 10-20 % wordt onder de vorm van ferritine opgeslagen onder meer in de lever en het hart. De overige 5-15 % wordt voor andere processen gebruikt. Er bestaat geen fysiologisch excretiemechanisme voor ijzer; uiteindelijk gaat per dag één tot twee milligram verloren via desquamatie van epitheel. Bloedingen vormen een andere voorname oorzaak van ijzerverlies.1
IJzerdeficiëntie als comorbiditeit
IJzerdeficiëntie is wereldwijd de frequentste oorzaak van anemie, en anemie werd reeds eerder al beschreven als onafhankelijke predictor voor een slechtere prognose in patiënten met hartfalen (HF).2 In een internationale cohorte van 1 506 patiënten met chronisch HF bleek tot 50 % van de patiënten een ijzertekort te hebben; van deze patiënten had slechts 34 % gelijktijdig een anemie.3 IJzerdeficiëntie draait dus om meer dan hemoglobine alleen.
In patiënten met chronisch HF bleken een hogere NYHA-klasse, hogere NT-proBNP-levels, een lager mean corpuscular volume en vrouwelijk geslacht krachtige, onafhankelijke predictoren van ijzertekort te zijn. IJzerdeficiëntie op zich bleek een belangrijke, onafhankelijke predictor van mortaliteit te zijn, met een grotere predictieve waarde dan anemie.3 Naast het gelijktijdig voorkomen van ijzerdeficiëntie met anemie in patiënten met HF, komt het ook vaak samen voor met chronische nierinsufficiëntie. Als de 3 comorbiditeiten gelijktijdig aanwezig zijn, wordt dit ook wel het 'cardiorenaal anemiesyndroom' genoemd. De prognose is slechter wanneer ijzerdeficiëntie met één of beide comorbiditeiten gepaard gaat.4
Vormen van ijzerdeficiëntie
Er worden twee vormen van ijzerdeficiëntie onderscheiden; een absoluut en een functioneel ijzertekort. Het absoluut ijzertekort bij HF kan veroorzaakt worden door een vermindering van de ijzeropslag door gastro-intestinaal bloedverlies (bv. ten gevolge van het gebruik van antiaggregantia, anticoagulantia of NSAID's), door malabsorptie (bv. gastro-intestinaal oedeem, inname van protonpompinhibitoren), of ten gevolge van malnutritie. Het functioneel ijzertekort bij HF kan ontstaan door een verminderde mobilisatie van ijzer bij inflammatie met hepcidineoverproductie en vrijstelling van pro-inflammatoire mediatoren (bv. IL-6).5
Gevolgen van ijzertekort bij patiënten met hartfalen
IJzertekort bij HF-patiënten leidt tot verminderde inspanningstolerantie (lagere VO2-peak), een slechtere prognose en gaat gepaard met meer depressies en verminderde kwaliteit van leven.3, 5, 6 De verminderde inspanningstolerantie wordt veroorzaakt door het effect van ijzer op het mitochondriaal metabolisme, ijzer is namelijk essentieel voor de vorming van ATP.7, 8 IJzertekort leidt daardoor tot verminderde contractiliteit van de cardiomyocyten. 7
Diagnostiek en behandeling van ijzerdeficiëntie bij HF-patiënten
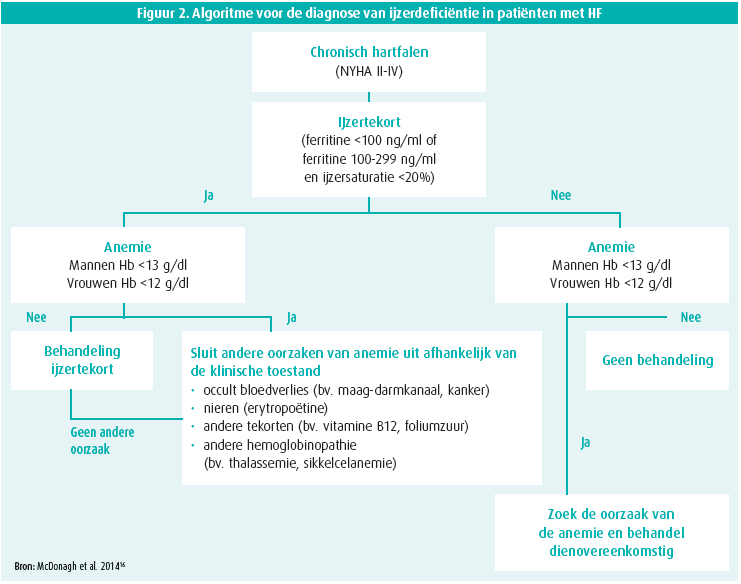
Men spreekt over ijzerdeficiëntie wanneer het ferritine < 100 μg/L of wanneer het ferritine 100-299 μg/L én de transferrine saturatie (TSAT) < 20 %.5 Anderzijds is ferritine ook een acutefase- eiwit. Bijgevolg kan bij patiënten met HF die in een toestand van chronische laaggradige inflammatie verkeren het ferritine normaal zijn, terwijl er wel een ijzertekort is.9, 10
De richtlijn over diagnostiek beveelt aan om alle patiënten met HF te screenen voor ijzerdeficiëntie d.m.v. serumferritine en TSAT-bepaling, dit is een klasse I-aanbeveling.11 Men adviseert om symptomatische patiënten met HFrEF en ijzerdeficiëntie te behandelen zodat de HF-symptomen, inspanningscapaciteit en kwaliteit van leven verbeteren (klasse IIa-aanbeveling) d.m.v. intraveneus (IV) ijzer (Ferric Carboxymaltose, FCM).11 Deze aanbeveling kwam tot stand op basis van de resultaten van de FAIRHF-12 en de CONFIRM-HF-trial13. In de FAIR-HF-trial verbeterde het zelfgerapporteerde 'patient global assessment' en de NYHA-klasse na 24 weken significant ten opzichte van de placebogroep, en dit zowel in ijzerdeficiënte HFrEF-patiënten met én zonder anemie.12 Orale ijzersupplementatie wordt niet aanbevolen. In de IRONOUT HF Randomized Clinical Trial werd geen verbetering van de inspanningscapaciteit na 16 weken orale ijzerbehandeling geobserveerd.14 Het bereiken van een volwaardige ijzersubstitutie met orale therapie duurt maanden; intraveneuze behandeling werkt vele malen sneller.
Veiligheid van IV-ijzerbehandeling
In een recente meta-analyse door Anker et al. werden de individuele patiëntendata van 4 dubbelblinde FCM-trials (Fer-CARS-01, FAIR-HF, EFFICACY-HF en CONFIRM-HF), goed voor een totaal van 839 patiënten, bestudeerd.15 Er werd een significante reductie in recurrente CV-hospitalisaties en CV-mortaliteit vastgesteld (p = 0,009). Ook recurrente HF-hospitalisaties en CV-mortaliteit (p = 0,011), recurrente CV-hospitalisaties en all cause- mortaliteit (p = 0,009) en recurrente HF-hospitalisaties en all cause-mortaliteit (p = 0,011) was significant lager in de FCM-groep. All cause-hospitalisatie en all cause-mortaliteit was niet significant verschillend tussen beide groepen (p = 0,06). Er waren eveneens significant minder HF-hospitalisaties (p = 0,003) en CV-hospitalisaties (p = 0,004) in de FCM-groep. All cause-hospitalisatie was niet significant verschillend (p = 0,056).15
Concreet: Praktische behandeling van hartfalenpatiënten met ijzerdeficiëntie - door prof. dr. C. S. P. Lam
Screenen: wanneer en wie?
- Diagnostische oppuntstelling bij alle nieuwe diagnoses van HF (klasse I-aanbeveling).11
- Persoonlijke opinie van prof. Lam: ijzerstatus min. 1 keer per jaar controleren in patiënten met reeds gekend HF, zeker wanneer ze symptomatisch zijn.
Behandelen: wanneer en wie?
IV ijzer (FCM) in symptomatische HFrEF-patiënten met ijzerdeficiëntie om HF-symptomen, inspanningscapaciteit en kwaliteit van leven te verbeteren (klasse IIa-aanbeveling).11
Behandelen: hoe?
- De initiële ijzerbehoefte moet berekend worden o.b.v. het lichaamsgewicht en het hemoglobinegehalte (details in bijsluiters van FCM).
- FCM mag IV gegeven worden als een onverdunde bolusinjectie of als een verdunde infusie (details in bijsluiters van FCM).
- De maximale aanbevolen cumulatieve dosis van FCM is 1000 mg ijzer per week.
Opvolgen van ijzerstatus, wanneer en hoe vaak?
Hier bestaan geen concrete richtlijnen over. Prof. Lam adviseert om de ijzerstatus 3 maanden na IV toediening opnieuw te evalueren. Indien onvoldoende gecompenseerd, dient verdere ijzertoediening te worden voorzien en moet bloedverlies uitgesloten worden. Vroegtijdige evaluatie van de ijzerstatus (binnen de 4 weken na IV ijzertoediening) dient te worden vermeden; het ferritinegehalte zal fors verhoogd zijn en is op dit tijdstip dus geen goede indicator van de ijzerstatus. Overweeg om de ijzerstatus routinematig te evalueren bij patiënten met gekend HF (1 à 2 keer per jaar) of wanneer symptomen aanhouden ondanks optimale medicamenteuze behandeling van hartfalen.
Conclusie
Tot 50 % van de patiënten met hartfalen heeft ijzerdeficiëntie en dit leidt tot een verminderde inspanningstolerantie, levenskwaliteit en is geassocieerd met een hogere mortaliteit. Patiënten met hartfalen moeten een gepersonaliseerde behandeling krijgen, afgestemd op hun comorbiditeiten waaronder ijzerdeficiëntie, anemie en nierinsufficiëntie. Behandeling van ijzerdeficiëntie door middel van intraveneus FCM wordt aanbevolen in symptomatische HFrEF-patiënten met ijzerdeficiëntie.
Referenties
- Abbaspour, N., Hurrell, R., Kelishadi, R. Review on iron and its importance for human health. J Research Med Sci, 2014, 19 (2), 164-174.
- Szachniewicz, J., Petruk-Kowalczyk, J., Majda, J., Kaczmarek, A., Reczuch, K., Kalra PR, et al. Anaemia is an independent predictor of poor outcome in patients with chronic heart failure. Int J Cardiol, 2003, 90, 303-308.
- Klip, I.T., Comin-Colet, J., Voors, A.A., Ponikowski, P., Enjuanes, C., Banasiak, W., et al. Iron deficiency in chronic heart failure: An international pooled analysis. Am Heart J, 2013, 165 (4), 575-582.e3.
- Klip, I.T., Jankowska, E.A., Enjuanes, C., Voors, A.A., Banasiak, W., Bruguera, J., et al. The additive burden of iron deficiency in the cardiorenal-anaemia axis: scope of a problem and its consequences. Eur J Heart Fail, 2014, 16 (6), 655-662.
- Jankowska, E.A., Haehling von, S., Anker, S.D., Macdougall, I.C., Ponikowski, P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J, 2013, 34 (11), 816-829.
- Enjuanes, C., Klip, I.T., Bruguera, J., Cladellas, M., Ponikowski, P., Banasiak, W. et al. International Journal of Cardiology. International Journal of Cardiology. Elsevier Ireland Ltd; 2014, 174 (2), 268-275.
- Hoes, M.F., Grote Beverborg, N., Kijlstra, J.D., Kuipers, J., Swinkels, D.W., Giepmans, B.N.G. et al. Iron deficiency impairs contractility of human cardiomyocytes through decreased mitochondrial function. Eur J Heart Fail, 2018, 20 (5), 910-919.
- Andrews, N.C. Disorders of Iron Metabolism. New Engl J Med, 1999, 341 (26), 1-10.
- Wish, J.B. Assessing Iron Status: Beyond Serum Ferritin and Transferrin Saturation. Clin J Am Soc Nephrol, 2006, (Supplement 1), S4-S8.
- Nanas, J.N., Matsouka, C., Karageorgopoulos, D., Leonti, A., Tsolakis, E., Drakos, S.G. et al. Etiology of Anemia in Patients With Advanced Heart Failure. J Am Coll Cardiol, 2006, 48 (12), 2485-2489.
- Ponikowski, P., Voors, A.A., Anker, S.D., Bueno, H., Cleland, J.G.F., Coats, A.J.S., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J, 2016, 37 (27), 2129-2200.
- Anker, S.D., Comin-Colet, J., Filippatos, G., Willenheimer, R., Dickstein, K., Drexler, H., et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency. N Engl J Med, 2009, 361 (25), 2436-2448.
- Ponikowski, P., van Veldhuisen, D.J., Comin-Colet, J., Ertl, G., Komajda, M., Mareev, V. et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J, 2015, 36, 657-668.
- Lewis, G.D., Malhotra, R., Hernandez, A.F., McNulty, S.E., Smith, A., Felker, G.M. et al. Effect of Oral Iron Repletion on Exercise Capacity in Patients With Heart Failure With Reduced Ejection Fraction and Iron Deficiency. JAMA, 2017, 16, 317 (19), 1958.
- Anker, S.D., Kirwan, B.-A., van Veldhuisen, D.J., Filippatos, G., Comin-Colet, J., Ruschitzka, F. et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in iron-deficient heart failure patients: an individual patient data meta-analysis. Eur J Heart Fail, 2017, 20 (1), 125-133.
- McDonagh, T., Macdougall, I.C. Iron therapy for the treatment of iron deficiency in chronic heart failure: intravenous or oral? Eur J Heart Fail, 2015, 17 (3), 248-2462.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.