Het primaire doel van een LVAD is om een adequaat circulatoir debiet te genereren en de vullingsdrukken te doen dalen bij patienten met eindstadium hartfalen. Het rechter ventrikel blijft echter de zwakste schakel en is dus ook de limiterende pomp van het systeem.
Inleiding
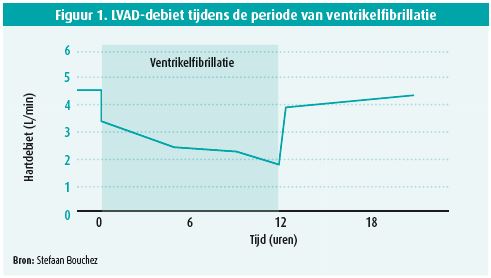
Een bewuste, aanspreekbare man wiens interne defibrillator ettelijke malen had afgevuurd, meldde zich aan op de Spoedgevallendienst. Tijdens het klinisch onderzoek konden geen perifere pulsaties gedetecteerd worden en het ecg vertoonde ventrikelfibrillatie (VF). Dat was op zijn minst een zéér merkwaardige en verontrustende toestand ... Deze patiënt bleek ongeveer een jaar geleden een implantatie van een linkerventrikelassistdevice (LVAD) te hebben ondergaan. Er werd besloten de patiënt op te nemen op Intensieve zorgen en hem te sederen in het vooruitzicht van een poging tot externe defibrillatie. Verschillende defibrillatiepogingen bleken onsuccesvol, zelfs na toediening van amiodaron. Zijn hartdebiet (figuur 1) daalde progressief tijdens de VF-periode. Na een periode van bijna 14 uur aanhoudende ventrikelfibrillatie werd overwogen om bij de patiënt extracorporele membraanoxygenatie toe te passen. Een laatste poging tot defibrillatie, ditmaal na toediening van esmolol, was wel succesvol. De echocardiografische opvolging toonde initieel een sterk gedaalde rechterventrikelfunctie die langzaam maar zeker herstelde in de daaropvolgende uren en dagen1.
Bij ongeveer 1 op de 3 patiënten op de wachtlijst voor harttransplantatie wordt een LVAD geïmplanteerd. Dit apparaat ondersteunt niet alleen de circulatie zodat er wat meer tijd wordt gewonnen tot er een hart beschikbaar wordt ('bridge to transplantation'), maar het verbetert tevens verschillende orgaansystemen en de levenskwaliteit. Het gunstige effect van de LVAD op de organen zorgt ervoor dat de patiënt in een betere conditie een transplantatie kan ondergaan. Echocardiografie bij patiënten met een LVAD is cruciaal voor het stellen van de indicatie, voor de begeleiding en optimalisatie van de LVAD-ondersteuning tijdens de implantatieprocedure en bij de diagnostiek van complicaties. De inhoud van dit artikel is gebaseerd op een overzichtsartikel dat eerder dit jaar werd gepubliceerd2.
Echocardiografie bij LVAD: de essentie
1 LVAD-fysiologie
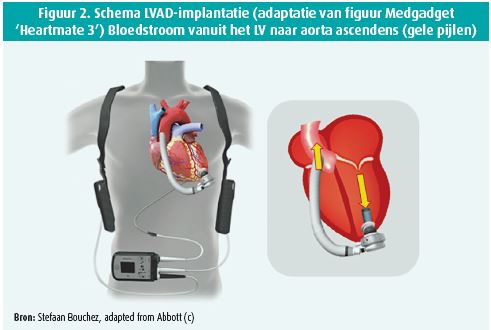
Een LVAD-apparaat is een centrifugaalpomp die bloed aanzuigt uit het linker ventrikel (LV) en het verder pompt naar de aorta via een buisprothese (figuur 2).
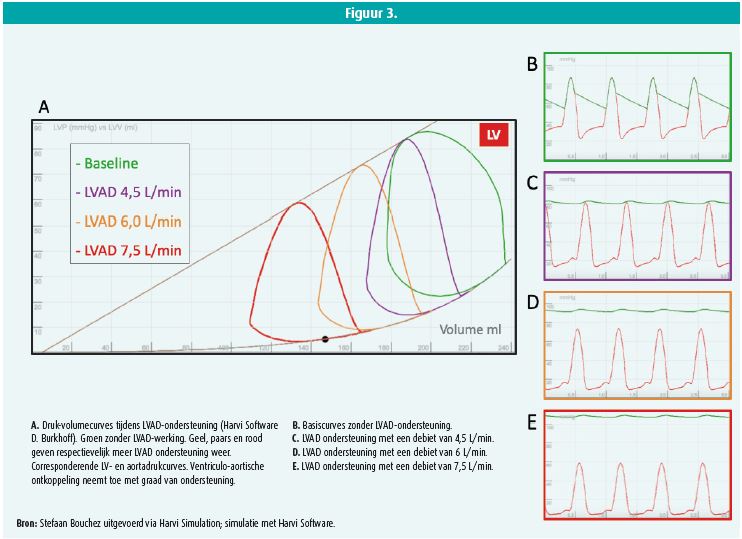
Daardoor daalt de intraventriculaire druk in het LV en stijgt de druk in de systeemcirculatie; met andere woorden: er treedt een ventriculo-aortische ontkoppeling op (figuur 3)3. Door de continue bloedstroom van de LVAD en het wegvallen van de eigen ejectie is er geen pulsatiliteit in het vasculair systeem aanwezig. Het debiet dat de LVAD kan genereren hangt af van verschillende factoren waarvan de vulling of preload van het LV, de rotatiesnelheid van de LVAD en de bloeddruk de belangrijkste zijn. Voldoende preload wordt grotendeels bepaald door de performantie van het rechter ventrikel (RV) terwijl een hoge arteriële bloeddruk de ejectie doorheen de LVAD remt. Een veelvoorkomende fout is een te snel opvoeren van de rotaties van de LVAD waardoor het LV te veel wordt gedraineerd. Door de interventriculaire interactie treedt er een shift van het interventriculair septum naar links wat de functie van het RV sterk compromitteert.
2 Preoperatieve echocardiografie
Het echocardiografisch onderzoek bij de indicatiestelling als voorbereiding van de ingreep omvat allereerst de evaluatie van de LV- en RV-functie. Daarnaast is het noodzakelijk om na te kijken of er een persisterend foramen ovale (PFO) of een intracardiale trombus aanwezig is. De sterke aanzuigkracht van de LVAD zorgt voor een rechts-linksshunt in het kader van een PFO of een embolisatie naar de aorta bij intracardiale trombi. Om een onbelemmerde en vooral voldoende flow naar de LVAD te verzekeren moet eveneens mitralisstenose uitgesloten worden. Als een meer dan minimale aorta-insufficiëntie of meer dan matige tricuspidalisinsufficiëntie (TI) aanwezig blijkt te zijn, zal klepchirurgie worden overwogen tijdens de implantatieprocedure. Een aorta-insufficiëntie zal een deel van het LVAD-debiet terugshunten naar het LV wat het effectieve systemische debiet doet dalen. Een matige tricuspidalisinsufficiëntie zal worden hersteld, indien geassocieerd met pulmonale hypertensie en een gedilateerde annulus. Een ernstige TI benadeelt de efficiëntie van het RV om voldoende debiet te leveren aan het LV en doet tevens de veneuze vullingsdrukken stijgen wat de lever- en nierfunctie nadelig beïnvloedt.
3 Perioperatieve echocardiografie
Het perioperatieve echocardiografische onderzoek richt zich niet alleen op het LVAD-apparaat zelf maar vooral op de omgevende structuren zoals het LV en het RV. Het RV is de limiterende pomp van het systeem. Het debiet dat door het RV wordt gegenereerd, stijgt niet door de LVAD-pompkracht op te drijven, integendeel zelfs.
De apicale canule wordt geïmplanteerd in de apex van het LV en wordt gepositioneerd in de richting van de mitralisklep. De positie van deze canule wordt het best geëvalueerd met kleurendoppler in het 'Mid-Esophageal'(ME) -vierkamerbeeld. De stroom moet laminair zijn naar de canule toe. De pulsed wave-doppler van de apicale canule toont lage snelheden met een bifasisch patroon van systolische en diastolische snelheden.
Snelheden hoger dan 1,5 m/s kunnen een indicatie zijn voor een obstructie ter hoogte van de canule. De evaluatie van de snelheden bij het Heartware-systeem is moeilijk gezien de artefacten in het dopplerpatroon.
De uitstroomgreffe wordt gehecht op de aorta ascendens en wordt echocardiografisch opgespoord met kleurendoppler in het ME-langeasbeeld. Continuous wave-doppler van de uitstroomgreffe vertoont eveneens een bifasisch patroon maar met een dominante diastolische snelheid. Dit dopplerpatroon wijzigt onder invloed van de rotaties en de preload van het LV. Een puur diastolisch patroon duidt op een te hoge rotatiesnelheid van de LVAD voor de preload aanwezig op dat moment. Tijdens de evaluatie van de uitstroomgreffe wordt ook de aortaklep geëvalueerd. Bij een optimale werking van de LVAD opent de aortaklep zich eens om de 2 à 3 cycli. Een continu gesloten aortaklep duidt meestal op een te forse pompfunctie van de LVAD.
Het RV is de limiterende pomp tijdens LVAD-ondersteuning en zodoende de belangrijkste determinant voor een succesvol LVAD-verloop. Er bestaat echter geen echocardiografische 'heilige graal' voor de predictie van de rechterventrikelfunctie tijdens LVAD-ondersteuning. In de meeste centra worden in eerste instantie de dimensies van het RV vergeleken met die van het LV. Daarnaast wordt uiteraard ook de functie geëvalueerd. Voor dit laatste worden TAPSE (Tricuspid Plane Annular Excursion) en meer recent ook strain gebruikt. De kans is groot dat mechanische RV-ondersteuning nodig is bij de combinatie van een sterk gedilateerd RV met een sterk gedaalde functie. Een goede predictor voor RV-falen blijkt de tijdsduur van de tricuspidalisinsufficiëntie te zijn maar dan wel gecorrigeerd voor de hartfrequentie. Een RV waarbij de TI-duur meer dan 461 ms bedraagt, lijkt performanter te zijn dan wanneer lagere waarden worden gemeten.
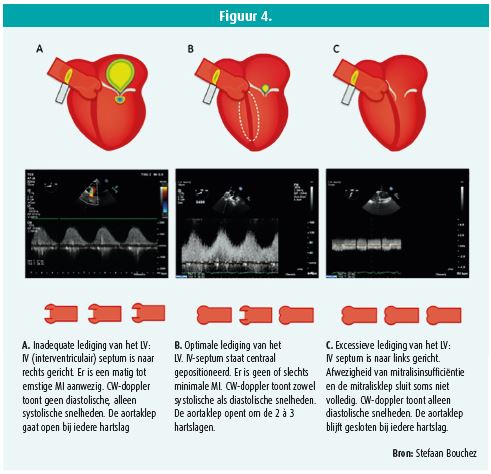
Het primaire doel van een LVAD is om een adequaat circulatoir debiet te genereren en de vullingsdrukken te doen dalen. Een optimaal debiet kan echter maar ontstaan mits voldoende aanbod of, met andere woorden, voldoende LV-preload. Enkele belangrijke aanbevelingen bij de echocardiografische evaluatie van LV-preload (figuur 4):
- De evaluatie van de positie van het interventriculair septum is kritiek. Dit moet gecentreerd staan tussen het RV en het LV. Bij inadequate ontlasting van het LV zal het septum naar rechts verplaatst zijn, terwijl bij excessieve ontlasting het septum wordt aangezogen naar links. Een linkse shift ondermijnt de functie van het RV waardoor de LV-preload nog meer in het gedrang komt.
- Gezien de LV-dilatatie en -disfunctie is mitralisinsufficiëntie meestal aanwezig. Door de LVAD-werking daalt de intraventriculaire druk, alsook de dimensie van het LV waardoor de mitralisinsufficiëntie quasi volledig verdwijnt. De aanwezigheid van meer dan milde mitralisinsufficiëntie tijdens de LVAD-werking duidt op een onvoldoende ontlasting door de LVAD en is een indicatie dat LVAD-rotaties verhoogd mogen worden.
- Bij een optimale LVAD-werking opent de aortaklep eenmaal om de 2 à 3 hartcycli. Een opening van de aortaklep bij elke hartslag betekent onvoldoende ontlasting van het LV. Een continu gesloten aortaklep suggereert een te forse LVAD-werking voor de aanwezige preload op dat moment. Dit treedt dus op bij een te lage LV-preload of bij bijna afwezige natieve LV-contractiliteit.
- Het dopplerpatroon van de uitstroomgreffe ter hoogte van de aorta ascendens zal bij een optimale werking hoofdzakelijk een diastolische stroom weergeven met een systolische component erbovenop. Als alleen een diastolische flow aanwezig is, duidt dit op een te forse ontlasting voor de momentane LV-preload. Dikwijls betekent dit dat de rotaties te hoog staan ingesteld maar uiteraard moet de oorzaak van een gedaalde preload onderzocht worden. Dit kan hypovolemie zijn maar eveneens een gevolg van rechterventrikelfalen.
4 Postoperatieve echocardiografie
Het postoperatief echocardiografisch onderzoek verifieert of de LVAD naar behoren werkt en sluit eventuele complicaties uit. Tamponnade en RV-falen zijn de twee belangrijkste complicaties onmiddellijk na de implantatie. In tegenstelling tot het klassieke echocardiografische beeld van een tamponnade waarbij vooral de rechterzijde wordt aangedaan, kunnen collecties zich ook aan de linkerzijde presenteren door de lagere drukken in de LV-caviteit.
In een later stadium kunnen ritmestoornissen eveneens optreden. Hemodynamisch belangrijke ritmestoornissen komen voor in 1 op de 3 patiënten en dit vooral tijdens de eerste maand na implantatie. Uiteraard kunnen ritmestoornissen ook later optreden zoals bij de patiënt vermeld in de inleiding.
Referenties
- Bouchez, S., De Somer, F., Herck, I. et al. Shock-refractory ventricular fibrillation in a patient implanted with a left ventricular assist device. Resuscitation, 2016, 107, e 1-2.
- Bouchez, S., Van Belleghem, Y., De Somer, D.F. et al. Haemodynamic management of patients with left ventricular assist devices using echocardiography: the essentials. Eur Heart J Cardiovasc Imaging, 2019, 20 (4), 373-382.
- Burkhoff, D., Sayer, G., Doshi, D., Uriel, N. Hemodynamics of mechanical circulatory support. J Am Coll Cardiol, 2015, 66, 2663-2674.
Niets van de website mag gebruikt worden voor reproductie, aanpassing, verspreiding, verkoop, publicatie of commerciële doeleinden zonder voorafgaande schriftelijke toestemming van de uitgever. Het is ook verboden om deze informatie elektronisch op te slaan of te gebruiken voor onwettige doeleinden.